乳腺癌C-erbB-2表达在新辅助化疗疗效中的预见性
蔡 媛 乔红梅 郑 甦 冯建丽 车潇良 马 蓉
原癌基因Her - 2 /neu(C - erbB2)是人类表皮生长因子受体家族的第2个成员,该家族中的受体均位于细胞膜上,在许多组织中都能发现。研究表明C-erbB-2过表达可导致乳腺上皮细胞的恶性转化,增加肿瘤细胞的侵袭性,并对某些化疗药物耐药[1]。本研究通过检测化疗前后乳腺癌组织中C-erbB-2的表达,以了解化疗是否会影响C-erbB-2的表达;同时对新辅助化疗的疗效与C-erbB-2的表达的相关性进行评测,以证实C-erbB-2在乳腺癌新辅助化疗疗效预测中的价值。
1 材料与方法
1.1 一般资料
选择我院2008年1月~2009年9月间满足以下条件的53例乳腺癌患者:①化疗前通过细针穿刺活检首次确诊为乳腺癌,并行C-erbB-2检测;②临床Ⅱ、Ⅲ期患者;③肿瘤病灶大小可以检测;④无治疗史;⑤心、肝、肾功能正常。初期检查包括:体检、乳腺钼靶及B超,部分行乳腺MRI检查,常规行肝肾功能、心电图、血常规、胸片或胸部CT、肝脏超声检查及全身骨扫描,部分患者加作胸部CT。原始肿瘤的大小通过乳腺B超或钼靶测量,淋巴结转移的情况通过体检及乳腺钼靶、超声或CT 的检查获得,每个化疗周期结束后均重复进行以上检查项目来评估化疗反应。
所有患者均为女性,年龄38~65岁,中位年龄49岁。组织学类型:浸润性导管癌46例,小管癌1例,浸润性小叶癌2例,黏液癌3例,微乳头状癌1例。临床分期均为Ⅱa以上。化疗统一为2个周期,化疗根据不同患者的身体状况及经济情况给予不同化疗方案,有以下几种:主要选择以含恩环类的联合化疗方案,部分与紫杉类联合,仅1例给予CMF(环磷酰胺、甲氨蝶呤、氟尿嘧啶)方案。第1个周期结束后经评价化疗无效的患者更改化疗方案重新进入评价程序或改变总体治疗计划,改用手术、放疗等。
1.2 方法
1.2.1 试剂 鼠抗人C-erbB-2单抗及其免疫组化试剂盒、DAB显色试剂盒均购自福建MAXin- Bio公司。
1.2.2 免疫组织化学方法 应用Elivision免疫组化法分别测定化疗前、后乳腺癌组织中C-erbB-2的表达。全部病例术前作细针穿刺活检或肿物切取活检,获取的标本经10%中性甲醛固定,石蜡包埋,4 μm 厚切片,用于常规及C-erbB-2的检测。组织经二甲苯脱蜡,梯度酒精至水化,pH 6.0柠檬酸缓冲液进行高温高压抗原修复,滴加相应一抗,室温下孵育1 h,PBS冲洗,加生物素标记的二抗,37℃30 min,PBS冲洗,DAB染色,苏木精复染,脱水,透明,封片。以PBS代替一抗作为阴性对照,用试剂盒已知阳性片或组织内残存的正常乳腺组织作阳性对照。
1.2.3 结果判定 根据美国癌症联合委员会(AJCC)乳腺癌TNM分期第6版对肿瘤进行临床分期。根据Miller and payer分级对化疗后的反应情况进行分类:完全无反应、病理缓解(包括部分缓解及完全缓解)、病理完全缓解。病理完全缓解(pathologic complete response,PCR)指乳腺及腋窝组织中均无浸润性癌,残留的导管原位癌包括在PCR范畴中。
所有的免疫组化染色切片均采用光学显微镜进行观察,并由两位高年资病理主治医师双盲法读片。C-erbB-2阳性物质定位于细胞膜。按阳性细胞数的所占比例以及染色程度分为4级:(-)为<10%肿瘤细胞染色或无染色;(+)为≥10%的肿瘤细胞胞膜不连续、较弱的淡黄色;(++)为≥10%的肿瘤细胞胞膜连续的染色,呈黄或深黄色;(+++)为≥50%的肿瘤细胞胞膜连续染色,呈棕黄色。阳性判断标准:其中将(-)、(+)定为C-erbB-2(-),(++)、(+++)定为C-erbB-2( + )。
1.3 统计学处理
组间差异性比较采用卡方检验或精确概率法。所有数据采用SPSS15.0统计软件包进行分析处理。
2 结果
2.1 新辅助化疗的疗效
53例乳腺癌患者新辅助化疗后,病理完全无反应的12例(22.6%),病理缓解(包括部分缓解及完全缓解)41例(77.4%),其中病理完全缓解3例(5.7%)。
2.2 新辅助化疗前后C-erbB-2表达变化情况
53例乳腺癌患者中,3例化疗后病理完全缓解无癌组织进行检测,余50例患者中C-erbB-2的变化情况:化疗前后表达一致的43例,一致性为86%;表达发生完全相反改变的是7(14.0%)例,其中由化疗前3例阴性转为化疗后阳性,4例由阳性转为阴性。化疗前后C-erbB-2的表达差异无统计学意义(χ2=0.051,P=0.822)(表1)。
2.3 C-erbB-2阳、阴性组化疗有效率差异比较
C-erbB-2表达阳性的病例化疗有效率为86.7%(13/15)、表达阴性的病例化疗有效率为73.7%(28/38),统计学分析无差异性(P= 0.472)(表2)。
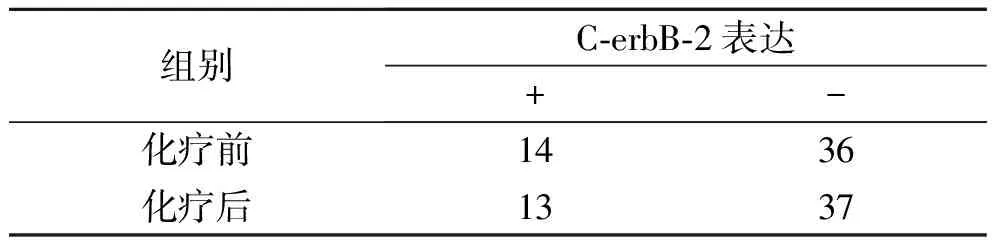
表1 新辅助化疗前后ER、PR、C-erbB-2表达变化的比较(例)

表2 C-erbB-2表达阳性、阴性组化疗有效率差异比较
3 讨论
新辅助化疗是乳腺癌规范化治疗的一部分,研究[2~6]显示其疗效显著。本研究中53例乳腺癌患者新辅助化疗后病理缓解率达77.4%,病理完全缓解率达5.7%。化疗的总有效率与文献研究结果相近,但达到PCR者稍低于国外研究结果(10%~20%)[2~4]。新辅助化疗后达到PCR的比率尽管不高,但研究[2~4]显示达到PCR的患者相对化疗后肿瘤依然有残留的患者其无病生存率及总生存率均明显增加。
新辅助化疗有其不尽人意之处。一些新辅助化疗无效的病例,由于手术治疗时间的推延,使某些原本可经手术切除的肿瘤变为不能切除;化疗会导致肿瘤的真正病理分期变得模糊不清,从而影响后期的治疗以及疗效的评价;临床反应有效的病例又会造成某些肿瘤预后因素信息的丢失,如淋巴结状况与肿瘤大小,有可能导致后期治疗不当。因此能在新辅助化疗前即预知疗效,从而选择敏感病例,并选择适宜药物进行化疗将能弥补其不足,提供乳腺癌个体化治疗的新模式。
目前临床上入选新辅助化疗方案的乳腺癌患者,均需要在化疗前行细针穿刺活检获取病变组织,然后对病变组织分型确诊,同时检测ER、PR、C-erbB2的表达,检测结果将作为后期治疗、评判预后及研究的指标[7]。细针穿刺活检获得的组织,相对于肿瘤而言组织很少,据其检测的结果能否代表整个瘤体的特性呢?Taucher等[8]研究1994~2000年间722例乳腺疾病患者的术前穿刺标本与术后大标本的病理特征及ER、PR的检测情况被对照研究,62.3%(450/722)的病例活检诊断为恶性,术后证实无1例误诊,可见这样的研究基础是可行的。本研究通过测定乳腺癌患者新辅助化疗前后C-erbB-2的表达,结果显示化疗前后C-erbB-2表达的一致性为86%;阳阴性发生改变的是14%,提示新辅助化疗对乳腺癌组织中C-erbB-2的表达无明显影响,以活检标本C-erbB-2的检测结果做研究是可行的,活检标本C-erbB-2的检测结果能代表整个瘤体的特性。已有一些C-erbB-2与新辅助化疗疗效相关性的研究,但结论不一。Miyoshi等[9]对78例患者给予4个周期的多西紫杉醇的新辅助化疗方案后,对照研究了化疗疗效与肿瘤生物因子及病理参数的关系,PCR率的高低与是否绝经、淋巴结转移及ER、PR、c-erbB2、ki-67的表达均无关,仅与乳腺癌细胞核的级别有关,核的级别低者较级别高者PCR率更高。Tiezzi等[10]通过对68例患者行多西紫杉醇、表柔沙星联合化疗,并行多变量分析,只有c-erbB2的高表达与无病生存率、总生存率相关,而ER、PR、P51、P21等的表达及临床病理特征均不能预示化疗的病例缓解率。结论是仅仅c-erbB2的表达对化疗后病例缓解是一重要的预示因子。还有研究显示,c-erbB2在阿霉素和环磷酰胺化疗方案中可提示化疗的疗效,c-erbB2阳性较阴性病例有较高的病例缓解率,但加入多西紫杉醇后c-erbB2阳性、阴性的化疗效果一样[11]。本研究结果显示: C-erbB-2的表达与化疗疗效无相关性,提示C-erbB-2不能作为新辅助化疗疗效的预测因子。依靠靶向因子的表达进行新辅助化疗敏感病例的选择方面可能还需要更多病例研究证实。
[1]高艳伟,高维实,赖玉书,等.Her - 2与乳腺癌研究进展〔J〕.内蒙古医学院学报,2008,30(1):69.
[2]Straver ME,van Adrichem JC,Rutgers EJ,et al.Neoadjuvant systemic therapy in patients with operable primary breast cancer:more benefits than breast-conserving therapy〔J〕.Ned Tijdschr Geneeskd,2008,152(46):2519.
[3]Shien T,Akashi-Tanaka S,Miyakawa K,et al.Clinicopathological features of tumors as predictors of the efficacy of primary neoadjuvant chemotherapy for operable breast cancer〔J〕.World J Surg,2009,33(1):44.
[4]Fuzhong T,Nan L,Jiajia G,et al.Clinical significance of t-he relationship between expression of survivin and effects of neoadjuvant chemotherapy in locally advanced breast cancer〔J〕.Gan To Kagaku Ryoho,2008,35(8):1319.
[5]Rastogi P,Anderson SJ,Bear HD,et al.Preoperative chemotherapy:updates of National Surgical Adjuvant Breast and Bowel Project Protocols B 18 and B 27〔J〕.J Clin Oncol,2008,26(5):778.
[6]熊德海,刘世德,刘 懿.乳腺癌新辅助化疗的非随机临床观察:附76例报告〔J〕.中华内分泌外科杂志,2009,3(2):110.
[7]Kaufmann M,von Minckwitz G,Bear HD,et al.Recommendations from an international expert panel on the use of neoadjuvant(primary)systemic treatment of operable breast cancer:new perspectives 2006〔J〕.Ann Oncol,2007,18:1927.
[8]Taucher S,Rudas M,Gnant M,et al.Sequential steroid hormone receptor measurements in primary breast cancer with and without intervening primary chemotherapy〔J〕.Endocrine-Related Cancer,2003,10(1):91.
[9]Miyoshi Y,Kurosumi M,Kurebayashi J,et al.Low nuclear grade but not cell proliferation predictive of pathological complete response to docetaxel in human breast cancers〔J〕.J Cancer Res Clin Oncol,2008,134(5):561.
[10]Tiezzi DG,Andrade JM,Ribeiro-Silva A,et al.HER-2,p5-3,p21 and hormonal receptors proteins expression as predictive factors of response and prognosis in locally advanced breast cancer treated with neoadjuvant docetaxel plus epirubicin combination〔J〕.BMC Cancer,2007,26(7):36.
[11]Learn PA,Yeh IT,McNutt M,et al.HER-2/neu expression as a predictor of response to neoadjuvant docetaxel in patients with operable breast carcinoma〔J〕.Cancer,2005,103(11):2252.

