甲醇气相羰化合成醋酸的反应机理及本征动力学
刘金红,刘志军,黄艳芳,姚虎卿
(1.南京工业大学化学化工学院,江苏 南京 210009;2.南通职业大学化学工程系,江苏 南通 226007)
甲醇气相羰化合成醋酸的反应机理及本征动力学
刘金红1,2,刘志军2,黄艳芳2,姚虎卿1
(1.南京工业大学化学化工学院,江苏 南京 210009;2.南通职业大学化学工程系,江苏 南通 226007)
用浸渍法制备了负载型 Ni-Mo-La/AC复合催化剂,并在平推流反应器中对甲醇气相羰基化催化反应进行了动力学数据的测定。实验证明,醋酸甲酯是甲醇气相羰基化反应的中间产物,醋酸显示连串反应最终产物的特征,由醋酸甲酯水解生成;二甲醚通过甲醇脱水生成,碘甲烷和活性炭共同对该反应起催化作用,二甲醚可进一步羰化生成醋酸甲酯;甲烷由甲醇分解后的产物氢气与碘甲烷反应生成。根据反应机理建立了幂函数动力学模型,由实验数据线性回归计算得到了动力学参数。
甲醇 醋酸 羰基化 复合催化剂 动力学
醋酸是重要的有机化工原料,目前工业生产醋酸的主要技术路线是甲醇液相羰基化合成法。气相羰基化法在设备腐蚀、催化剂成本、反应条件等显示了液相羰基化无法比拟的优势,自20世纪70年代以来,甲醇气相羰基化催化体系的研究引起了国内外的关注[1-3],而仅有少量关于甲醇气相羰化合成醋酸及醋酸甲酯的反应机理及动力学报道[3,4]。日本学者Omata K等[3]的研究表明,醋酸甲酯和二甲醚是反应的初期产物;醋酸是由醋酸甲酯和醋酐(醋酸甲酯羰化生成)水解生成,高压及高浓度碘化物有利于醋酸的生成。王云海等[5]认为在催化剂作用下一氧化碳与碘甲烷加成碘乙酰活性中间体,在没有水存在的条件下,它主要与甲醇反应生成醋酸甲酯,醋酸甲酯再分解为乙酸。如果反应原料中加入水则可能改变反应路径,使水与碘乙酰直接生成乙酸,从而大大提高乙酸的选择性。本工作在 Ni-Mo/AC双组分催化剂[6-8]的基础上制备了Ni-Mo-La/AC三组分复合催化剂,并对在此催化剂上甲醇气相羰化反应动力学数据进行了测试及分析,以期更好地理解该反应机理,建立可行的复杂反应动力学方程。
1 实验部分
催化剂的制备。催化剂载体为20~40目的活性炭,催化剂Ni负载量为8%,Mo/Ni比0.3,La负载量为2.7%。用水为溶剂浸渍24 h负载Mo,微波干燥5 min,在烘箱中120 ℃烘4 h;然后用甲醇为溶剂,共同浸渍24 h负载Ni和La,在烘箱中120 ℃烘8 h。焙烧温度450 ℃,还原温度450 ℃。
实验反应条件:压力1.0 MPa,起始原料CO:CH3OH:CH3I物质的量比为40:20:1。实验用平推流积分反应器,反应管内径dt为12 mm,管长L为480 mm,催化剂当量直径dp近似为1 mm。反应装置相应参数为:dt/dp=12、L/dp=480,完全符合平推流积分反应器dt/dp>8、L/dp>150的衡量标准[9]。
2 结果与讨论
2.1 外扩散传质阻力的消除
固定液体物料空时(W/F=10 g-cat·h/mol)不变,在反应温度为250 ℃,压力为1.0 MPa,起始原料配比CO:CH3OH:CH3I物质的量比为40:20:1的条件下,改变气体流速,测定甲醇转化率随气体流速的变化情况,结果如图1所示。可以看到,在气体流速大于75 mL/min的情况下,外传质的影响基本可以忽略。

图1 气体流速对甲醇转化率的影响Fig.1 Effect of gas velocity of on the conversion of CH3OH

图2 催化剂颗粒大小对CH3OH转化率的影响Fig.2 Effect of catalyst size on the conversion of CH3OH
2.2 内扩散的影响
固定液体空时(W/F=10 g-cat·h/mol)、反应温度250 ℃、压力1.0 MPa和起始原料配比不变的情况下,实验考察了不同催化剂颗粒粒度时的甲醇转化率,结果见图2。可以看出,当催化剂的颗粒小于20~40 目时,甲醇的转化率基本保持不变,说明内扩散影响已可排除。
2.3 动力学数据测定
表1所示为不同条件下甲醇转化率、羰化产物收率及各产物醋酸(HAc)、醋酸甲酯(MeOAc)、甲烷、二甲醚(DME)选择性随时间变化的实验结果。
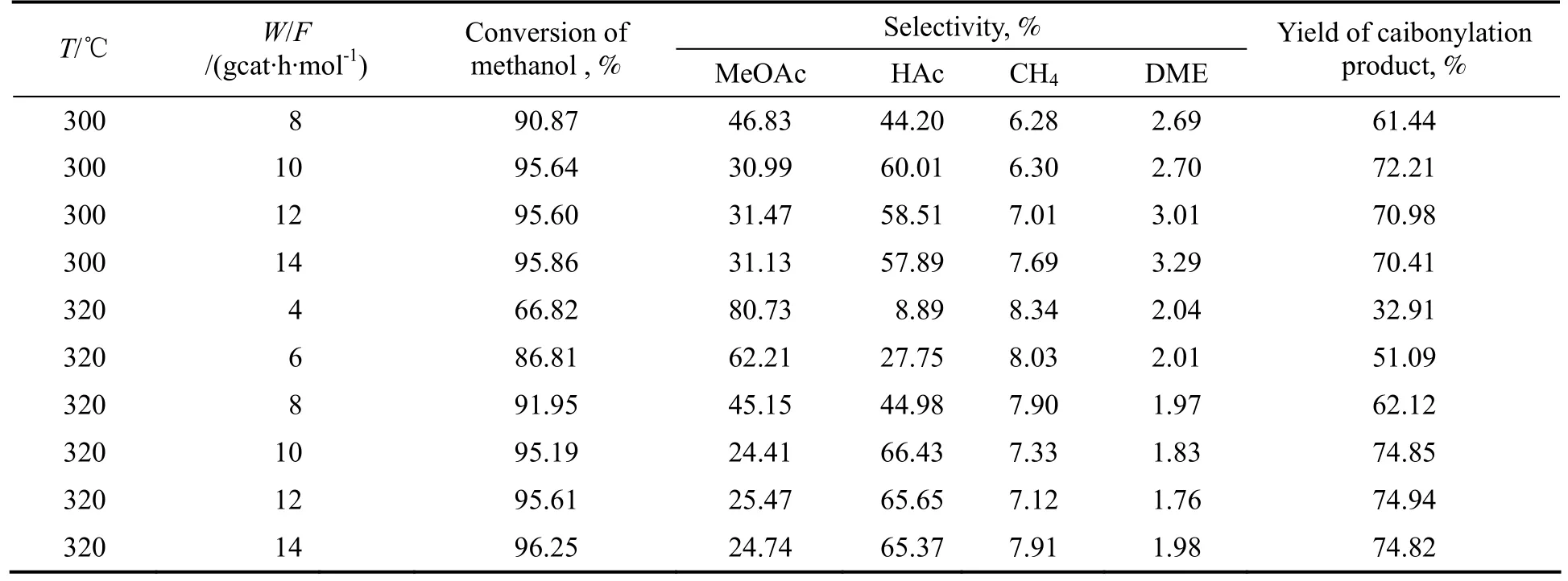
续表1
由实验可见,无论反应温度如何变化,转化率、收率及选择率的变化趋势是一致的,说明在本研究的温度范围内,反应温度不影响反应的历程。在220~320 ℃,空速相同时甲醇转化率随温度升高而增大。随着温度的升高,醋酸甲酯的选择性逐渐降低,醋酸的选择性逐渐增大,温度相同时随空速增大,甲醇转化率和醋酸选择性减小、醋酸甲酯选择性增大。同时还可以看出,空速对产物选择性的影响程度与温度高低有很大关系。空速太大和太小都不利于醋酸的生成。随着温度升高,空速对醋酸甲酯及醋酸的选择性的影响明显增大,当温度达到320 ℃时,醋酸甲酯的选择性从W/F为4 g-cat·h/mol时的80.73%降至W/F为14 g-cat·h/mol时的24.74%,而醋酸选择性则从前者的8.89%快速升至后者时的65.37%。
副产物二甲醚与甲烷,二者的选择性均较低。在测试温度范围内,温度升高二甲醚的选择性下降,甲烷选择性升高,说明高温对甲烷有利。空速对二者选择性影响均不明显。
2.4 主副反应及途径
从动力学数据分析可知,醋酸甲酯是甲醇气相羰基化反应的中间产物,醋酸则显示出连串反应最终产物的特征,它由醋酸甲酯水解生成,这与Fujimoto[10]等人的研究相一致,即:

副产物二甲醚的形成是通过甲醇的脱水反应(3)实现的,而碘甲烷和活性炭共同对这一反应起到了催化作用。同时,二甲醚的含量随反应进行逐渐减少,说明其可进一步羰化生成醋酸甲酯,如反应(4),这与郭岱石[11]等人的研究结果相似。

在不使用促进剂碘甲烷的情况下反应体系的产物只有氢,而通入碘甲烷后出现了包括甲烷在内的其它产物,说明碘甲烷参与了甲烷的形成,如式(5)~(7),这与Fujimoto[10]等在实验中发现的结果一致。

由于甲醇分解反应(7)随温度升高迅速趋向容易,因此在实验数据上就表现为温度升高,对生成甲烷有利,甲烷选择性增大。
至此可知甲醇与一氧化碳在活性炭负载镍催化剂和碘甲烷促进剂的共同作用下的气固相反应,主要经历如下途径:

2.5 反应机理推论
根据实验结果及理论分析,结合Fujimoto[10]等人的研究及郭岱石[11]等从热力学角度得出的乙酰碘难以形成的论点,甲醇气相羰基化生成醋酸及醋酸甲酯的反应历程如下:

2.6 本征动力学分析
2.6.1 动力学模型的建立
在反应进行的起始阶段,甲醇的含量较高,金属酰化物主要与甲醇发生反应,其和水反应的选择性很小;而在甲醇转化后期醋酸甲酯的浓度又变的较大,其与水反应的选择性也大于金属酰化物与水的反应,因此反应(11)可以忽略。在整个反应过程中碘化物均较活泼,极易继续反应,即碘化物一旦生成,就立即反应掉,其生成速率与消耗速率相等以致其浓度不随时间变化,可认为处于稳态。
根据上述反应(8)~(13)建立主产物醋酸及醋酸甲酯反应的动力学模型,过程与方法如下。

根据连串反应的稳态近似处理法,可看出水的生成速率始终和醋酸甲酯的生成速率相同,因而水的分压可用醋酸甲酯的分压来代替。则有:
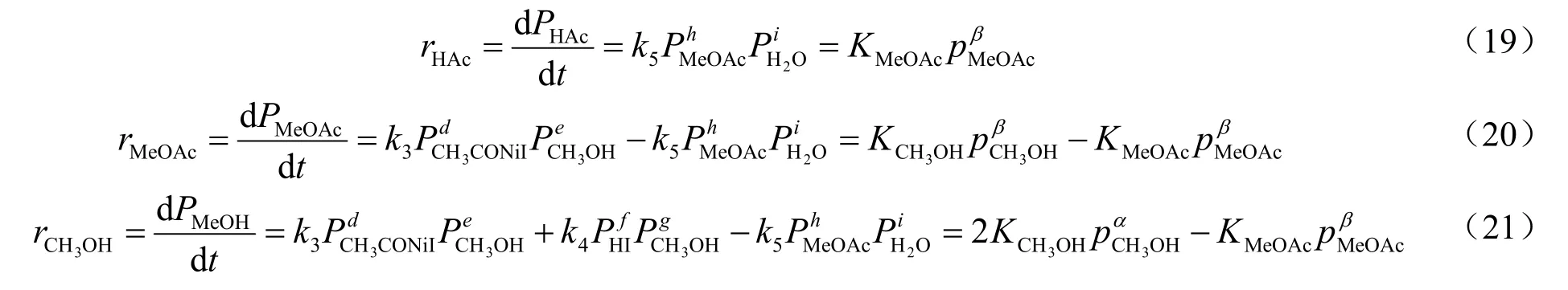
2.6.2 动力学数据处理
为求取动力学模型参数,在总压力Pt为1.0 MPa,初始原料配比CO:CH3OH:CH3I为40:20:1(物质的量比)的条件下,对反应数据进行如下处理。

各组分反应后的分压则可根据甲醇转化率(x)、醋酸甲酯收率醋酸收率测得,按下三式计算:
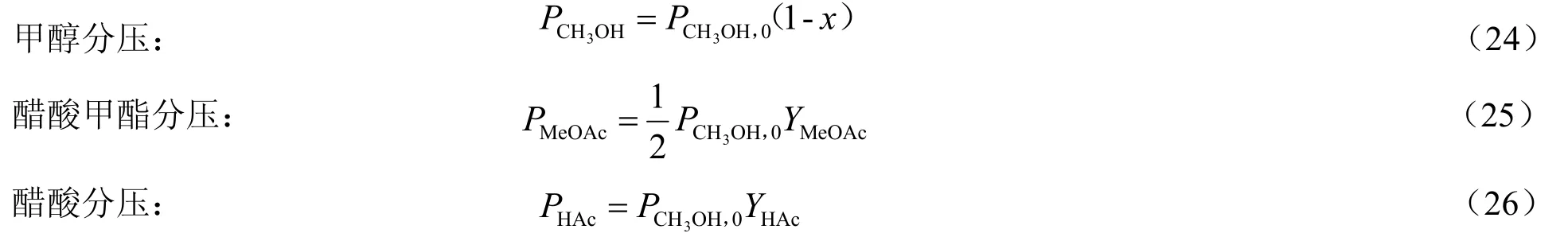
根据动力学数据可计算出不同空时的各组分分压,对于多相催化反应,其反应速率可表示为:

依据动力学数据可求得醋酸甲酯和醋酸的收率。对本反应体系采用图解法来求得不同温度下不同空时的反应速率,即作不同温度下甲醇转化率及产物收率对空时变化的曲线图,并对曲线上的点作切线,求出该切线的斜率即为该点的转化率或收率的变化率,与结合得到反应速率,结果如表2~表6。
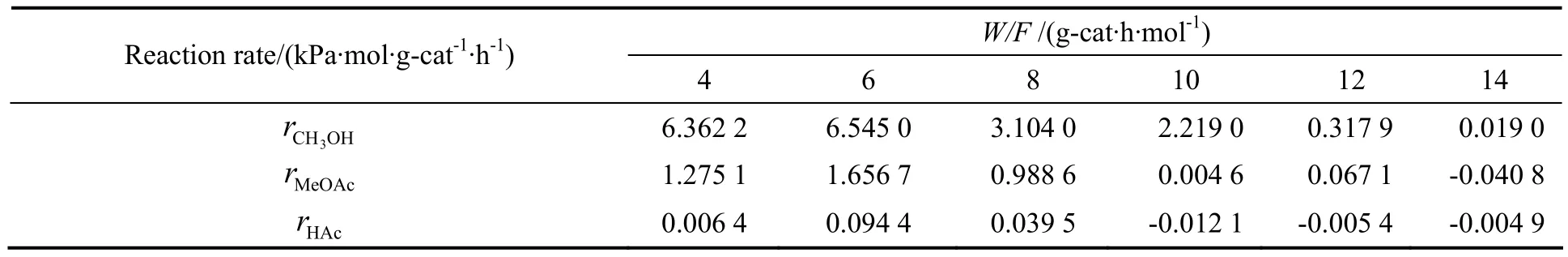
表2 220 ℃不同空时下的反应速率Table2 The reaction rate as the function of the space time at 220 ℃
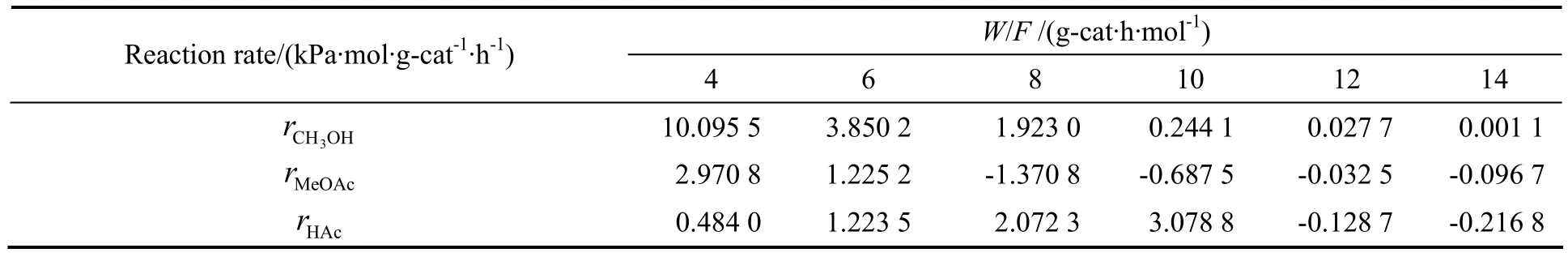
表3 250 ℃不同空时下的反应速率Table3 The reaction rate as the function of the space time at 250 ℃
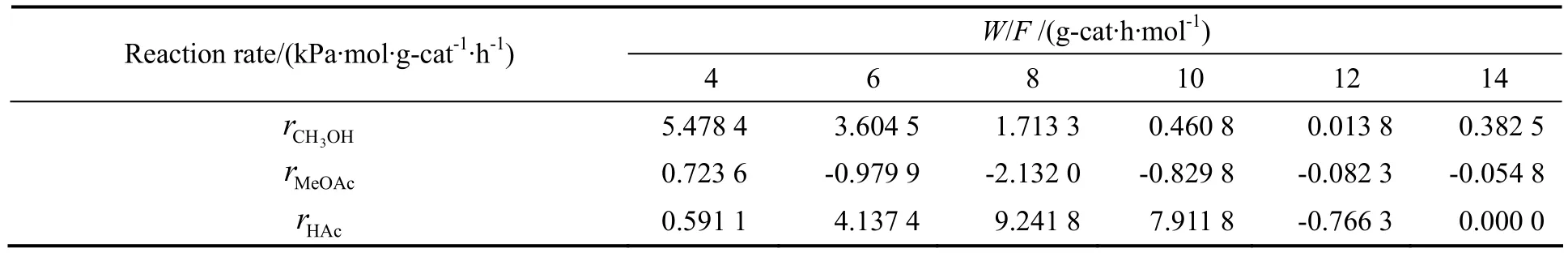
表4 280 ℃不同空时下的反应速率Table4 The reaction rate as the function of the space time at 280 ℃

表5 300 ℃不同空时下的反应速率Table5 The reaction rate as the function of the space time at 300 ℃

表6 320 ℃不同空时下的反应速率Table6 The reaction rate as the function of the space time at 320 ℃
2.6.3 动力学模型参数的计算
采用线性回归法计算动力学模型的参数值。将方程(19)代入(21)得到:

将式(19)和(30)转换为线性方程形式如下:
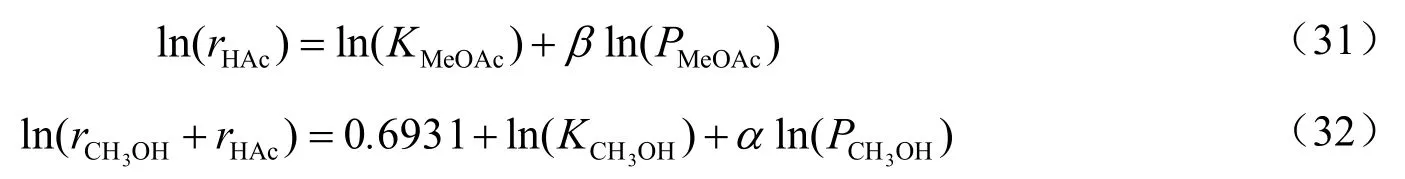
将实验结果代入方程(31)、(32)之中,通过最小二乘法回归出各方程的参数值,结果如表7。

表7 不同温度下的动力学参数值Table7 Kinetic parameter of different temperature
由于220 ℃时醋酸的选择性极低,基本不生成醋酸,以至于这一点的β与其他偏差比较大,取其他四个温度点的α和β平均值分别为0.574 2和0.266 6。假设温度对反应速率常数的影响符合Arrhenius方程,与(-T-1)呈现直线关系,斜率为15.507 1×103,截距为3.847 4。与(-T-1)也呈现直线关系,斜率为10.879 4×103,截距为1.887 3。由此计算出甲醇与醋酸甲酯的A0和E。由此得到本征动力学速率方程的表达式为:

3 结 论
对负载型Ni-Mo-La/AC复合催化剂催化甲醇气相羰基化反应进行了动力学数据的测定,通过实验数据及理论分析,得到主副产物的反应途径为:醋酸甲酯是甲醇气相羰基化反应的中间产物,醋酸显示连串反应最终产物的特征,由醋酸甲酯水解生成;二甲醚通过甲醇脱水生成,碘甲烷和活性炭共同对该反应起催化作用,二甲醚可进一步羰化生成醋酸甲酯;甲烷由甲醇分解后的产物氢气与碘甲烷反应生成。
[1]马正飞, 石 磊, 姚虎卿. Ni-Zn-Cu/AC催化剂上甲醇气相低压羰基化反应 [J]. 化学工业与工程, 2003, 20(4):189-194.Ma Zhengfei, Shi Lei, Yao Huqing. Vapor phase carbonylation of methanol on Ni-Zn-Cu/AC catalysts [J]. Chemical Industry and Engineering.2003, 20(4):189-194.
[2]Liu T C, Chiu S J. Kinetics of primary reactions of vapour-phase methanol carbonylation on Sn-Ni/C catalyst [J]. Ind Eng Chem Res, 1994,33(7):1674-1679.
[3]Omata K, Fujimoto K, Shikada T, et al. Vapor phase carbonylation of organic compounds over supported transition-metal catalyst. 3. Kinetic analysis of methanol carbonylation with nickel-active carbon catalyst [J]. Ind Eng Chem Prod Res Dev, 1985, 24(2):234-239.
[4]Piet W N M van L . Homogeneous catalysis [M]. USA: Kluwer Academic Publishers, 2006:109.
[5]王云海, 赵景联, 王新平. Ni/PHAC催化甲醇羰基化合成乙酸工艺研究 [J]. 高校化学工程学报, 2003, 17(1):106-109.Wang Yunhai, Zhao Jinglian, Wang Xinping. Synthesis of acetic acid via methanol carbonylation catalyzed by nickels supported on phenolic-resine derived active carbon [J]. Journal of Chemical Engineering of Chinese Universities, 2003, 17(1):106-109.
[6]刘金红, 张 倩, 姚虎卿. Ni/活性炭催化剂上还原途径及催化性能 [J]. 化学反应工程与工艺, 2007, 23(3):244-247.Liu Jinhong, Zhang Qian, Yao Huqing. Reduetive paths and the catalytic performance over Ni/AC catalyst [J]. Chemical Reaction Engineering and Technology, 2007, 23(3):244-247.
[7]石 磊, 马正飞, 方 峻, 等. 甲醇常压气相羰基化合成乙酸的镍基双金属催化剂研究 [J]. 化学反应工程与工艺, 2002, 18(3):206-211.Shi Lei, Ma Zhengfei, Fang Jun, et al. Study on bimetallic supported catalysts used in atmospheric gas-phase carbonlyation of methanol to acetic acid [J]. Chemical Reaction Engineering and Technology, 2002, 18(3):206-211.
[8]刘志军, 刘金红, 黄艳芳, 等. Ni-Mo/AC双金属催化剂制备条件研究 [J]. 天然气化工, 2009, 34(3):48-51.Liu Zhijun, Liu Jinhong, Huang Yanfang, et al. Study on parparation conditions of Ni-Mo/AC catalyst [J]. Natural Gas Chemical Industry, 2009,34(3):48-51.
[9]朱炳辰. 化学反应工程(第三版) [M]. 北京: 化学工业出版社, 2001:503.
[10]Fujimoto K, Omata K, Shikada K, et al. Vapor-phase carbonlyation of organic compounds over supported transition-metal catalyst 2 Synthesis of acetic acid and methyl acetate from methanol with nickel-active carbon catalyst [J]. Ind Eng Chem Prod Res Dev, 1983, 22(3):436-439.
[11]郭岱石, 马正飞, 姚虎卿. Ni/AC催化剂上甲醇羰化制醋酸反应机理热力学分析 [J]. 天然气化工, 2002, 27(4):11-15.Guo Daishi, Ma Zhengfei, Yao Huqing. Thermodynamic analysis on vapor-phase carbonylation of methanol to acetic acid over Ni/AC catalyst[J]. Natural Gas Chemical Industry, 2002, 27(4):11-15.
Reaction Mechanism and Intrinsic Kinetics of Acetic Acid Synthesized by Methanol Carbonylation in Gas Phase
Liu Jinhong1,2,Liu Zhijun2,Huang Yanfang2,Yao Huqing1
(1. College of Chemistry and Chemical Engineering,Nanjing University of Technology, Nanjing 210009, China;2. Department of Chemical Engineering, Nantong Vocational College, Nantong 226007, China)
Complex catalyst Ni-Mo-La/AC was prepared by impregnation method. And kinetic data of acetic acid catalytic synthesized by methanol carbonylation in gas phase were measured in a plug flow reactor. The results indicated that methyl acetate was the first order product of the vapour phase carbonylation of methanol, and acetic acid was the second order product of the sequential reaction by hydrolysis from methyl acetate. The dimethyl ether was obtained through dehydration of methanol. Methyl iodide and activated carbon had the catalysis effect together on this reaction. The dimethyl ether could also produce methyl acetate by carbonlylation; methane was obtained by reaction of methyl iodide and the production of methanol decomposition. On the base of above analysis, a reaction kinetics model was set up and model parameters were obtained by linear regression of data.
methanol; acetic acid; carbonylation; complex catalyst; kinetics
O643 文献标识码:A
1001—7631 ( 2011 ) 05—0418—07
2010-11-23;
2011-04-20
刘金红(1962-),女,教授。E-mail:jinhongkl@163.com
江苏省高校自然科学研究计划(04KJD530147)

