单宁的抗营养作用与去除方法的研究进展*
艾庆辉,苗又青,麦康森
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
中国是世界水产养殖大国,总产量占世界产量的70%左右[1]。随着水产养殖规模的扩大以及养殖模式的转变,水产养殖业对饲料的依赖性逐渐增强。在集约化鱼类生产中饲料成本往往占到总成本的50%以上[2]。由于水生动物特殊的生理代谢方式,蛋白质作为最重要的营养元素之一,在饲料中占有极其重要的地位——鱼类饲料蛋白质含量约占饲料干重的29%~55%[3]。鱼粉因蛋白质含量高、氨基酸平衡、易于消化吸收等被认为是最好的饲料蛋白源之一。随着集约化养殖的迅猛发展,鱼粉的需求量急剧上升。然而,由于过度捕捞、环境污染以及气候变化等导致世界鱼粉产量逐渐下降而价格逐年上升,从而严重制约了水产养殖业的进一步发展。因此,寻找适宜的蛋白源以替代鱼粉就成为亟待解决的重要问题。然而植物蛋白源中往往含有多种抗营养因子,限制了在饲料中的应用[4-6]。
单宁(Tannin,tannic acid)又称单宁酸或鞣酸,是一类水溶性、分子量在500~3 000 Da之间的酚类化合物[7-8]。单宁在植物界中广泛分布,是一种重要的次级代谢产物,也是除木质素以外含量最多的一类植物酚类物质。单宁主要存在于植物界的高等植物,特别是双子叶植物,如豆科(Leguminosae)、桃金娘科(M yrtaceae)等的树皮、叶子、木质部、果实以及种子等几乎各个组织器官中[7,9]。
单宁按结构可以分为水解单宁(Hydrolysable tannins,H T)、缩合单宁(Condensed tannins,CT)以及复杂单宁(Comp lex tannins)。水解单宁是没食子酸或鞣花酸与糖(一般是葡萄糖)或多元酚形成的酯。水解单宁分子量相对较小,具有很强的极性,可溶于水,与蛋白质分子中的亲核基团(-NH2、-SH)形成不溶性复合物,也可与金属离子等结合形成沉淀。水解单宁易于被酶(单宁酶)、酸和碱水解[10]。水解产物为没食子酸或鞣花酸及葡萄糖。因此,水解单宁根据水解产物可以进一步分为没食子单宁(Gallotannins)和鞣花单宁(Ellagitannins)。缩合单宁,又称原花色素,大多是通过C4-C6或C4-C8键连接的寡聚或多聚黄烷-3-醇或黄烷-3,4-二醇。缩合单宁相对分子量较大,一般不容易被水解。复杂单宁是介于水解单宁和缩合单宁之间的一种单宁,含有水解单宁和缩合单宁组成单位,具有前两者的共性[7-8,11](见表1)。
1 单宁的抗营养性
单宁因具有苦涩味道并能和蛋白质、糖类、金属离子等结合而成为难以消化吸收的复合物,故而会降低动物的摄食率以及饲料中某些营养元素的生物利用率,加之其本身和代谢产物往往能对动物产生毒害作用,因此被认为是抗营养因子。
1.1 降低摄食率
目前,大多数研究报道指出单宁能降低动物摄食率。这些动物既包括单胃动物,如鸡[12]、罗非鱼(Oreochrom ismossambicus)[13]、鲤[14]和东方田鼠(M icrotus fortis)[15]等,又包括反刍动物,如绵羊[16-18]等。单宁对摄食率的影响可能与实验动物的种类以及饲料单宁的种类和含量有关。研究结果显示,相对于水解单宁,缩合单宁对罗非鱼摄食率有显著抑制作用,而对鲤的研究却得出了相反的结论[13-14],这表明,摄食率因单宁和动物的种类而异。目前,尚不清楚产生这种差异的原因。饲料单宁含量对实验动物摄食率有显著影响。Barry和Duncan[19]用不同单宁含量的Lotus pedunculatus饲喂绵羊,发现绵羊对低单宁饲料和高单宁饲料(分别为45.6和105.9 g/kg干物质)干物质的摄食率分别为83.3和75.0(g/kg体质量0.75)。M cNabb等[20]用单宁含量为55 g/kg干物质的Lotus pedunculatus饲喂绵羊,发现与对照组(聚乙二醇,PEG处理组)相比,绵羊的摄食率无显著变化。单宁具收敛性,口感苦涩,影响适口性[21],因此,饲料的适口性随其单宁含量逐渐增加而降低。这可能是降低动物摄食率的重要原因。饲料中单宁含量低时对动物摄食率不产生负面影响的原因可能是,动物在进化过程中对单宁产生了一定程度的适应,比如,通过唾液腺分泌的富脯氨酸蛋白(Proline-rich p rotein,PRP)结合饲料单宁[22],以改善其适口性提高摄食率。然而,也有研究表明,适口性可能不是影响摄食率的主要因素。Narjisse等[23]研究发现,灌喂低剂量(0.1%)单宁后,绵羊的摄食率降低,产生这种结果的原因可能是单宁增加了消化道排空的时间,而产生“饱”的感觉进而降低摄食率[24]。最新研究表明,灌喂高剂量的单宁(3.0 g/kg体质量)后,由此造成的消化系统等损伤可能是导致摄食率降低的最主要原因[17]。

表1 单宁的主要种类及来源[7]Table 1 Themajor groups of tannins with their rep resentative types and main sources
1.2 降低饲料营养物质的生物利用率
目前,已有大量研究表明单宁能降低动物对营养物质的生物利用率。单宁主要降低蛋白质并在不同程度上影响其他营养物质的利用率[25-27]。尽管相关研究还不深入,然而,目前的研究报道显示,单宁对营养物质的生物利用率的抑制作用可能具有多方面的原因,主要可能有以下几个方面:
1)降低营养物质的消化与吸收:单宁和饲料中的营养物质,如蛋白质[28]、糖[29]、钙[30]、铜和锌[31]等结合成不溶于水的复合物。这些物质在动物消化道内比较稳定,很难被消化。此外,单宁还能抑制消化酶活力,从而进一步降低营养物质的消化率。A l-M amary等[30]研究发现高粱单宁对兔消化酶具有显著的抑制作用,饲料中3.5%单宁可分别抑制α-淀粉酶和脂肪酶活力达77%和43%。Kandra等[32]的研究也证实了单宁对唾液α-淀粉酶的抑制作用。单宁能降低营养物质的吸收。Kim和M iller[33]研究发现,茶水(含118 mg/l儿茶酚和82 mg/l单宁酸)能降低Sp rague-Dawley大鼠对铁的吸收率达50%以上。该研究还指出,无论是外源(明胶)还是内源(唾液腺分泌)富脯氨酸蛋白均能提高Sp rague-Dawley大鼠对铁的吸收率。富脯氨酸蛋白能提高铁的吸收率的原因在于,其能取代铁与单宁结合成不溶性的复合物,从而提高铁的吸收率。
2)降低动物体内的氮平衡:研究表明,单宁能降低动物体内的氮平衡。King等[34]等用单宁含量不同的高粱饲喂北京鸭,发现高单宁含量的高粱可显著降低其体氮沉积量。Narjisse等[23]研究发现橡树(Quercus ilex)单宁可降低绵羊体氮保留率达159%。单宁降低氮平衡的原因可能是,降低氮的摄入量、消化吸收量以及提高氮的排出量。Narjisse等[23]研究发现,单宁能提高绵羊尿氮排出量达44%而对粪氮则没有显著影响。M arzo等[35]发现饲料中的单宁(25 g/kg饲料)显著降低了鸡的蛋白质效率同时显著提高了鸡肝脏的蛋白质降解率。Barahona等[36]研究发现单宁能够提高绵羊粪氮排出量。单宁对粪氮的影响比较复杂,一方面,可能是单宁降低了氮的摄入量以及消化和吸收量;另一方面,单宁诱导唾液腺分泌的富脯氨酸蛋白也是造成体氮流失的重要原因。
3)改变动物消化道菌群:消化道菌群对动物、尤其是反刍动物的营养消化有重要作用[37]。Smith和Mackie[38]研究指出,缩合单宁改变了大鼠消化道微生物的种群结构,大鼠摄食含单宁的饲料后,其消化道中单宁耐受菌比例显著上升。研究发现,缩合单宁对瘤胃蛋白质降解菌生长具有抑制作用并降低了该类细菌对蛋白质的水解率[37],因而也就降低了反刍动物对饲料蛋白质的消化率。
4)单宁能损害消化系统:单宁,尤其是高剂量的单宁,对动物消化系统的损害作用,已经在相关研究中得到验证。Herv?s等[17]研究发现连续灌喂高剂量缩合单宁(3.0 g/kg体质量)10 d后绵羊胃肠道黏膜出现溃疡、增厚,内部充气膨胀以及充满大量水样物质。Marzo等[35]研究发现,单宁对鸡肝脏的生长具有抑制作用。
1.3 单宁及其降解产物对养殖动物产生直接毒害作用
Boyd等[39]研究发现,单宁酸可对大鼠产生急性毒害作用。口服单宁酸后,大鼠表现出惊厥呼吸衰竭并导致死亡,解剖结果显示,单宁酸导致肝坏死、肾炎以及暂时性急性肠炎,并能导致脾、肾上腺皮质和睾丸等多个器官浮肿以及胸腺等萎缩。Glick和Joslyn[40]研究发现饲料中高浓度的单宁(8%)对刚断奶的小鼠有致死作用,而随着小鼠的生长,其对单宁的耐受能力逐渐增强。Saha和Kaviraj[13]研究了水解单宁和缩合单宁对罗非鱼的急性和慢性毒性作用,发现缩合单宁对罗非鱼的毒性作用大于水解单宁,96 h内水解单宁和缩合单宁对其半致死浓度(LC50)分别为107.2和55 mg/L。而Becker和M akkar[14]关于单宁对鲤影响的研究中得出了不同的结论,实验结果显示水解单宁对鲤的毒性显著高于缩合单宁,当实验进行至42 d时因水解单宁对实验鱼的毒害作用导致实验无法继续进行。Herv?s等[17]研究发现,灌喂绵羊高浓度单宁(3.0 g/kg体质量)5 d后其即表现出不良症状(体质虚弱,精神不振),8 d后绵羊呼吸和心跳速度加快,食欲减退,粪便黏稠表面覆盖黏液,10 d后导致实验无法继续进行,而低浓度的单宁对绵羊未产生有害影响。动物种类的不同以及单宁的来源和组成差异可能是导致这些研究得出相悖结论的原因。单宁对养殖动物的毒性主要表现在两个方面,一是直接损伤消化道,二是其代谢物质进入循环系统后对肝肾等造成损伤。
由于单宁具有较强的抗营养作用,因此,在动物饲料中应慎重添加富含单宁的植物性饲料原料。
2 单宁的去除方法
目前,已有大量关于去除植物性原料中单宁的方法报道。这对于提高植物性饲料原料、尤其是植物性蛋白源在饲料工业中的应用具有极其重要的意义。这些去除方法包括传统的理化方法以及生物方法等。
2.1 理化方法
关于理化手段降解单宁的方法主要包括溶液浸提、干燥方式、脱壳、挤压、碱、聚乙二醇以及射线处理等。
单宁往往存在于某些豆类的种皮内,而其他部位含量很少,因此通过脱壳可基本上完全除去其中的单宁[41]。挤压过程中可以产生高温,能对热不稳定的抗营养因子起到一定程度的破坏甚至是去除作用。Marzo等[42]研究指出,挤压可以显著降低芸豆中包括缩合单宁和多酚类物质在内的多种抗营养因子含量。与未经处理的芸豆相比,挤压的芸豆可显著改善大鼠的生长性能。有研究表明,单宁对碱比较敏感,在碱性条件下,单宁活性受到抑制。Canbolat等[43]用不同浓度的NaOH溶液(0、20、40、60和80 g/L)分别对2种树叶(A rbutus and rachne和Glycyrrhiza g labra L.)处理7 d,发现随着NaOH溶液的升高,样品中单宁含量直线下降,80 g/L NaOH溶液可分别降低A rbutus and rachne和Glycyrrhiza g labra L.60%和87%的单宁。草木灰被证明对单宁活性具有一定程度的抑制作用,由于草木灰水溶液呈碱性,因此,其作用机制被认为与NaOH相同。已有研究表明,草木灰不仅可以降低Acacia cyanophy lla中的单宁含量,还能提高绵羊对其蛋白质等的消化率[44]。由于单宁能与某些化合物结合成比与蛋白质等形成的复合物更难溶的复合物,因此向植物性原料中添加这类物质可显著降低单宁的抗营养作用,这类物质包括,PEG和PRP,其中关于PEP以开展了大量研究。PEP能与单宁形成比蛋白质更难溶的复合物[45],因此能够提高动物对含单宁饲料中蛋白质等的摄食率[46]、消化率[47]。Kim和M iller[33]研究发现PRP能够改善Sp rague-Daw ley大鼠对铁的吸收率。最新研究表明,射线处理对单宁具有明显的去除作用。de Toledo等[48]用不同剂量的γ射线(2、4和8 kGy)照射5种不同的大豆,发现随着放射剂量的增加,其包括单宁在内的多种抗营养因子含量显著下降。
然而传统方法往往在去除植物蛋白源中抗营养因子的同时,会降低其中其他营养物质的含量,导致原料的营养价值降低。Egounlety和Aworh[41]研究表明,用水对大豆、豇豆以及Macrotylom a geocarpa粉浸提12~14 h后,可降低其寡糖含量20%~30%,其中可降低蔗糖含量分别为27%、31%和35%。通过水浸提、脱壳、冲洗以及加热综合处理后,可降低上述3种豆粉中55%~74%的蔗糖。Marzo等[42]等研究发现,尽管挤压没有降低芸豆中蛋白质、糖类、纤维和灰分含量,却极显著地降低了其中含硫氨基酸的含量。
2.2 微生物对单宁的降解作用
2.2.1 单宁对微生物的拮抗性 单宁被认为是植物在长期进化过程中为防止被动物采食和致病微生物感染而产生的一类具有防御作用的次级代谢物质[49]。因此,单宁具有抑制微生物生长以及抵抗生物降解的能力[50]。单宁对微生物的抑制机制目前尚未完全了解,其主要机制可能是:i与微生物的细胞壁上的某些物质反应,导致其功能降低或丧失;ii与微生物分泌的胞外酶结合使之活性丧失;iii与环境中的营养物质结合抑制微生物的吸收[51]。
2.2.2 单宁降解菌的种类与分布 尽管单宁有抑制微生物的功能,但仍有部分微生物被发现对可以在含有单宁的环境中稳定地生长繁殖并能分泌单宁酶将单宁降解[7,51-52]。关于单宁降解菌的研究已有很长的历史,据Knudson[53]报道,早在1867年,Van Tieghem就发现了1株青霉(Penicillium g laucum)能够将五倍子中的单宁降解为没食子酸。Bhat等[7]综述了目前常见的单宁降解菌发现,具有单宁降解能力的微生物大多是霉菌,其中又以青霉属(Penicillium)和曲霉属(Aspergillus)种类居多,另外还有毛壳属(Chaetomium)、镰刀菌属(Fusarium)、丝核菌属(Rhizoctonia)、柱孢属(Cylind rocarpon)、木霉属(Trichoderm a)的一些种类也有一定的降解单宁的能力。相对于霉菌,具有单宁降解能力的细菌种类相对较少,主要分布于芽孢杆菌属(Bacillus)、克雷伯氏菌属(Klebsiella)、棒状杆菌属(Corynebacterium)等。而关于具有单宁降解能力的酵母报道较少。最近的研究报告指出,某些乳酸菌(Lactobacilli)也具有降解单宁的的能力(见表2)。
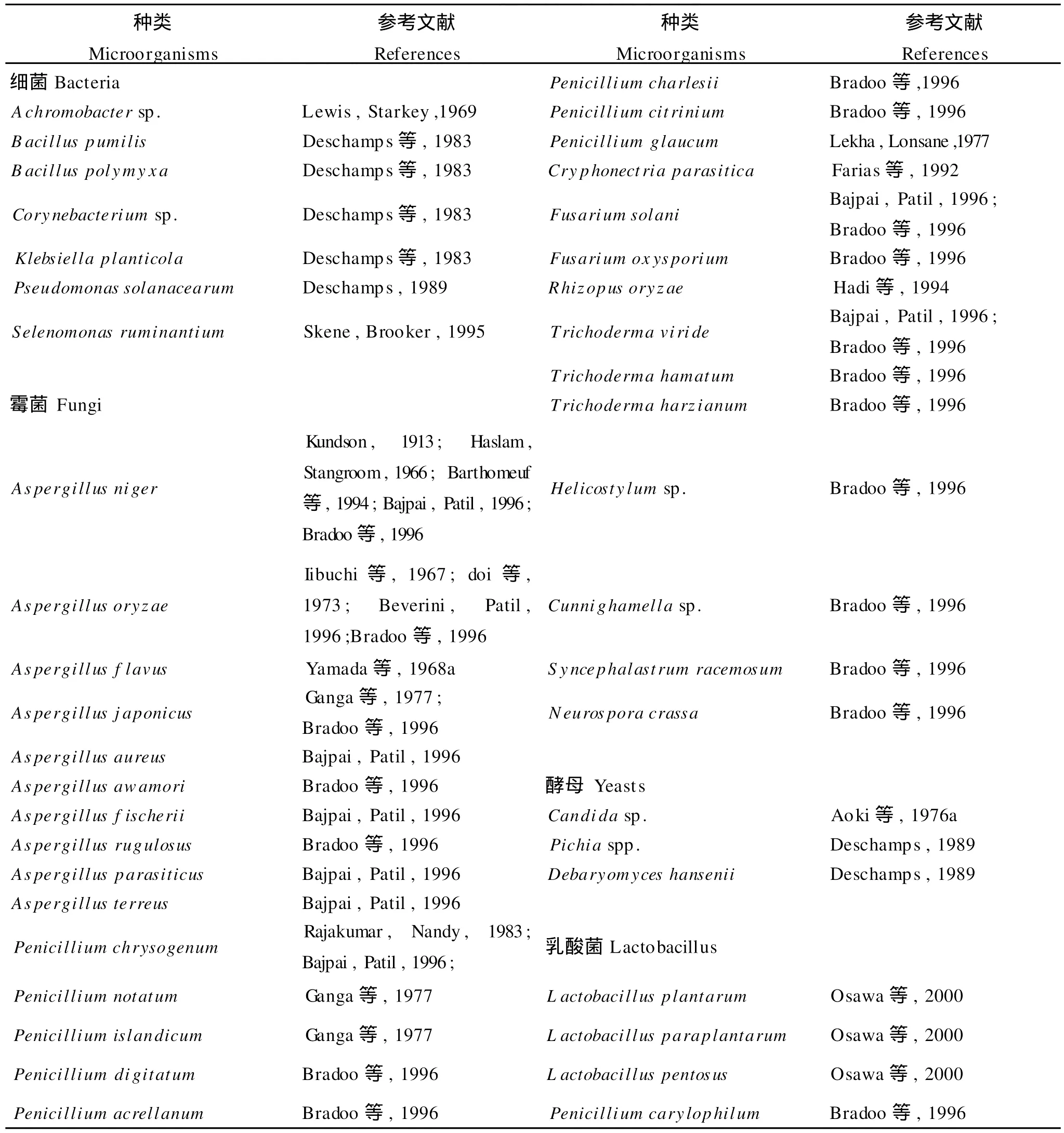
表2 能降解单宁的微生物[7,55]Table 2 Tannin-degrading Microorganism s
单宁降解菌在自然界有着相当广泛的分布。在单宁含量丰富的水体(如皮革厂排出的废水等)、土壤、某些发酵食物以及摄食富含单宁饲料的动物消化道、粪便中,往往能较容易地分离出单宁降解菌。Kumar等[54]从制革厂的废水中分离出1株能降解单宁的细菌(Citrobacter f reund ii),6 h内可产生单宁酶1.87 U/m L,并将单宁酸降解为葡萄糖和没食子酸。M ahadevan和M uthukum ar[55]总结了以往研究报道的能够在水体中分离到的微生物的种类,发现水体中分布的单宁降解菌以青霉属(Penicillium)和曲霉属(Aspergillus)种类居多。Osaw a等[56]从某些发酵的食品以及成年人的粪便中分离出了3株具有单宁降解能力的乳酸菌,而此前关于从发酵食品中分离单宁降解菌的研究尚未见报道。大量研究表明反刍动物消化道中具有单宁降解能力的微生物[57-59]。
2.2.3 单宁的微生物降解 目前已有大量关于微生物降解单宁的研究报道[7,55,57-59]。然而,利用微生物降解植物性原料中单宁的研究尚不多见。微生物不仅可以显著降解植物性饲料原料中的单宁,还可以同时降解其他多种抗营养因子,并提高其营养物质含量,改善消化率。Gamble等[60]用3株白根霉(Ceriporiopsis subverm ispora CZ-3-8497、Ceriporiopsis subverm ispora FP-90031-sp和Cyathus stercoreus A TCC 36910)对Lespedeza cuneata进行发酵发现这3株白根霉均能显著降低其单宁含量高达85%以上。Rakesh等[61]研究发现,霉菌发酵不仅显著降低了刺槐(Robinia pseudoacacia)中单宁含量而且提高了粗蛋白含量,并显著提高了其干物质消化率。Towo等[62]研究表明发酵可以显著降低高粱中酚类物质和植酸盐的含量,并能提高其铁的体外消化率。
3 结论
单宁的抗营养作用主要体现在降低养殖动物的摄食率消化率以及对动物产生直接毒性等方面。尽管,目前以对单宁的抗营养作用开展了大量的研究,但是由于单宁的来源广泛,种类众多,组成复杂,因此不同的研究往往得出不同的甚至相反的结论。目前,大多数研究主要采用非纯化的单宁(含单宁的饲料原料)进行实验,但由于饲料原料中含有多种物质,往往可能对实验结果产生不利影响,因此,采用纯化单宁开展研究将具有更重要的意义。通过技术手段降低植物性饲料原料中单宁含量,以提高原料的利用率降低单宁对养殖动物的健康损害,具有重要的实际价值。尽管传统方法能有效去除植物性原料中的单宁,但同时又造成了原料中其他营养成分的损失。与传统的去除方法相比,微生物降解法具有更广阔的前景。然而,目前关于微生物降解植物性饲料原料中单宁的研究较少,关于发酵产物对养殖动物(特别是水生动物)生长、存活等的影响更少。所以,开展微生物发酵降解植物性饲料原料中单宁的降解研究以及对养殖动物影响的研究将具有重要的理论与实际价值。
[1] Fao.Food and Agriculture Organization of the United Nations[M].[s.l.]:The State of Wo rld Fisheries and Aquaculture 2008(electronic version),2009:18.
[2] El-Sayed A M.A lternative dietary p rotein sources for farmed tilapia,Oreochrom is spp[J].Aquaculture,1999,179:149-168.
[3] Wilson R P.Fish Nutrition[M].(3rd edn).San Diego:Academic Press Inc,2002:146-148.
[4] 艾庆辉,谢小军.水生动物对植物蛋白源利用的研究进展[J].中国海洋大学学报:自然科学版,2005,35,(6):929-935.
[5] Zhang L,Mai K S,Ai Q H,et al.Use of compound protein source as a replacement for fish meal in diets of Large Yellow Croaker,Pseudosciaena crocea R.[J].Journal of the World Aquaculture Society,2008,39(1):83-90.
[6] Cheng Z Y,Ai Q H,Mai K S,et al.Effects of dietary canola meal on grow th performance,digestion and metabolism of Japanese seabass,Lateolabrax japonicus[J].Aquaculture,2010,305:103-108.
[7] Bhat T K,Singh B,Sharma O P.M icrobial degradation of tannins-a current perspective[J].Biodegradation,1998,9:343-357.
[8] 霍振华,方热军.单宁对反刍动物的抗营养作用机理及其消除措施[J].中国饲料,2007,20:20-23.
[9] Palm C A,Gachengo C N,Delve R J,et al.Organic inputs for soil fertility management in tropical agroecosystem s:application of an organic resource database[J].Agriculture,Ecosystems and Environment,2001,83:27-42.
[10] Huang W,Ni J,Borthw ick A G L.Biosynthesis of valonia tannin hydrolase and hydrolysis of volonia tannin to ellagicacid by Aspergillus niger SHL 6[J].Process Biochemistry,2005,40:1245-1249.
[11] Chung K T,Wei C L,Johnson M G.A re tannins a double-edged sword in biology and health[J]?Trends in Food Science&Technology,1998,9:168-175.
[12] Marquardt R R,Ward A T,Campbell L D,et al.Purification,identification and characterization of a grow th inhibitor in faba beans(Vicia faba L.var.minor)[J].The Journal of Nutrition,1997,107:1313-1324.
[13] Saha N C,Kaviraj A.Acute and chronic toxicity of tannic acid and spent bark of cinchona to tilapia Oreochrom is mossambicus[J].Aquaculture,1996,145:119-127.
[14] Becker K,Makkar H P S.Effects of dietary tannic acid and quebracho tannin on grow th performance and metabolic rates of common carp(Cyprinus carpio L.)[J].Aquaculture,1999,175:327-335.
[15] Li J,Liu J,Tao S.Effectsof hunger and tannic acid on food intake and foraging behavior in M icrotus fortis[J].Acta Ecologica Sinica.2007,27(11):4478-4484.
[16] Reed JD,Soller H.Woodward,A.Fodder tree and straw diets for sheep:intake,grow th,digestibility and the effects of phenolics on nitrogen utilization[J].Animal Feed Science and Technology,1990,30(1):39-50.
[17] Herv?s G,P?rez V,Gir?ldez F J,et al.Intoxication of sheep with quebracho tannin extract[J].Journal of Comparative pathology,2003,129(1):44-54.
[18] Salem H B,Nefzaoui A,Makkar H PS,et al.Effect of early experience and adaptation period on voluntary intake,digestion,and grow th in Barbarine lambs given tannin-containing(Acacia cyanophy lla Lindl.foliage)or tannin-free(oaten hay)diets[J].Animal Feed Science and Technology,2005,122:59-77.
[19] Barry T N,Ducan SJ.The role of condensed tannins in the nutritional value of Lotus pedunculatus for sheep.1.Voluntary intake[J].British Journal of Nutrition,1984,51:485-491.
[20] McNabb W C,Waghorn G C,Barry T N,et al.The effect of condensed tannins Lotus pedunculatus on the digestion and metabolism of methionine,cystine and inorganic sulphur in sheep[J].British Journal of Nutrition,1993,70:647-661.
[21] Drewnow ski A,Gomez-Carneros C.Bitter taste,phytonutritrients,and the consumer:a review[J].The American Journal of Clinical Nutrition,2000,72:1424-1435.
[22] Shimada T.Salivary proteins as a defense against dietary tannins[J].Journal of Chemical Ecology,2006,32:1149-1163.
[23] Narjisse H,Elhonsali M A,Olsen J D.Effects of oak(Quercus ilex)tannins on digestion and nitrogen balance in sheep and goats[J].Small Ruminant Research,1995,18:201-206.
[24] Frutos P,Hervíás G,Giráldez F J,et al.Review.Tannins and ruminant nutrition[J].Spanish Journal of Agricultural Research,2004,2:191-202.
[25] Mariscal-Landin G,Avellaneda J H,Reis de Souza T C,et al.Effect of tannins in sorghum on amino acid ileal digestibility and on trypsin(E.C.2.4.21.4)and chymotrypsin(E.C.2.4.21.1)activity of grow ing pigs[J].Animal Feed Science and Technology,2004,117:245-264.
[26] Vilari?no M,Métayer J P,Crépon K,et al.Effects of varying vicine,convicine and tannin contents of faba bean seeds(Vicia faba L.)on nutritional values for broiler chicken[J].Animal Feed Science and Technology,2009,150:114-121.
[27] Barry T N,Manley T R.The role of condensed tannins in the nutritional value of Lotus pedunculatus for sheep 2.Quantitative digestion of carbohydrates and proteins[J].British Journal of Nutrition,1984,51:493-504.
[28] Frazier R A,Deaville E R,Green R J,et al.Interactions of tea tannins and condensed tannins with proteins[J].Journal of Pharmaceutical and Biomedical Analysis,2010,51:490-495.
[29] Lacassagne L,Francesch M,Carr B,et al.Utilization of tannincontaining and tannin-free faba beans(Vicia faba)by young chicks:Effects of pelleting feeds on energy,protein and starch digestibility[J].Animal Feed Science,1988,20(1):59-68.
[30] Al-Mamary M,Al-Habori M,Al-Aghbari A,et al.In vivo effects of dietary sorghum tannins on rabbit digestive enzymes and mineral absorption[J].Nutrition Research,2001,21:1393-1401.
[31] +engil?IA,;zacar M.Competitive biosorption of Pb2+,Cu2+and Zn2+ions from aqueous solutions onto valonia tannin resin[J].Journal of Hazardous Materials,2009,166:1488-1494.
[32] Kandra L,Gyongyi G,Agnes Z,et al.Inhibitory effects of tannin on human salivary a-amylase[J].Biochemical and Biophysical Research Communications,2004,319:1265-1271.
[33] Kim H S,Miller D D.Proline-rich proteinsmoderate the inhibitory effect of tea on iron absorption in rats[J].The Journal of Nutrition,2005,135:532-537.
[34] King D,Fan M Z,Ejeta G,et al.The effects of tannins on nutrient utilisati on in the White Pekin duck[J].British Poultry Science,2000,41(5):630-639.
[35] Marzo F,U rdaneta E,Santidrian S.Liver p roteolytic activity in tannic acid-fed birds[J].Poultry Science,2002,81:92-94.
[36] Barahona R,Lascano C E,Cochran R,et al.Intake,digestion,and nitrogen utilization by sheep fed tropical legumes with contrasting tannin concentration and astringency[J].Journal of Animal Science,1997,75:1633-1640.
[37] Min B R,Attwood G T,M cNabb W C,et al.The effect of condensed tannins from Lotus cornicul atus on the proteolytic activities and grow th of rumen bacteria[J].Animal Feed Science and Technology,2005,121:45-58.
[38] Smith A H,Mackie R I.Effect of condensed tannins on bacterial diversity and metabolic activity in the rat gastrointestinal tract[J].Applied and Environmental Microbiology,2004,70(20):1104-1115.
[39] Boyd E M,Bereczky K,Godi I.The acruye toxicity of tannic acid administered intrgastrically[J].Canadian Medical Association Journal,1965,92:1292-1297.
[40] Glick Z,Joslyn M A.Food intake depression and othermetabolic effects of tannic acid in the rat[J].The Journal of Nutrition,1969,100:509-515.
[41] Egounlety M,Aworh O C.Effects of soaking,dehulling,cooking and fermentation with Rhizopus oligosporus on the oligosaccharides,trypsin inhibitor,phytic acid and tannins of soybean(Glycine max Merr.),cowpea(Vigna unguiculata L.Walp)and groundbean(M acroty lama geocarpa Harms)[J].Journal of Food Engineering,2003,56:249-253.
[42] Marzo F,Alonso R,U rdaneta E,et al.Nutritional quality of extruded kidney bean(Phaseolus vulgaris L.var.Pinto)and its effects on grow th and skeletal muscle nitrogen fractions in rats[J].Journal of Animal Science,2002,80:875-879.
[43] Canbolat O,Ozkan CO,Kamalak A.Effectsof NaOH treatment on condensed tannin contents and gas p roduction kinetics of tree leaves[J].Animal Feed Science and Technology,2007,138:189-194.
[44] Salem H B,Abidi S,Makkar H P S,et al.Wood ash treatment,a cost-effective w ay to deactivate tannins in Acacia cyanophlla Lindl.foliage and to imp rove digestion by Barbarine sheep[J].Animal Feed Science and Technology,2005,122:93-108.
[45] Jones W T,Mangan J L.Complexes of condensed tannins of sainfoin(Onobrychis viciifolia Scop.)with fraction-1 leaf p rotein and with submaxillary mucoprotein,and their reversal by polyethylene-glycol and p H[J].Journal of the Science of Food and Agriculture,1977,28:126-136.
[46] Villalba J J,Provenza FD.Preference for polyethylene glycol by sheep fed a quebracho tannin diet[J].Journal of Animal Science,2001,79:2066-2074.
[47] Priolo A,Waghorn GC,Lanza M,et al.Polyethylene glycol as a means for reducing the impact of condensed tannins in carob pulp:effects on lamb grow th performance and meat quality[J].Journal of Animal Science,2000,78:810-816.
[48] De Toledo T C F,Canniatti-Brazaca S G,A rthur V,et al.Effects of gamma radiation on total phenolics,trypsin and tannin inhibitors in soybean grains[J].Radiation Physics and Chemistry,2007,76:1653-1656.
[49] Cowan M M.Plant products as antimicrobial agents[J].Clinical Microbiology Review s,1999,12(4):564-582.
[50] Henis Y,Tarari H,Volcani R.Effect of water extracts of carob pods,tannic acid,and their derivatives on the morphology and grow th of microorganisms[J].Applied Microbiology,1964,12(3):204-309.
[51] McSweeney C S,Palmer B,McNeill D M,et al.Microbial interactions with tannins:nutritional consequences for ruminants[J].Animal Feed Science and Technology,2001,91:83-93.
[52] Aguilar C N,Rodr guez R,Guti rrez-Snchez G,et al.Microbial tannases:advances and perspectives[J].Appl Microbiol Biotechnol,2007,76:47-59.
[53] Knudson L.Tannic acid fermentation.I[J].Journal of Biological Chemistry,1913,14:159-202.
[54] Kumar R A,Gunasekaran P,Lakshmanan M.Biodegradation of tannic acid by Citrobacter freundiiisolated from a tannery effluent[J].Journal of Basic Microbiology,1999,39:161-168.
[55] Mahadevan A,Muthukumar G.Aquaticmicrobiology with reference to tannin degradations[J].Microbiology,1980,72:73-79.
[56] Osawa RO,Kuroiso K,Goto S,et al.Isolation of tannin-degradation Lactobacilli form humans and fermented foods[J].Applied and Environmental Microbiology,2000,66(7):3093-3097.
[57] Singh B,Bhat T K,Sharma O P.Biodegradation of tannic acid in an in vitroruminal system[J].Livestock Prodution Science,2001,68:259-262.
[58] Makkar H P S.Effects and fate of tannins in ruminant animals,adaptation to tannins,and strategies to overcome detrimental effects of feeding tannin-rich feeds[J].Small Ruminant Research,2003,49:241-256.
[59] Frutos P,Hervás G,Gir ldez F J,et al.Review.Tannins and ruminant nutrition[J].Spanish Journal of Agricultural Research,2004,2(2):191-202.
[60] Gamble G R,Akin D E,Makkar H P S,et al.Biological degradation of tannins in Sericea Lespedeza(Lespedeza cuneata)by the white rot fungi Ceriporiopsis subvermispora and Cyathusstercoreus analyzed by solid-state13C nuclear magnetic resonance spectroscopy[J].Applied and Environmental Microbiology,1996,62(10):3600-3604.
[61] Rakesh D D,Bhat T K,Singh B.Effect of fungal treatment on composition,tannin levels,and digestibility of black locust(Robinia pseudoacacia)leaves[J].The Journal of General and Applied Microbiology,2000,46:99-103.
[62] Towo E,Matuschek E,Svanberg U.Fermentation and enzyme treatment of tannin sorghum gruels:effects on phenolic compounds,phytate and in vitro accessible iron[J].Food Chemistry,2006,94:369-376.

