鲣鱼肝脏酶解物对高果糖大鼠的降压活性研究*
王玉明,武晓琳,李兆杰,薛 勇,王静凤,薛长湖
(中国海洋大学食品科学与工程学院,山东青岛266003)
高血压病是以体循环动脉压增高为主要表现的临床综合症。由高血压引发的心脑血管疾病的死亡率已排到所有疾病死亡率的第一位,高血压正严重地危害着人们的健康和生命。普通的药物治疗都存在不同程度的副作用,长期服用会打乱人体正常的体液代谢甚至严重损伤心脑肝肾等功能,因此研究开发具有降压效果的功能性食品日益受到关注。
鲣鱼(Katsuw onus pelam is)属鲈形目鲭科鲣鱼属,是重要的海洋洄游鱼类,主要产于太平洋、印度洋和大西洋,我国东海和南海也可以大量捕获[1-2]。主要用于加工鲣鱼罐头,在日本主要用于加工生产“鲣节”,食用时将其刨成木鱼花,是日本传统的调味品,也可制作成生鱼片食用。在鲣鱼加工过程中内脏作为废弃物除掉,用途只有制作鱼粉,利用价值低。为了充分有效地利用鲣鱼加工副产物资源,提高其加工副产物的利用价值,我们对鲣鱼肝脏进行蛋白质酶解制备了以多肽为主要成分的鲣肝脏酶解物,前期的研究结果显示,鲣鱼肝脏酶解物具有显著的降血脂和抑制肝脏脂肪蓄积的作用[3]。本实验为了探索鲣鱼肝脏酶解物的新的生理活性,进行了降血压方面的研究。
1 材料和方法
1.1 主要仪器和药品
分光光度计(日本岛津UV-2550),氨基酸自动
分析仪(日立835250型),酶标仪(美国Bio-Rad公司的680型),小动物无创血压测定仪M K-2000型(日本室町制作所)。血清TC、TG、HDL-C试剂盒(北京中生生物工程高技术公司),磷脂(PL)、游离脂肪酸(NEFA)和葡萄糖试剂盒(日本和光纯药);血清脂联素测定EL ISA试剂盒(日本德岛Otsuka Pharmaceutical),血清瘦素测定EL ISA试剂盒(美国DSL公司),胰岛素试剂盒(美国R&D System s),其余试剂均为国产分析纯。
1.2 方法
1.2.1 样品制备
1.2.1.1 鲣鱼肝脏酶解物的制备 采取新鲜鲣鱼肝脏并切碎匀浆,25℃搅拌12 h,利用肝脏内蛋白质分解酶进行充分消化。消化后产物经过滤得到水溶液,减压浓缩后作为实验样品(以下称鲣鱼肝脏酶解物-KPLH)。
1.2.1.2 氨基酸组成分析 样品在6 mol/L HCl溶液中于110℃条件下水解20 h,通过氨基酸自动分析仪测定其氨基酸组成和含量[4]。色氨酸采用分光光度法进行测定[5]。
1.2.2 动物实验
1.2.2.1 饲料的配制 如表1所示,动物饲料含10%玉米油、20%蛋白质、65%碳水化合物,其它成分按A IN-76标准配方配制而成[6]。模型组饲料中含有55%的果糖,KPLH组在此基础上添加5%鲣鱼肝脏酶解物。
1.2.2.2 动物分组及实验方法 5周龄SPF级健康Spague-Daw ley雄性大鼠,体质量(190±10)g,购自北京动物实验中心。大鼠随机分为3组:正常对照组、模型对照组和5%鲣鱼肝脏酶解物添加组,每组7只,单笼饲养。饲养条件为:室温(23±2)℃,光暗周期为12/12 h,自由摄食和饮水,连续喂食4周。于末次饲喂后,大鼠禁食不禁水12 h,乙醚麻醉后,腹部大动脉采血处死大鼠,取肝脏称重。血液室温放置30 m in后,离心并分离血清,-80℃冻藏待测。
1.2.2.3 血压测定 大鼠血压经适应性练习后于实验开始第2周末和第4周末,10··00~12··00以tail cuff法测量清醒状态下大鼠尾动脉心收缩期血压,每只动物成功测定5次,取平均值作为收缩期血压[7]。
1.2.2.4 血清化学指标的测定 血清TC、TG、HDL-C、PL、NEFA及葡萄糖均按试剂盒说明测定。用EL ISA法分别测定血清胰岛素、脂联素和瘦素的含量。
1.3 统计分析
数据分析采用SPSS11.0软件,分析模型组与KPLH组之间的差异,以P<0.05为具有统计学意义上的差异,数据用?x±S.E.表示。相关性分析按Pearson’s correlation coefficient test方法求得相关系数(r)及双侧检验的概率,P<0.05为差异显著。
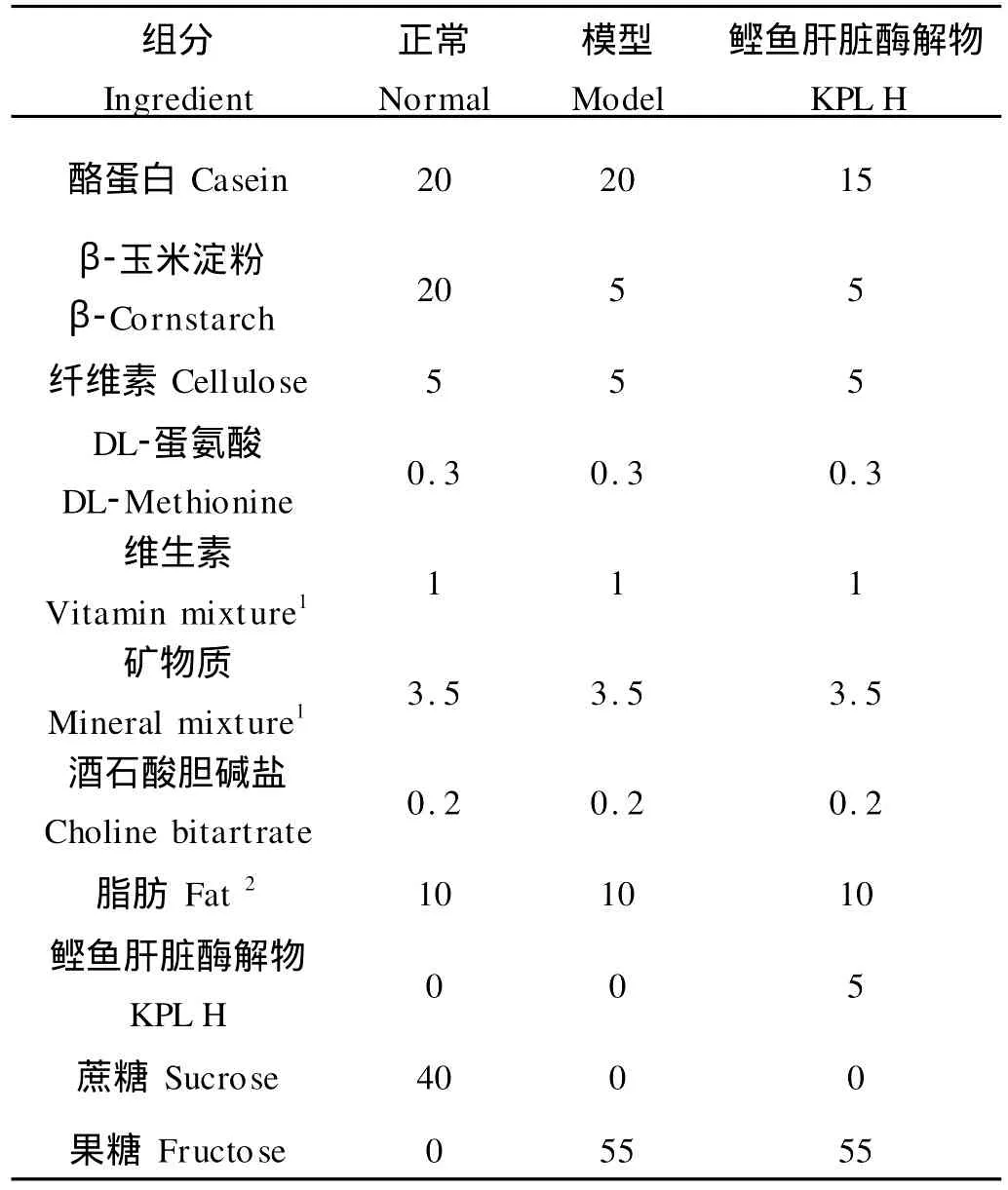
表1 实验饲料配方Table 1 The composition of experimental diets/%
2 实验结果
2.1 氨基酸组成
酪蛋白和KPLH的氨基酸组成如表2所示,KPLH中的酸性氨基酸和碱性氨基酸含量略低于酪蛋白,但必须氨基酸和中性氨基酸含量显著高于酪蛋白。

表2 氨基酸组成Table 2 The composition of amino acids/%
2.2 鲣鱼肝脏酶解物对大鼠体重、肝脏组织重量的影响
如表3所示,鲣鱼肝脏酶解物(KPLH)对大鼠摄食量、体质量增加和肝脏质量无显著影响。
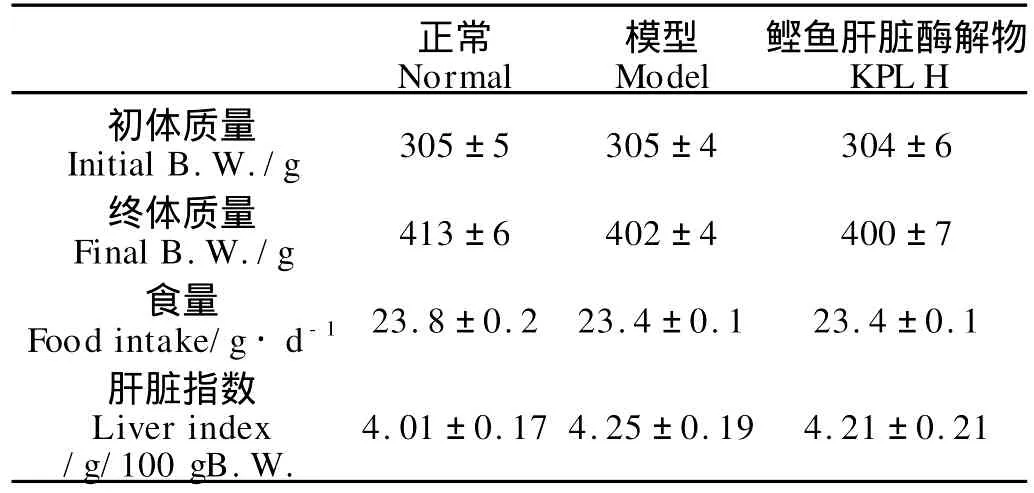
表3 KPLH对大鼠生长的影响Table 3 Effects of KPLH on the grow th parameters in rats(?x±S.E n=7)
2.3 鲣鱼肝脏酶解物对大鼠空腹血清指标的影响
由表4可以看出,高果糖饮食使模型组血清HDLC降低了16%(P<0.05)、脂联素降低了19%(P<0.05)、胰岛素水平升高了33%(P=0.12),胰岛素抵抗指数HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(nmol·min-1)/22.5[8]显著升高;喂食KPLH后大鼠血清HDL-C和脂联素浓度显著提高(25%和69%,P<0.05),胰岛素水平恢复到正常水平,但是对瘦素水平无显著的影响。
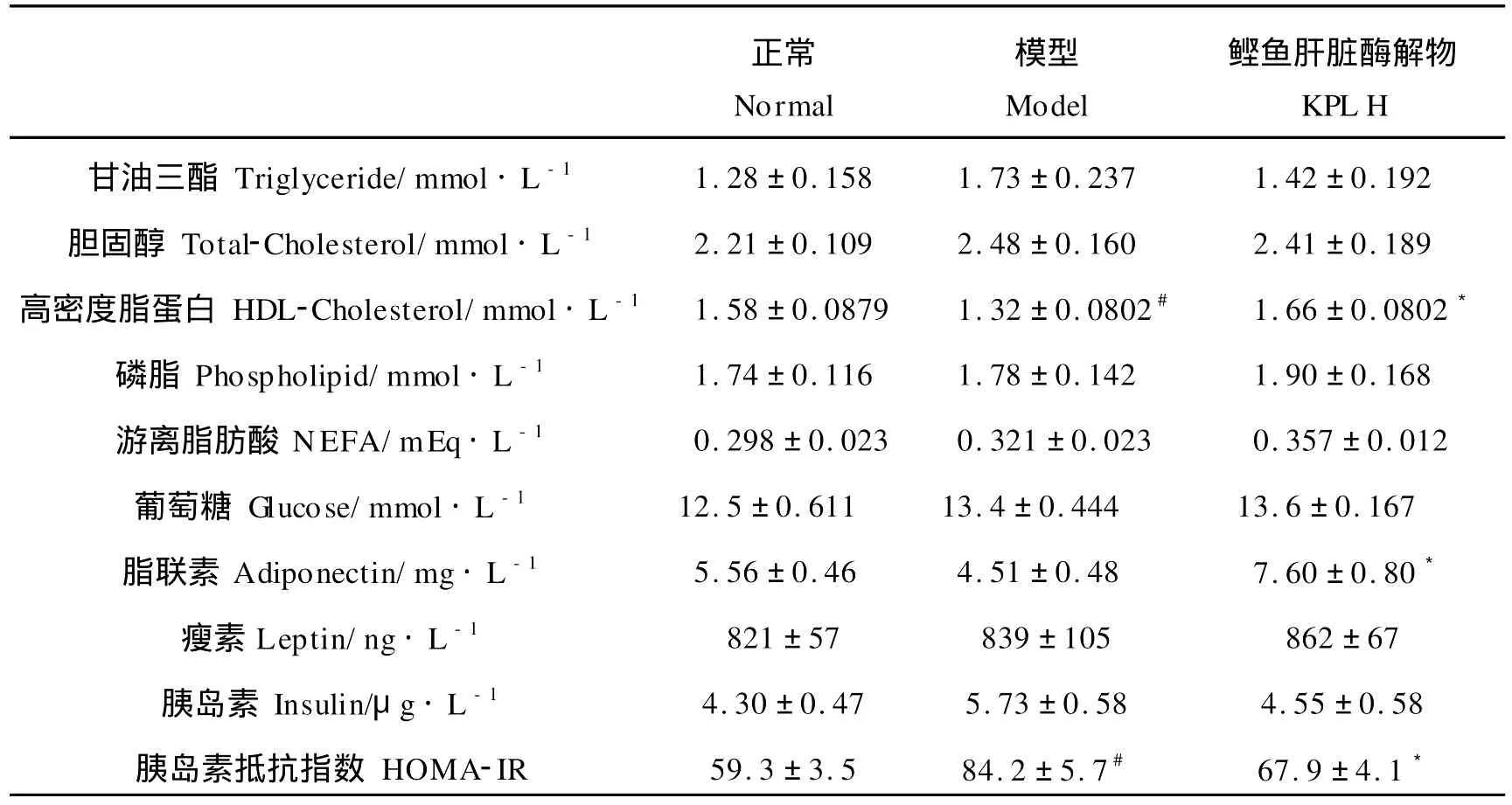
表4 KPLH对大鼠血清指标的影响Table 4 Effects of experimental diets on serum parameters in rats(?x±S.E n=7)
2.4 鲣鱼肝脏酶解物对大鼠血压的影响
给大鼠喂食含有大量果糖的饲料明显提高了大鼠血压,KPLH喂食2周后大鼠尾动脉收缩压明显低于对照组(9%,P<0.05)(见图1)。这表明,KPLH可有效预防高血压的发生。
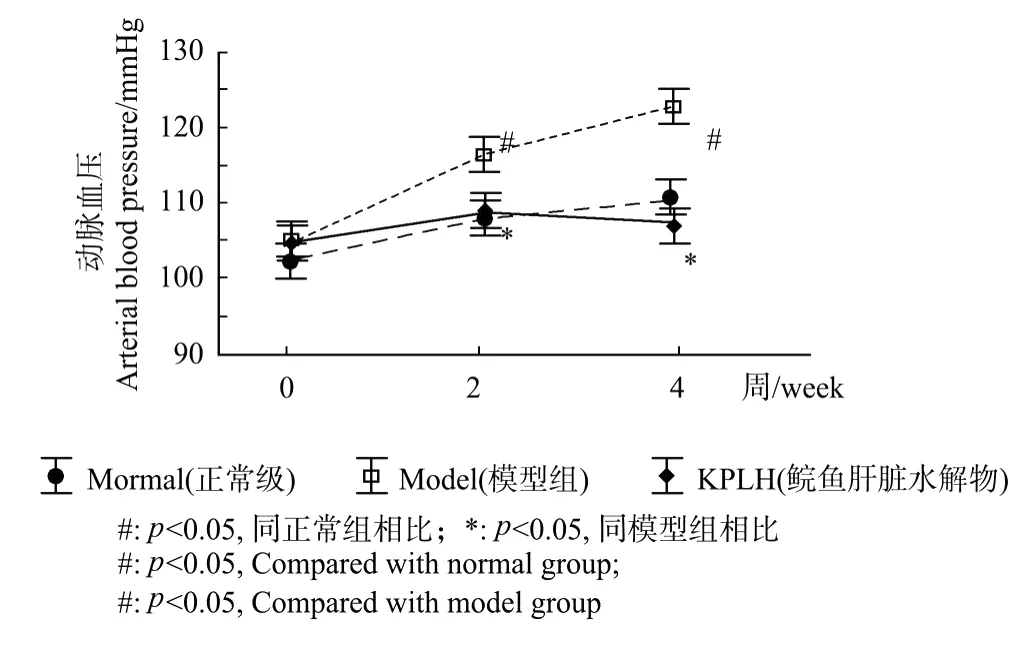
图1 KPLH对大鼠血压的影响Fig.1 Effect of KPLH on blood p ressure in rats
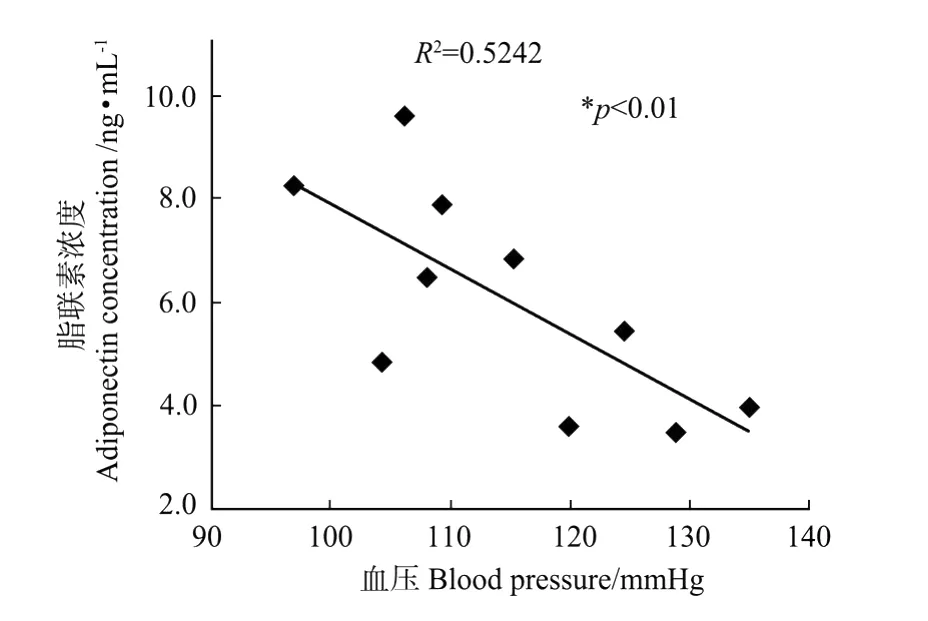
图2 血清脂联素浓度与血压相关性Fig.2 Correlation between blood pressure and serum adiponectin concentration
3 讨论
文献报道,喂食大鼠高果糖饲料2周后即可引起大鼠血压的升高,喂食4周后达到最高,是研究原发性高血压常用的主要非遗传性动物模型[6]。本实验结果显示,喂食高果糖饲料后大鼠尾动脉血压持续升高,第4周时血压较正常组升高20%,表明高血压模型造模成功(见图1)。本文研究了鲣鱼肝脏蛋白质酶解物KPLH的降压活性,KPLH的摄食可明显抑制由高果糖饲料引发的大鼠血压升高,喂食含5%KPLH的高果糖饲料2周后,大鼠血压较模型组降低9%(P<0.05),4周后较模型组降低15%(P<0.05),已达到正常血压水平。说明鲣鱼肝脏酶解物对高血压具有一定的预防作用。
鲣鱼肝脏蛋白质酶解物KPLH的主要成分是肽类,关于肽类的降压活性研究一般集中在直接抑制血管紧张素酶ACE活性方面[9-11],关于肽类对其他高血压因素的影响的体内研究较为少见。高果糖喂食引发的大鼠高血压发病与众多因素有关,如,胰岛素耐性、骨骼肌肌纤维组成变化、TNFα等脂肪细胞因子的增加等[12-13]。本实验结果显示,大鼠喂食高果糖饲料后,血糖水平未见显著升高,但胰岛素水平升高了33%(P=0.12),胰岛素抵抗指数HOMA-IR显著升高(P<0.01),表明大鼠体内存在明显的胰岛素抵抗性,喂食KPLH后大鼠HOMA-IR较模型组显著降低,胰岛素水平恢复到接近正常水平,胰岛素抵抗性得到显著改善。KPLH摄食对高果糖诱发的大鼠胰岛素抵抗性的改善可能是其抑制血压上升的原因之一。
最近的研究表明,由脂肪细胞分泌的脂肪活性因子瘦素(Lep tin)和脂联素(A diponectin)也对血压和胰岛素抵抗起重要的调节作用。瘦素会引起血压升高[14],而脂联素则可抑制血压上升[15-16],循环血液中的脂联素浓度与胰岛素抵抗引起的血压升高呈负相关[17],脂联素浓度的升高可以改善由高果糖饲料引发的胰岛素抵抗性。本研究结果显示,KPLH喂食大鼠4周后,空腹血清瘦素水平均未发生明显变化,但是,血清脂联素浓度却显著升高(P<0.05,见表2)。张闽等[12]研究发现果糖诱导的高血压与血清脂联素水平的降低有关。本实验进一步分析了动物血压与血清脂联素水平之间的相关性,结果显示,血清中脂联素浓度和大鼠血压之间有明显的负相关关系(P<0.001,R2=0.524,见图2),以上结果提示,KPLH对血压升高的抑制作用可能与其提高了血清中脂联素浓度有关。
综上所述,鲣鱼肝脏酶解物可改善大鼠胰岛素抵抗性,升高血清中与血压降低有关的脂肪细胞活性因子的水平,从而起到抑制高血压发生的作用。有关蛋白质酶解产物对胰岛素抵抗性以及脂肪细胞活性因子的影响国内外报道较少,其详细机制有待于进一步研究。
[1] 冯启浩,但乐平.一种新的风味和营养兼备的食品配料——柴鱼制品[J].中国食品添加剂,2002,2:74-77.
[2] 赵荣兴,缪圣赐.中西太平洋鲣鱼Katsuw onus pelam is(Linnaeus)的资源状况及产量[J].现代渔业信息,2005,20(3):13-14.
[3] 王玉明,王静凤,薛长湖.鲣肝脏水解物对大鼠脂肪代谢的影响[J].水产学报,2009,33(1):146-150.
[4] Saito M,Kunisaki N,Urano N,et al.Collagen as the ajor edible component of sea cucumber(Stichopus jaonicus)[J].Journal of Food Science,2002,7(4):1319-1322.
[5] 李予霞,王少珩.色氨酸分析方法的筛选研究[J].石河子大学学报,2001,5(1):41-44.
[6] Hwang IS,Ho H,Hoffman B B,et al.Fructose-induced insulin resistance and hypertension in rats[J].Hypertension,1987,10(5):512-516.
[7] Inoue N,Nagao K,Hirata J,et al.Conjugated linoleic acid prevents the development of essential hypertension in spontaneously hypertensive rats[J].Biochem Biophys Res Commun,2004,323:679-684.
[8] Bonora E,Formentini G,Calcaterra F,et al.HOMA-estimated insulin resistance is an independent predictor of cardiovascular disease in type 2 diabetic subjects[J].Diabetes Care,2002,25(7):1135-1141.
[9] 付雪艳,薛长湖,宁岩,等.中国毛虾酶解多肽降压作用的初步探讨[J].海洋科学,2005,29:20-23.
[10] 刘萍,陈黎斌,杨严俊.酶解玉米蛋白制备降血压肽的研究[J].食品工业科技,2006,27:117-119.
[11] 范俊峰,李里特,张艳艳,等.2种蛋白酶的大豆蛋白水解物对血管紧张素转换酶的抑制作用[J].食品与发酵工业,2004,30(1):80-84.
[12] 张闽,杨晔,刘敏,等.果糖诱导的高血压伴胰岛素抵抗大鼠血清脂联素肿瘤坏死因子α浓度的变化[J].心肺血管病杂志,2007,26(1):48-50.
[13] 李怡,李秋贵,浦信行,等.从骨骼肌纤维组成成分变化探讨糖肾胶囊对胰岛素抵抗改善的机制[J].中国医药学报,2000,15(1):20-22.
[14] 赵旭燕,李玉明,王波.胰岛素抵抗高血压大鼠血清瘦素水平与胰岛素抵抗的关系[J].心血管康复医学杂志,2005,14(1):14-16.
[15] Dogru T,Sonmez A,Tasci I,et al.Plasma adiponectin and insulin resistance in new onset hypertension[J].Endocrine,2006,29(3):405-408.
[16] Nagao K,Inoue N,Wang Y M,et al.Conjugated linoleic acid enhances plasma adiponectin level and alleviates hyperinsulinemia and hypertension in Zucker diabetic fatty(fa/fa)rats[J].Biochem Biophys Res Commun,2003,310(2):562-566.
[17] Benndorf R A,Rudolph T,Appel D,et al.Telmisartan imp roves insulin sensitivity in nondiabetic patients with essential hypertension[J].Metabolism,2006,55(9):1159-1164.

