诺氟沙星2种不同给药方式在中国对虾体内的残留及消除规律*
孙 铭,李 健,张 喆,王静凤
(1.中国海洋大学食品科学与工程学院,山东青岛266003;2.中国水产科学研究院黄海水产研究所,农业部海洋渔业资源可持续利用重点开放实验室,山东青岛266071)
诺氟沙星(No rfloxacin,NFLX)是氟喹诺酮类药物之一,具有抗菌谱广,抗菌力强,无交叉耐药性[1-2]等特点。在水产上主要应用于鱼、虾、蟹、鳖等水产养殖动物的弧菌、嗜水气单胞菌、柱状杆菌、爱德华氏菌等引起的出血、烂鳃、肠炎、腹水、败血等细菌疾病[3]。何平等研究了诺氟沙星在淡水青虾体内的药代动力学特征[4];陈文银研究了诺氟沙星在中华鳖体内的药代动力学[5];张雅斌等研究了诺氟沙星不同给药方式下的在鲤鱼中的药代特征[6];房文红研究了诺氟沙星在斑节对虾血淋巴中的药代特征[7]及2种给药方式下诺氟沙星在凡纳滨对虾体内的转运和消除规律[8]。诺氟沙星在人类疾病防治上也被临床广泛应用,成为治疗感染性疾病的重要药物。但此类药物在食品动物中的残留会引起人类病原菌对其产生耐药性,它产生的毒副作用还会对人体产生直接的危害,如对肝代谢有干扰作用,而且还破坏和减少体内红细胞、白细胞的数目,因而其在可食性动物组织中的残留问题已经日益引起人们的关注。目前,有关NFLX在中国对虾(Fenneropenaeus chinensis)体内的残留研究国内外尚未见报道,并且同一种药物在不同给药方式下其残留特征也有所差别。本实验模拟实际养殖条件,研究了药浴给药和药饵给药2种方式下NFLX在中国对虾组织中的残留及消除状况,为制定合理的休药期以及临床用药提供了理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康中国对虾,平均体质量(17.34±1.00)g,平均体长(11.81±0.60)cm,购于胶州宝荣水产科技有限公司。试验前暂养2周,投喂不含任何药物的配合饲料,海水取自宝荣水产科技有限公司养殖用水,水温(28±1)℃,盐度为18,连续充氧。1.1.2药品和试剂 诺氟沙星标准品(99.5%),诺氟沙星原粉(纯度为94.78%),乙腈和甲醇色谱纯,磷酸,三乙胺,正己烷,均为分析纯。
1.2 方法
1.2.1 标准曲线及检测限 将配置的浓度为0.01,0.02,0.05,0.1,0.2,0.5,1,2和5μg/m L诺氟沙星标准溶液,依次从低浓度到高浓度进行HPLC(Agilent-1100型)测定。用荧光检测器检测,记录其峰面积。以诺氟沙星浓度为横坐标(x),峰面积为纵坐标(y)做标准曲线。进行回归分析,求出回归方程和相关系数及曲线估计标准误差。
最低检测限的确定根据公式LOD=3×V×C/(S/N)计算的。其中V-进样体积(m L);C-最小检测浓度(μg/m L);S/N-信噪比。
1.2.2 回收率及精密度 回收率:一组取0.1、0.5、1、5μg/m L 4个水平的诺氟沙星标准液浓度各1 m L,分别加入1 g肌肉、肝胰脏、鳃和1 m L血淋巴4种空白组织中,每个浓度有3个平行,处理样品后进行HPLC测定;另一组为标准溶液经处理后进行HPLC测定。按照公式计算回收率。回收率=(处理前加入标准液样品的测定值/标准溶液的测定值)×100%。
精密度:取0.1、0.5、1、5μg/m L不同浓度诺氟沙星标准液,分别加入4种组织中,经处理后,制得的各浓度样品于1 d内分别重复进样5次和连续进样5d测定,计算各浓度水平响应值峰面积的变异系数C.V。
1.2.3 给药及取样 健康中国对虾360尾,随机分在36个200 L的桶里,药浴和药饵各18桶,每桶10尾,连续充气,暂养2周后用于实验。药饵给药:30 mg/kg·bw药饵连续投喂5 d,每天投喂4次;5 d后投喂空白饵料;药浴给药:10 mg/L药浴5 d。给药期间不换水,分别在0.5、2、4、6、9、12、24、48、96、144、216、288、384 h取血、肌肉、肝胰腺、鳃组织,每一个时间点随机取6尾虾用于药物分析。另取未给药的中国对虾作空白对照。全部样品-20℃冷冻保存用于药物分析。
1.2.4 样品的处理 准确称取1 g组织,置于50 m L离心管中,加入2 m L乙腈,用高速分散器匀散,再用2 m L乙腈清洗刀头,合并2次提取液,于振荡器上振荡30 s,静置2 h,然后5 000 r/min离心10 min,吸取全部上清液;在40℃恒温水浴下氮气吹干,残留物用1 m L流动相溶解,加入2 mL正己烷去脂肪,下层过0.22μm滤膜,过滤后的液体进行高效液相色谱测定。
1.2.5 测定条件 柱子条件:Agilent TC-C18(5μm,250×4.6 mm,I.D);流动相:乙腈:0.01 mol/L的磷酸溶液(三乙胺调节至p H 3.42)=16∶84(L/L);流速,1.0 mL/min;荧光检测器,激发波长280 nm,发射波长450 nm;柱温,30℃;手动进样量,20μL。
1.2.6 数据处理 将浓度-时间数据用计算机拟合,求出消除速率常数(β)和消除曲线方程;采用公式t1/2=0.693/β计算消除半衰期(t1/2);根据消除曲线方程计算理论休药期。
NFXL是按一级动力学过程从体内消除的,即在消除后期服从指数消除:Ci=C0e-kt,可以根据消除后期测定的组织药物浓度及规定的最高残留限量(M RL),计算各组织药物浓度降至规定水平所需时间:
2 结果
2.1 标准曲线及检测限
标准溶液在0.01~5μg/m L浓度范围内具有良好的相关性,线性回归方程y=908.26 x+15.67,R2=0.9999。本方法的最低检测限为0.01μg/m L。
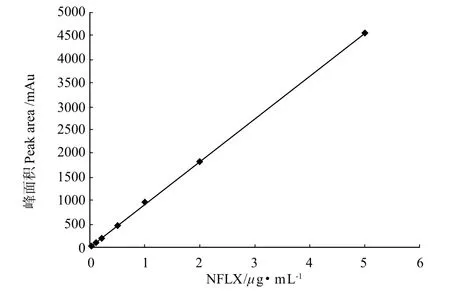
图1 荧光检测器所检测的峰面积与NFLX浓度的关系Fig.1 Relationship between peak area detected by FLD detector and norfloxacin concentrations
2.2 回收率(见表1)
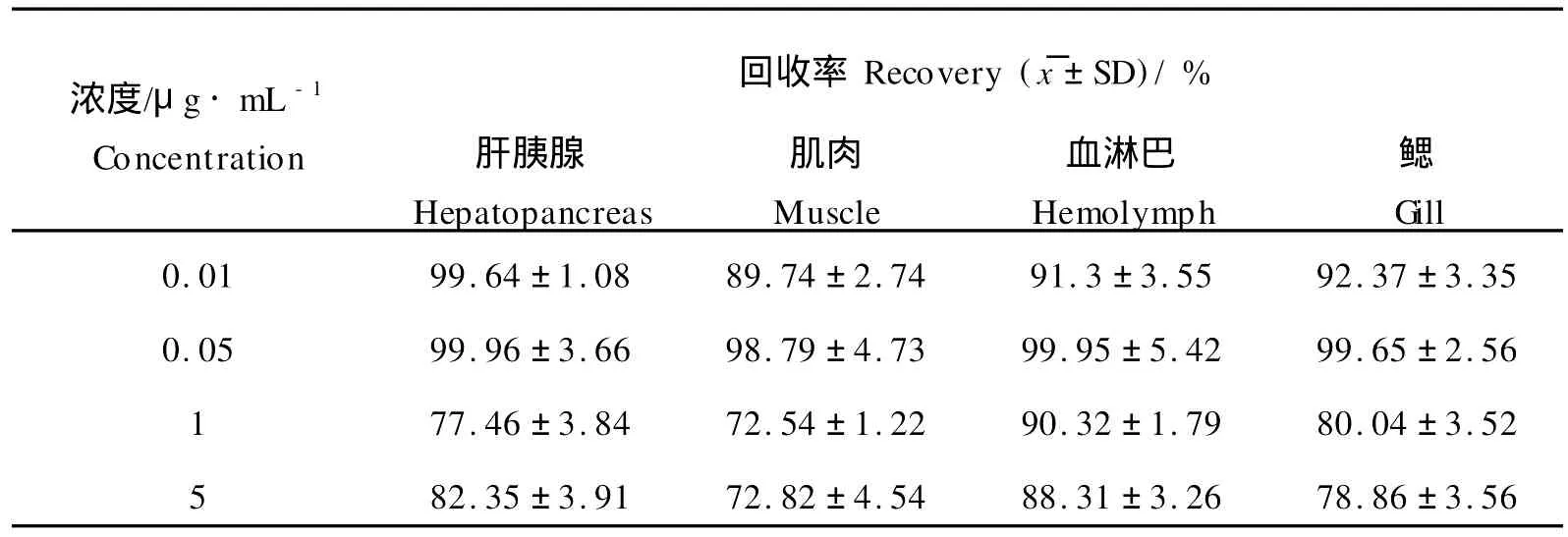
表1 诺氟沙星在肝胰腺、肌肉、血淋巴、鳃4种组织中的回收率Table 1 Recovery of Nor floxacin in hepatopancreas,musle,plasma,gill of Fennerropenaeus chinensis
2.3 精密度
按照精密度测定方法操作,测得4种组织中0.01,0.05,1和5μg·m L-14个浓度水平的日内精密度为(2.37±1.21)%~(3.78±1.25)%,日间精密度为(3.46±1.51)%~(4.08±1.63)%。
2.4 2种给药方式下诺氟沙星在组织中的分布及残留
2种给药方式下,药物在血淋巴和各组织中的分布如图2a~d,可以看出药物在血淋巴和肝脏、肌肉、鳃组织中的分布较广泛,但在同时间点里,肝脏中的药物浓度显著高于其他组织。给药后48 h除肝脏外,其他组织检出微量残留或未检出残留,给药144 h后各组织均未检测到药物。
2.4.1 诺氟沙星在鳃中的分布及残留 图2b中可以看出,药浴给药方式下,鳃中药物浓度在4 h达到药峰0.129μg·g-1,6 h后开始下降,在48 h消除到0;给药384 h后各组织均未检测到药物;而药饵给药方式下,鳃中药物浓度在2 h达到高峰0.028μg·g-1,随后开始下降,12 h后几乎检测不出。
2.4.2 诺氟沙星在血淋巴中的分布及残留 图2c中可以看出,药浴给药方式下,血淋巴中诺氟沙星表现为2个药峰,分别在4和24h,药物浓度分别为0.21和0.075μg·m L-1;而药饵给药方式下,血淋巴中诺氟沙星也分别在4和24 h表现出2个药峰,药物浓度分别为0.11和0.06μg·m L-1。从给药后血药浓度-时间变化曲线来看,在2种给药方式下,中国对虾血药浓度的变化趋势基本一致。但是,诺氟沙星药浴给药比药饵给药吸收程度好。
2.4.3 诺氟沙星在肝胰腺中的分布及残留 图2d可以看出,药浴给药下,肝胰腺中药物浓度在9 h到达药峰,浓度为1.361μg·g-1,12 h后迅速下降;而药饵给药下,肝胰腺药物浓度首先呈上升趋势,4 h就到达药峰为0.744μg·g-1,在随后几个小时肝胰腺中浓度相差不大,24 h开始下降。
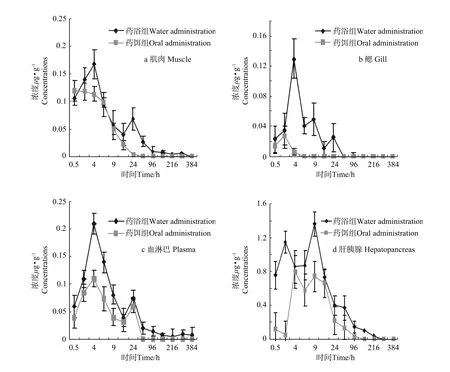
图2 中国对虾药饵给药(30 mg·kg-1)和药浴给药(10 mg·L-1)诺氟沙星后各组织的浓度-时间关系曲线Fig.2 Concentration of norfloxacin in four tissues of Fenneropenaeus chinensis following oral administration(30 mg·kg-1)and water administration(10 mg·L-1)
2.5 2种给药方式下诺氟沙星在中国对虾体内的消除
给药9 h后,药浴给药肌肉中诺氟沙星浓度高于药饵给药,但随后各采样点肌肉中诺氟沙星浓度均低于水产品诺氟沙星的残留限量50μg·kg-1。但肝胰腺和鳃中诺氟沙星在不同给药方式下相差较大。药浴给药下,鳃和肝胰腺中药物浓度明显高于药饵给药下鳃和肝胰腺中药物浓度,且药浴给药下肝胰腺中药物浓度达峰时间滞后5 h。
中国对虾经2种给药方式给药后,数据经回归处理得到血淋巴和肝胰腺、肌肉中药物浓度(C)与时间(t)的关系的消除曲线方程、相关指数(r2)及消除半衰期(T1/2)见表2。
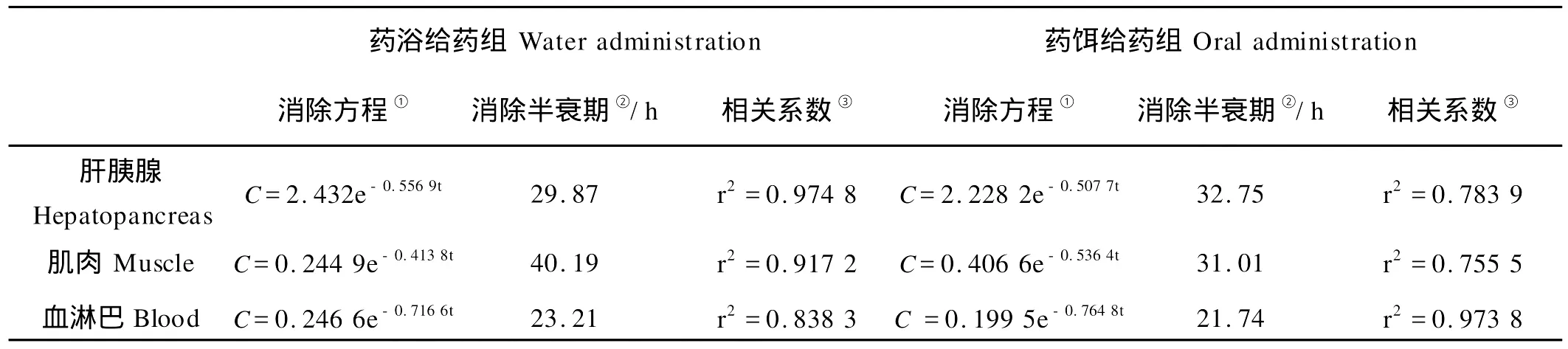
表2 中国对虾药浴给药和药饵给药后3种组织中诺氟沙星消除方程及消除参数Table 2 Elimination equation and parameters of norfloxacin in three tissues of Fenneropenaeus chinensis following oral administration and water administration
3 讨论
3.1 2种给药方式下诺氟沙星在中国对虾体内的转运途径
药饵给药方式下,对虾肝胰脏中的药物浓度在4 h时较高可能是诺氟沙星在中国对虾体内的“首过效应”,房文红、刘玉林等对此也有相关的报道[8-9]。对高等动物而言,口服给药时药物主要先通过胃肠黏膜及毛细血管,然后首先进入肝门静脉,通过肝脏后才能进入血液循环[10]。4 h达到最高浓度后,药物浓度开始下降,到9 h又达到1个峰值,即肝脏中出现了药物重吸收现象,出现这种原因可能是“肝胆循环”所致。与本实验中药饵给药肝胰脏中药物浓度高的相关报道有,美洲龙虾血窦内注射[11-13],美洲龙虾[13]和凡纳滨对虾口服OM P[14],均表现出肝胰脏中药物浓度高出其他组织的几十倍甚至上百倍。
药浴给药方式下,检测到各组织中都有诺氟沙星大量存在,推测诺氟沙星可经鳃吸收。鳃是中国对虾进行气体交换的场所,具有丰富的毛细血管。当药物经鳃进入对虾体内后,随着血液循环进入其他组织和器官。对于鳃对物质的吸收现象,其他文献也有报道。刘长发研究报道了金鱼鳃对铅和镉的吸收过程,研究结果表明当铅或镉颗粒随水流经过鳃表面时,部分水铝矿颗粒吸附在鳃丝表面黏液上,铅或镉以载体转运方式进入鳃组织,再转移到血液[15-16]。药物经鳃进入对虾体内,经过血液循环进入肝胰腺,对虾肝胰脏中的药物浓度在9 h时才达高峰,因此药浴给药方式下肝胰腺中药物达峰时间比药饵给药方式下滞后。
3.2 诺氟沙星在中国对虾组织中的残留及消除规律
诺氟沙星在中国对虾体内经药浴给药和药饵给药后,组织中的药物浓度显著高于血液中的浓度。而肝胰腺不仅是水产动物的解毒器官又是排泄器官,所以成为水生生物体内渔药残留的主要部位[17-18]。药浴给药方式下,肝脏与血液中的药物浓度比最高值可达10.45∶1;药饵给药方式下,肝脏与血液中的药物浓度比最高值为7.2∶1,说明该药物在体内的穿透力极强,广泛分布于各组织中。组织中的药物浓度较高,可用于全身及深部组织感染的治疗。水产动物的种属[19-20]、性别[21]、水温[22]、给药方式[6]、给药剂量[21-22]都会影响氟喹诺酮类药物的消除。给药途径不同主要影响生物利用度和药效出现的快慢。Oie S&Tozer T N研究表明,药物的吸收速度受到给药途径的影响,一般由快到慢依次为:静脉注射、肌肉注射、皮下注射、口服、药浴。郭锦朱和廖一久比较了不同给药方式下带点石斑鱼(Epinephelis)对氟甲奎的吸收、分布和消除发现,药饵方式给药生物利用度比药浴方式高得多,分别为44%和9%。Mal wisi Let等对鲤诺氟沙星药动学比较研究也指出,诺氟沙星口灌比肌注和混饲吸收程度都要好,混饲给药吸收速度较慢且生物利用也低。本文研究发现,诺氟沙星药浴给药与药饵给药相比,在体内残留量大,消除时间长。这种现象可能与对虾对药饵没有完全摄入有关或者药饵一部分溶于水体,也可能与连续药浴时鳃的吸收作用有关;再者就是药浴给药剂量是推荐剂量的2.5倍,而药饵给药剂量按照推荐剂量给药,2种给药方式给药剂量与推荐剂量相比,药浴给药剂量更大。
3.3 2种给药方式下血药浓度出现“双峰”现象
本研究在2种给药方式下,中国对虾的血药-浓度关系曲线出现2个药物浓度峰,称为“双峰”现象。该现象与南美白对虾[23]、凡纳滨对虾[8]血淋巴的研究结果一致。关于药物吸收出现双峰或多峰现象及其机制的研究在兔、鼠等其他动物已有报道[24-25],这可能与肝肠循环、胃肠循环、吸收速率等有关[26]。药物药-时曲线第二峰的出现,相当于一次“自体给药”的过程,势必影响药物作用强度及消除过程[27],但对于产生机理的探讨有待继续研究。在制定临床给药方案时,应注意“双峰现象”的影响。
3.4 休药期的制定
目前,欧盟、美国禁止诺氟沙星用于食品动物,我国尚未见禁止NFLX在食品动物中使用的报道。欧盟对氟喹诺酮类药物(恩诺沙星、环丙沙星、单诺沙星)在食品动物中MRL的规定:肌肉组织中为100μg·kg-1,肝脏和肾脏组织中为200μg·kg-1,在有关家禽及猪组织中NFLX的MRL为:50μg·kg-1,NFLX在水产品中的M RL尚未确定,因此本实验中NFLX的M RL暂以50μg·kg-1为标准。在温度(28±1)℃条件下,中国对虾经药饵给药(30mg·kg-1)和药浴给药(10mg·L-1)后,要想降到50μg·kg-1的残留限量,NFLX在对虾肌肉中的休药期分别不得低于(3.90和3.84 d)。由于温度对药物残留的影响非常大,随着温度的升高,药物在水产动物体内的代谢速度加快,药物残留量低。Ellis A E等研究表明,温度升高1℃,药物代谢速度增加10%。由于药物在动物体内的消除受许多因素的影响,因此关于休药期的制定应多方面考虑。本实验条件下所制定的休药期适应于本实验的条件,当条件有所区别时,本休药期仅作参考。
[1] 郭惠元.我国诺酮类抗菌药物研究开发概况[J].中国医药工业杂志,1989,20(9):421-424.
[2] Vancutsem P,Babish J G,Scward W S.The fluoroquinolones antimicrobial:struettire,antimicrobial animals and toxicity[J].Cornell Vet,1990,80(2):173-186.
[3] 杨先乐,王民权,杨勇.诺氟沙星在大黄鱼血浆和肌肉中的RPHPLC检测方法[J].水产学报,2004,28(12):1-6.
[4] 何平,尹文林,沈锦玉,等.诺氟沙星在淡水青虾体内药物代谢动力学研究[J].浙江海洋学院学报,2008,27(2):135-139.
[5] 陈文银,印春华.诺氟沙星在中华鳖体内的药代动力学研究[J].水产学报,1997,21(4):434-437.
[6] 张雅斌,张祚新,郑伟,等.不同给药方式下鲤对诺氟沙星的药代动力学研究[J].水产学报,2000,24(6):559-563.
[7] 房文红,邵锦华,施兆鸿,等.斑节对虾血淋巴中诺氟沙星含量测定及药代动力学[J].水生生物学报,2003,27(1):13-17.
[8] 房文红,杨先乐,周凯.诺氟沙星在凡纳滨对虾不同组织中处置和消除规律[J].水产学报,2004,28(增刊):19-24.
[9] 刘玉林,王翔凌,杨先乐,等.诺氟沙星在大黄鱼体内的药代动力学及残留研究[J].水产学报,2007,31(5):655-660.
[10] 林志彬,金有豫.医用药理学基础[M].北京:世界图书出版公司,1998:4-18.
[11] Barron M G,Gedutis C,James M O.Pharmacokinetics of sulphadimethoxine in the lobster,Homerus americannus,following intrapericardial administration[J].Xenobiotica,1988,18(3):269-277.
[12] James M O,Barron M G.Disposition of sulfadimethoxine in the lobster(Homarus americanus)[J].Vet Hum Toxicol,1988,30(suppl):36-40.
[13] James M O,Herbert A H.Disposition of ormetop rim in the lobster,Homarus americanus[J].Pharm Res,1988(5):196-203.
[14] Park E D,Lightner D V,Milner N,et al.Exp loratoxy bioavailability and pharmacokinetic studier of sulphadimethoxine and ormetop rim in the penacid shrimp,Penaeus tannamei[J].Aquac;1995,130(2,3):113-128.
[15] 刘长发,陶澍,曹军,等.金鱼鳃对颗粒吸附态铅的吸收[J].应用生态学报,2000,11(2):283-286.
[16] 刘长发,陶澍,龙爱民.金鱼对颗粒态镉的鳃吸收[J].环境科学学报,2001,21(1):24-28.
[17] 李美同,郭文林,仲锋.土霉素在鳗鲡组织中残留的消除规律[J].水产学报,1997,21(1):39-43.
[18] 朱秋华,钱国英.3种药物在甲鱼体内的残留研究[J].中国水产科学,2001,8(1):50-53.
[19] 杨先乐,刘至治,恒山雅仁.盐酸环丙沙星在中华绒鳌蟹体内药物代谢动力学研究[J].水生生物学报,2003,27(1):18-21.
[20] 方星星,李健,王群,等.复方新诺明在花鲈体内的残留及消除规律[J].海洋科学,2003,27(9):16-20.
[21] Ho S P,Cheng C F,Wang W S.Pharmacokinetic and depletion studies of sarafloxacin after oral administration to eel(Anguilla anguilla)[J].Journal of Veterinary Medical Science,1999,61(5):459-463.
[22] Martinsen B,Horsberg T E,Bruke M.M ultiple-dose pharmacokinetic and depletion studies of sarafloxacin in Atlantic salmon(salmo salar)[J].Journal of Fish Diseases,1994,17(2):111-121.
[23] 房文红,郑国兴.肌注和药饵给药下诺氟沙星在南美白对虾血淋巴中药代动力学[J].水生生物学报,2006,30(5):541-546.
[24] 周怀梧,沈佳庆,吕明,等.吡罗昔康在家兔体内的肠肝药物动力学分析[J].中国药理学报,1992,13(2):180-182.
[25] 陈淑娟,杨毅梅,刘奕明,等.蝙蝠葛碱大鼠体内药物代谢动力学研究[J].中国药理学通报,2001,17(2):225-229.
[26] 顾培德.阿斯匹林血药浓度双峰现象初探[J].苏州医学院学报,1996,16(1):44.
[27] 林武,梁文权,赵伟红,等.炎痛喜康药物动力学的双峰现象[J].浙江医科大学学报,1991,20(4):150-152.

