具荧光活性的节旋藻藻蓝蛋白α亚基在大肠杆菌中的重组表达*
衣俊杰,臧晓南,张学成**,袁定阳,赵炳然,唐 俐
(1.中国海洋大学海洋生命学院,山东青岛266003;2.国家杂交水稻工程技术研究中心,湖南长沙,410125)
藻胆蛋白是广泛存在于蓝藻、红藻、隐藻和少数甲藻中的一类光合作用捕光色素蛋白,光吸收区位于蓝绿光区,能够利用高等植物不能吸收的光能并传递到光合作用反应中心[1]。根据藻胆蛋白吸收光谱性质的差异,可将其分为四大类藻红蛋白(Phycoerythrin)、藻蓝蛋白(Phycocyanin)、藻红蓝蛋白(Phcoerycyanin)和异藻蓝蛋白(Allophycocyanin)。藻胆蛋白是一类寡聚体蛋白,基本结构单位是α亚基和β亚基,每个亚基接连着1~4个色基,使藻胆蛋白具有特定的吸收光谱[2]。
藻胆蛋白中的色基称为藻胆素,是1种具有开链四吡咯结构的化合物。目前在蓝藻中研究的比较清楚的藻胆素共有4种,分别是藻红胆素(Phycoerythrobilin,PEB)、藻蓝胆素(Phycocyanobilin,PCB)、藻尿胆素(Phycourobilin,PUB)和藻紫胆素(Phycoviolobilin,PVB)[3]。藻胆素通过硫醚键与脱辅基蛋白的半胱氨酸残基交联而共价结合在脱辅基蛋白上形成藻胆蛋白。藻蓝蛋白只含有藻蓝胆素这一种色基,分别位于α-84位、β-82位和β-153位。
色基与脱辅基蛋白的结合一般需要相应的藻胆色素裂合酶催化。现已研究证明裂合酶CpcE和CpcF在合适的条件下催化PCB特异性的连接到藻蓝蛋白α亚基的合适位点形成正确的连接产物[3-4]。Tooley A J.等[5]克隆了Synechocystis sp.PCC 6803的藻蓝蛋白α亚基基因cpc A、催化脱辅基蛋白与色基结合的裂合酶基因cpc E和cpc F,以及催化藻蓝胆素生成的铁氧蛋白氧化还原酶基因pcy A和亚铁血红素氧化酶基因hox1,在大肠杆菌内实现了藻蓝胆素的生物合成和具有荧光活性的藻蓝蛋白α亚基的生物合成。Guan等[6]利用Synechocystis sp.PCC6803的相关催化酶催化螺旋藻藻蓝蛋白α亚基得到具有荧光活性的螺旋藻藻蓝蛋白α亚基,但是目前没有关于用节旋藻自身的裂合酶CpcE和CpcF催化其藻蓝蛋白α亚基与色基结合的相关报道。
节旋藻是1种具有食用及药用价值的经济藻类,其中含有的藻蓝蛋白可作为1种天然色素应用于食品、化妆品等领域[7]。藻蓝蛋白不仅具有抗氧化、抗肿瘤、抗炎性等生理活性[8],而且还可作为1种荧光物质,用于生物的荧光标记和光动力学治疗[9-10]。
为探索节旋藻藻蓝蛋白的生物合成机理,本实验克隆了节旋藻的藻蓝蛋白α亚基基因cpc A,以及4个关键酶基因cpc E、cpc F、pcy A和hox1(hox1来自集胞藻Synechocystis sp.PCC6803)。将cpc A、cpc E和cpc F基因构建到质粒pACYCDuet-1中,hox1和pcy A基因构建到质粒p ET-24a(+)中,用电击法将含有5个基因的2个质粒共同转入大肠杆菌,通过体内重组表达研究证实节旋藻自身的裂合酶CpcE和CpcF能够催化藻蓝蛋白α亚基与色基结合产生有荧光活性的藻蓝蛋白,进一步充实验证了人工合成有光能传递活性节旋藻藻蓝蛋白的途径,为表达有荧光活性的藻蓝蛋白提供理论和实验基础。
1 材料和方法
1.1 材料与试剂
E.coli DH5α,E.coli BL 21(DE3),Arthrospira platensis FACHB 314,Synechocystis sp.PCC 6803由本实验室保存。Taq酶、限制性内切酶、克隆载体pMD18-T Simple Vector、连接试剂盒DNA Ligation Kit Ver.2.0均为TA KARA公司产品。表达载体pACYCDuet-1购自Novagen公司,p ET-24a(+)由池振明教授惠赠。氨苄青霉素、卡那霉素、氯霉素购自Sigma公司。IPTG为Solarbio产品。DNA回收试剂盒,质粒提取试剂盒购自天根公司。引物和测序均有上海博尚公司完成。
1.2 基因组提取与基因片段的PCR扩增
采用CTAB新法提取Arthrospira platensis FACHB314以及Synechocystis sp.PCC 6803全基因组DNA。设计了5对引物,引物序列具体如下:

以Arthrospira platensis FACHB314基因组DNA为模板,PCR扩增基因cpc A(引物为cpcA-1,cpcA-2)、cpc E(引物为cpcE-1,cpcE-2)、cpc F(引物为cpcF-1,cpcF-2)、pcy A(引物为pcyA-1,pcyA-2),以Synechocystis sp.PCC 6803基因组DNA为模板,PCR扩增基因hox1(引物为hox1-1,hox1-2)。PCR扩增条件均为:预变性94℃,5 min,然后按94℃,50 s;59℃,50 s;72℃,50 s循环30次;最后72℃延伸8 min。经PCR扩增出来的5个基因片段分别连接到pMD18-T Simple Vecto r上,转化大肠杆菌DH5α,用含Amp的平板进行筛选,经PCR检测和测序鉴定阳性克隆得到质粒pMD18T-cpc A,pMD18T-cpc E,pMD18T-cpc F,pMD18T-pcy A,pMD18T-hox1。
1.3 表达载体的构建
Bam H I-Sac I双酶切质粒pMD18T-cpc A,得到的cpc A片段与同样双酶切的载体pACYCDuet-1连接,得到重组质粒pACYCDuet-cpc A。Nde I-BglⅡ双酶切质粒pMD18T-cpc E,得到的cpc E片段与同样双酶切的载体pACYCDuet-cpc A连接,得到重组质粒p ACYCDuet-cpc A-cpc E。BglⅡ-Xho I双酶切质粒pMD18T-cpc F,得到的cpc F片段与同样双酶切的载体pACYCDuet-cpc A-cpc E连接,得到重组质粒pACYCDuetcpc A-cpc E-cpc F。以上3种质粒均需转化大肠杆菌DH5α,用含氯霉素的平板进行筛选,经PCR检测和测序鉴定阳性克隆。Bam H I-Sac I双酶切质粒pMD18T-hox1,得到的hox1片段与同样双酶切的载体p ET-24a(+)连接,得到重组质粒p ET-hox1。Sac I-SalI双酶切质粒pMD18T-pcy A,得到的pcy A片段与同样双酶切的载体p ET-hox1连接,得到重组质粒p ET-hox1-pcy A。以上2种质粒均需转化大肠杆菌DH5α,用含卡那霉素的平板进行筛选,经PCR检测和测序鉴定阳性克隆。
1.4 转化与蛋白质表达
重组体系Ⅰ:将质粒pACYCDuet-cpc A和p ET-hox1-pcy A通过电击法共转化大肠杆菌BL 21(DE3),用含氯霉素和卡那霉素的平板筛选,经PCR检测鉴定阳性克隆。重组体系:将质粒p ACYCDuet-cpc A-cpc E-cpc F和p ET-hox1-pcy A通过电击法共转化大肠杆菌BL 21(DE3),用含氯霉素和卡那霉素的平板筛选,经PCR检测鉴定阳性克隆。将含各种表达质粒的BL 21(DE3)分别在37℃培养至OD600值约为0.6,加入IPTG至终浓度为1 mmol/L,28℃低温诱导6 h后,测量其OD600值,确保2个重组体系离心收集的菌体量一致,2次蒸馏水洗2次菌体沉淀,-20℃保存。
1.5 重组蛋白的超声波破碎
将冻存的细胞重悬于0.1 mol/LPBS(p H=7.2)中,采用Sonics超声波破碎仪对样品进行超声破碎,共处理6 min(破碎5 s,间隔2.5 s),离心后得上清[11]。
1.6 SDS-PAGE电泳、Western Blotting及光谱检测
蛋白样品进行SDS-PAGE分析以及Western Blotting检测。
荧光光谱用H ITACH I F-4500型荧光光谱仪,荧光光谱扫描速度240 nm/min,狭缝宽度5.0 nm。
2 结果
2.1 基因的克隆与载体构建
由5对引物cpcA-1/cpcA-2、cpcE-1/cpcE-2、cpcF-1/cpcF-2、pcyA-1/pcyA-2、hox1-1/hox1-2分别扩增出大小为492 bp,876 bp,615 bp,720 bp和750 bp的基因片段,测序结果与实际序列一致。对获得的重组质粒pACYCDuet-cpc A、pACYCDuet-cpc A-cpc E-cpc F和p ET-hox1-pcy A进行酶切和PCR检测,均得到相应片段,电泳结果与预计符合(见图1)。

图1 p ET-hox1-pcy A,pACYCDuet-cpc A-cpc E-cpc F的PCR检测电泳图Fig.1 Agarose gel electrophoresisof PCR p roducts of p ET-hox1-pcy A and pACYCDuet-cpc A-cpc E-cpc F
2.2 蛋白表达
重组体系Ⅰ:将pACYCDuet-cpc A和p ET-hox1-pcy A通过电击法共同转化大肠杆菌BL 21(DE3),表达菌诱导6 h后离心收集的菌体沉淀呈现蓝绿色(见图2),超声破碎菌体,离心,将得到的上清通过SDSPAGE电泳以及Western Blotting,检测到了表达的目的蛋白(见图3)。

图2 经诱导后不同的表达菌株呈现不同程度的蓝绿色Fig.2 The different E.coli cells appears different blue-green colors after induced
重组体系Ⅱ:将pACYCDuet-cpc A-cpc E-cpc F和p ET-hox1-pcy A通过电击法共转化大肠杆菌BL 21(DE3),表达菌诱导6 h后离心收集的菌体沉淀呈现蓝绿色(见图2),超声破碎菌体,离心,将得到的上清通过SDS-PAGE电泳以及Western Blotting,检测到了表达的目的蛋白(见图3)。
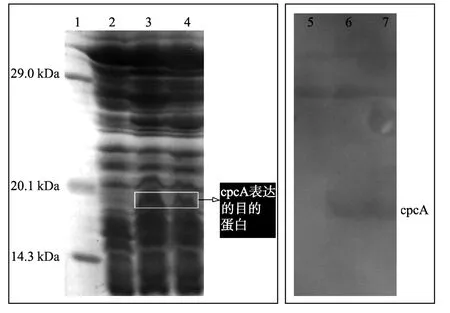
图3 表达产物SDS-PAGE电泳图及Western Blotting图Fig.3 SDS-PAGE and western blo tting of the supernatant of the broken E.coli cells
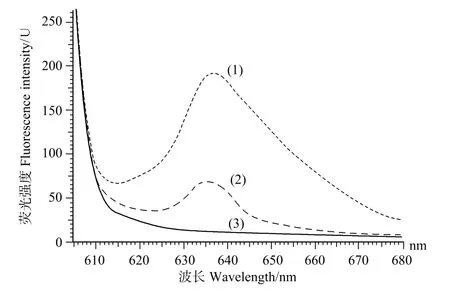
图4 细胞上清液的荧光光谱Fig.4 Fluorescence emission spectra of the supernatant of the broken E.coli cells
2.3 光谱分析
重组体系Ⅰ与重组体系Ⅱ表达菌诱导培养6 h后,离心收集菌体经超声破碎得到的上清液进行荧光光谱检测发现,在590 nm激发波长下,重组体系Ⅱ的最大荧光发射峰为637.8 nm,荧光强度为192.6 U;重组体系Ⅰ的最大荧光发射峰为636.8 nm,荧光强度为66.37 U(见图4)。
3 讨论
本实验将在大肠杆菌体内表达出有荧光活性的节旋藻藻蓝蛋白α亚基所需要用到5个基因(藻蓝蛋白α亚基基因cpc A,裂合酶基因cpc E和cpc F、血红素氧化酶基因hox1、铁氧蛋白氧化还原酶基因pcy A)分别构建到2个相容的载体p ET-24a(+)和pACYCDuet-1上,得到2组重组体系:重组体系Ⅰ(pACYCDuetcpc A及p ET-hox1-pcy A)和重组体系Ⅱ(p ACYCDuet-cpc A-cpc E-cpc F及p ET-hox1-pcy A)。
重组实验结果表明,重组体系Ⅱ表达出了有荧光活性的藻蓝蛋白,菌体颜色呈现蓝绿色,证实在节旋藻裂合酶CpcE和CpcF的催化下得到了具有荧光活性的节旋藻藻蓝蛋白α亚基。而无裂合酶催化的重组体系Ⅰ的菌体也呈现一定的蓝绿色,但是颜色比较淡,推测重组体系Ⅰ可能也表达了一定量有荧光活性的藻蓝蛋白。SDS-PA GE电泳结果表明2个菌株均表达了目的蛋白,从图谱上看,重组体系Ⅰ所表达出的蛋白量比重组体系Ⅱ的多;Western Blotting检测结果表明2个体系表达出的α亚基与天然的藻蓝蛋白具有相同的抗原性。
在以往研究中提到藻蓝蛋白α亚基具有自催化作用,但是α-84的自发连接却缺乏特异性,底物PCB在自发连接过程中多数已经被氧化成181,182-二氢胆绿素。但是陈芳等[12]在进行鱼腥藻PCC7120藻蓝蛋白α亚基体内重组研究时,发现没有裂合酶催化的表达体系与有裂合酶催化的表达体系相比产生了0.2%的有荧光活性的藻蓝蛋白。
荧光光谱分析结果显示,在590 nm的激发波长下,2个重组体系的荧光发射峰一致,均在638 nm左右,这说明二者都表达了有荧光活性的藻蓝蛋白。但是重组体系Ⅰ荧光强度远远低于重组体系Ⅱ,而且从SDS-PAGE电泳结果显示重组体系Ⅰ所表达的藻蓝蛋白α亚基的量多于重组体系Ⅱ的,上述结果可以证明藻蓝蛋白α亚基有一定的自催化作用,在无裂合酶CpcE和CpcF的存在下,也能合成有光学活性的节旋藻藻蓝蛋白α亚基,但是自催化能力比较低,这同时也证明节旋藻藻蓝蛋白α亚基与其色基结合主要依赖于裂合酶CpcE和CpcF的催化作用。
Guan等利用1个载体的多基因组合生物表达,证明Synechocystissp.PCC6803裂合酶CpcE和CpcF可以催化螺旋藻α亚基与色基的结合[6,14-15]。本实验证实了节旋藻的裂合酶CpcE和CpcF在催化节旋藻藻蓝蛋白α亚基与色基结合中的作用,进一步充实了人工合成有荧光活性节旋藻藻蓝蛋白的途径,为在水稻中表达有光学活性的藻蓝蛋白提供理论和实验基础。
[1] 何培民.海藻生物技术及其应用[M].北京:化学工业出版社,2007:199.
[2] Gantt E.Phycobilisomes:Light-harvesting pigment complexes.BioSience,1975,25:781-788.
[3] 王广策,邓田,曾呈奎.藻胆蛋白的研究概况(Ⅰ)一藻胆蛋白的种类与组成[J].海洋科学,2000,24(2):22-5.
[4] 王广策,邓田,曾呈奎.藻胆蛋白的研究概况(Ⅱ)—藻胆蛋白的结构及其光谱特性[J].海洋科学,2000,24(3):19-22.
[5] Aaron J Tooley,Yuping A Cai,A lexander N Glazer.Biosynthesis of a fluorescent cyanobacterial C-phycocyanin holo-αsubunit in a heterologous host[J].PNAS,2001,98(19):10560-10565.
[6] Xiangyu Guan,Song Qin,Zhongliang Su,et al.Combinational biosynthesis of a fluo rescent cyanobacterial Holo-α-Phycocyanin in escherichia coli by using one exp ression vecto r[J].App lied Biochemistry and Biotechnology,2007,142:52-59.
[7] 张学成.螺旋藻—最完美的功能食品[M].青岛:青岛海洋大学出版社,1999.
[8] 李冰,张学成,高美华,等.钝顶螺旋藻藻蓝蛋白和多糖的抗肿瘤免疫活性研究[J].中国海洋大学学报:自然科学版,2004,34(3):396-402.
[9] 卓素珍,张虹.螺旋藻中藻蓝蛋白的生理功能及其提取纯化研究进展[J].食品科技,2008,33(1):150-152.
[10] 范敏,王雪青,段开红,等.螺旋藻藻蓝蛋白光敏作用的研究进展[J].生命科学,2008,20(2):283-286.
[11] 赵金梅,朱菁萍,王锋,等.层理鞭枝藻藻蓝蛋白β亚基的体内重组[J].武汉大学学报:理学版,2006,52(4):481-486.
[12] 陈芳,周明,赵岩,等.鱼腥藻PCC7120藻蓝蛋白α亚基体内重组研究[J].武汉植物学研究,2006,24(5):387-391.
[13] Jianhui Zhou,Gail E Gasparich,Veronica L Stirewalt,et al.The cpc E and cpc F genesof Synechococcus sp.PCC 7002[J].Biological Chemistry,1992,267(23):16138-16145.
[14] 关翔宇.藻蓝蛋白组合生物合成及蓝藻连接多肽生物进化研究[D].青岛:中国海洋大学海洋生命学院,2008.
[15] X Y Guan,W J Zhang,XW Zhang,et al.A potent anti-oxidant p roperty:fluorescent recombinant alpha-phycocyanin of Spirulina[J].Appl Microbiol,2009,106(4):1093-1100.

