饲料中硒和α-硫辛酸对皱纹盘鲍稚鲍抗氧化反应的影响*
陈齐勇,张文兵,麦康森,马洪明,刘付志国
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
水生动物由于生活环境较为复杂,体内的活性氧(ROS)水平常因水中溶解氧、温度以及毒素等环境因子的异常变化而升高,以至超过自身抗氧化系统的清除能力,这时过量的ROS由于其高度活跃的化学性质往往引起蛋白、脂肪、核酸等生物大分子氧化进而导致细胞损伤[1-2]。大量研究表明,多种疾病的发生都与体内的ROS水平有着直接的关系[3]。因此,关注水生动物的健康应该对其体内氧化和抗氧化的动态平衡引起重视。
硫辛酸的抗氧化功能在众多的“离体”和“在体”试验中都已得到证实[3-5]。它不仅能够清除氧自由基、螯合重金属离子,还具有修复氧化损伤的作用[3]。然而,硫辛酸同时具有促氧化效应[3],这主要取决于氧化应激的形式和机体的生理状态[6]。目前为止,对硫辛酸的抗氧化作用的研究主要集中于陆生脊椎动物[7-10],在水生动物中发表的相关数据较少。
硒是动物必需的微量元素,也是1种潜在的抗氧化剂,常作为谷胱甘肽过氧化物酶的活性中心参与抗氧化作用[11]。Tirosh等[12]对H T4神经细胞株的研究发现,硒和硫辛酸的协同作用能更为有效地保护细胞免受谷氨酸盐的氧化损伤。万敏等[13]研究发现饲料中硒和维生素E的相互作用显著影响皱纹盘鲍血清过氧化氢酶(CA T)、谷胱甘肽还原酶(GR)和谷胱甘肽过氧化物酶(GPX)的活性。当饲料中含有450 IU/kg的维生素E时,添加0.6 mg/kg的硒能使皱纹盘鲍血清中的抗氧化物酶系统总体达到相对平衡,从而有效的抵抗氧化胁迫[13]。
在影响皱纹盘鲍抗氧化能力的营养因子方面,发表的数据主要集中在维生素上,如维生素D[14]、维生素A[15]、维生素E[16]、维生素E和硒的交互作用[13]。本研究的目的是探讨饲料中硒和硫辛酸对皱纹盘鲍抗氧化反应的影响,为从营养途径提高皱纹盘鲍抗氧化胁迫的能力提供基础数据。
1 材料与方法
1.1 试验设计和饲料配制
基础饲料参照Mai等[17]的配方,以酪蛋白和明胶为蛋白源,鲱鱼油和大豆油(1∶1)为脂肪源,糊精为主要糖源,辅以纤维素、维生素、矿物质等配制而成。利用2×3的双因素试验设计,分别添加硒(0,1 mg/kg)和硫辛酸(0,800,3 200 mg/kg)配制成6种半精制饲料。其中,硫辛酸(纯度98%,DL-α-Lipoic acid)由Lancaster公司提供,硒源为Na2SO3·5H2O。基础饲料中常规指标包括粗蛋白、粗脂肪和粗灰分的测定参照AOAC[18]。
饲料制作参照Zhang等[19],稍作修改,原料经粉碎过100目筛后,用电子天平按配方比例准确称取,将其充分混匀,辅以其质量的80%左右的蒸馏水揉匀,擀薄(厚度约0.5 mm)切割成约1 cm2的薄片。片状饲料要在5%(g/L)的氯化钙溶液中浸泡约1 min,使褐藻酸钠转变成为稳定不溶于水的褐藻酸钙凝胶,以减少营养物质的溶失。饲料风干后密封于样品袋中并保存在-20℃冰柜中待用。
1.2 试验动物分组和养殖管理
皱纹盘鲍稚鲍购自青岛鳌山卫育苗场,为当年人工孵化的同一批鲍苗。经暂养2周后挑选规格一致的健康个体(平均体质量(0.43±0.00)g)随机分成6组,每组3个重复,每个重复50只鲍鱼。
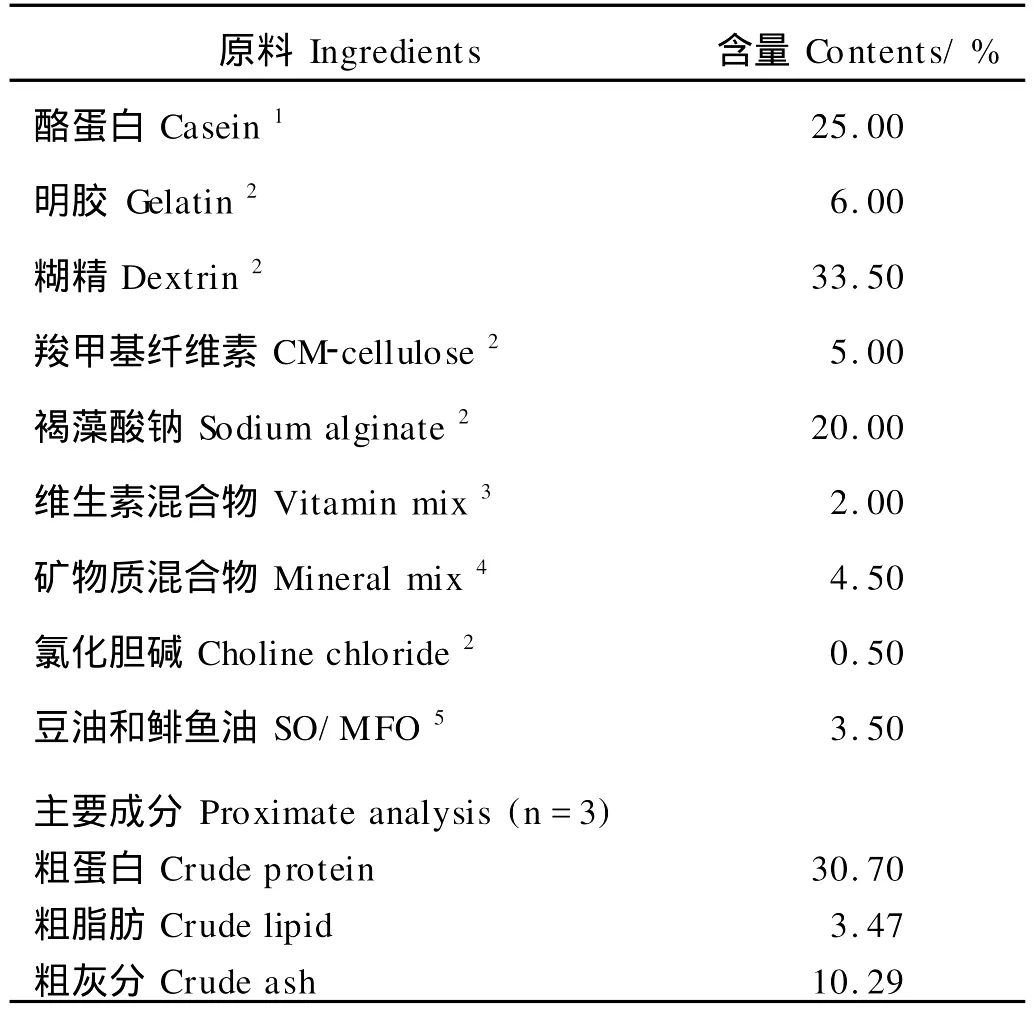
表1 基础饲料配方及其营养成分Table 1 Ingredient and proximate composition of the basal diet
生长试验在中国海洋大学鳌山卫实验基地进行,流水养殖16周。试验期间,每天17··00投喂,次日08··00清底,并密切观察稚鲍采食及健康状况。养殖过程中水温15~25℃,盐度22~28,p H=7.4~7.9,溶解氧不低于6 mg/L,水体中硒含量为1.54μg/L。
1.3 样品的采集和处理
养殖试验结束时,停喂稚鲍3 d以排空其肠道内容物。收集肝胰脏,将其剪成小块混匀后分装在小管中,所有样品保存在-80℃冰箱中待测。肝胰脏样品使用前解冻,加入预冷的匀浆介质(0.86%生理盐水,质量浓度=1/9),冰上匀浆,然后4℃、4 000 r/min离心15 min,取上清测定抗氧化指标。
参考B radfo rd[20]的考马斯亮兰法测定肝胰脏匀浆液中蛋白质的含量,以牛血清白蛋白作为标准蛋白。过氧化氢酶(CA T)、谷胱甘肽过氧化物酶(GPX)和超氧化物歧化酶(SOD)活力的测定参照万敏等[13]的方法;丙二醛(MDA)的测定参照Sahin等[21]的硫代巴比妥酸法;总抗氧化力(T-AOC)测定采用铁离子还原/抗氧化力测定法(FRAP),参考Benzie和Strain[22];谷胱甘肽(GSH)用比色法测定,参照Anderson等[23]。
1.4 统计分析
用SPSS 16.0软件和Excel 2003进行数据处理。用百分数表示的数据先转化成反正弦方根后再进行方差分析。差异显著时用Duncan检验进行多重比较。显著水平为0.05。
2 试验结果
2.1 超氧化物歧化酶(SOD)
从表2可以看出,硫辛酸显著影响了肝胰脏中SOD活力(P<0.05),硒及硒与硫辛酸的交互作用对SOD都无显著影响(P>0.05)。SOD活力在添加800 m g/kg硫辛酸的两处理组显著高于0 m g/kg添加组(P<0.05),3 200 mg/kg硫辛酸处理组与对照组无显著差异(P>0.05)。
2.2 谷胱甘肽过氧化物酶(GPX)
硫辛酸和硒对皱纹盘鲍肝胰脏中GPX活性均有显著影响(P<0.05)(见表2),但无显著交互作用(P>0.05)。当饲料中不添加硫辛酸时,硒显著提高了GPX活性;在添加800和3 200 mg/kg硫辛酸后,硒添加组GPX活力比不添加组有所增加,但差异不显著(P>0.05)。饲料中添加800 mg/kg硫辛酸显著提高了GPX活性,3 200 m g/kg硫辛酸则降低了其活性(P<0.05)。
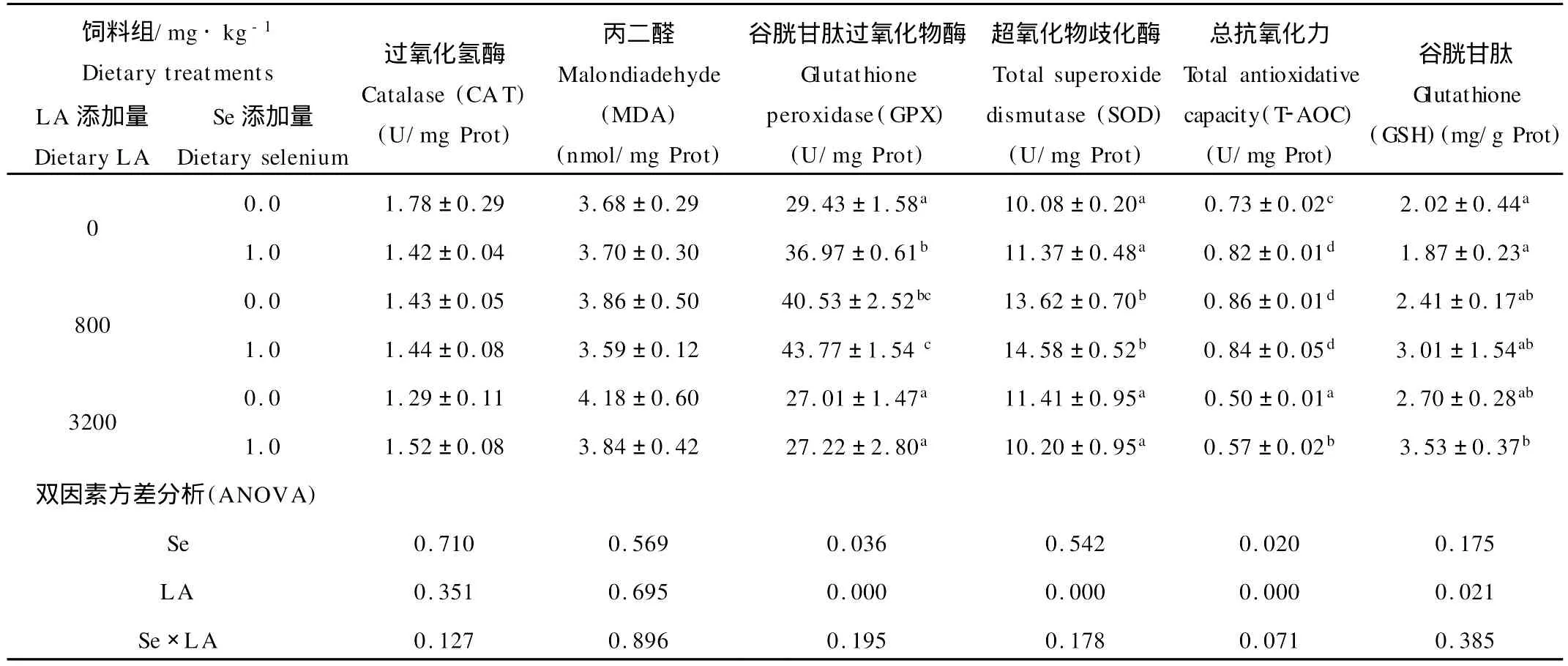
表2 饲料中添加α-硫辛酸(LA)和硒(Se)对皱纹盘鲍稚鲍肝胰脏中抗氧化指标的影响(平均值±标准误,n=3)Table 2 Effects of diet supplementedα-lipoic acid(LA)and selenium(Se)on anti-oxidative parameters in hepatopancreas of juvenile abalone,Haliotis discus hannai Ino(mean±S.E.,n=3)
2.3 谷胱甘肽(GSH)
如表2所示,硫辛酸显著影响肝胰脏中GSH含量,硒对GSH影响不显著且和硫辛酸无显著交互作用。但在添加硫辛酸后,1 mg/kg硒添加组的GSH水平相比缺乏组表现出增加的趋势。在添加和不添加硒的情况下,GSH水平都随硫辛酸添加量的增加而增加,其中在同时添加1 mg/kg硒和3 200 mg/kg硫辛酸的处理组GSH最高,并显著高于对照组(P<0.05)。
2.4 过氧化氢酶(CA T)
不同处理的稚鲍的CA T在1.29~1.78之间(见表2),硒和硫辛酸对CA T都无显著影响,亦无显著交互作用(P>0.05)。
2.5 丙二醛含量(MDA)
皱纹盘鲍稚鲍的MDA值在3.59~4.18之间变化(见表2),各处理组间无显著差异(P>0.05)。但添加硒和800 m g/kg硫辛酸时MDA值低于对照组,而添加3 200 mg/kg硫辛酸表现出升高的趋势。
2.6 总抗氧化力(T-AOC)
T-AOC值的变化如表2所示,硒和硫辛酸分别显著影响了稚鲍肝胰脏T-AOC值(P<0.05),但两者无交互作用(P>0.05)。在饲料中添加0和3 200 mg·kg-1的硫辛酸时,1 mg/kg的硒显著增加了T-AOC值(P<0.05),而添加800 m g/kg硫辛酸时,硒对T-AOC值影响不显著(P>0.05)。无论添加或不添加硒,在800 mg/kg处理组T-AOC升高,在3 200 mg/kg组降低,最低值出现在不添加硒同时添加3 200 mg/kg硫辛酸的处理组,显著低于对照组(P<0.05)。
3 讨论
SOD、GPX和CA T都是抗氧化系统中主要的抗氧化酶,SOD催化超氧自由基的歧化反应,在维持生物体内活性氧的动态平衡、增强吞噬细胞防御能力和整个机体的免疫功能中起着重要作用;GPX帮助阻止氢过氧化物和有机过氧化物的形成,该酶活性降低,则引起自由基和过氧化物积累,进而导致脂质和细胞膜氧化损伤[24];CA T是一类广泛存在于生物体内的抗氧化酶,催化过氧化氢降解。这几种抗氧化酶常被用于衡量机体的抗氧化状态。T-AOC是用于评价机体抗氧化系统性能的综合性指标[25]。
在本研究中,饲料中添加800 mg/kg硫辛酸时,皱纹盘鲍稚鲍肝胰脏中SOD和GPX活力显著提高,硫辛酸表现出抗氧化作用,与Kow luru和Odenbach[26]在小鼠上的研究结果一致;而添加3 200 mg/kg硫辛酸时SOD和GPX活力下降,与不添加硫辛酸的对照组的值之间没有显著差异。皱纹盘鲍肝胰脏中TAOC的变化趋势也与SOD和GPX这2种酶相似,并且在硫辛酸添加量为3 200 mg/kg时T-AOC的值显著低于对照组和800 mg/kg添加组。另外,尽管肝胰脏中MDA的含量没有受到饲料中硫辛酸添加量的显著影响,但是存在饲料中添加3 200 mg/kg硫辛酸有提高MDA含量的趋势。因此,从SOD、GPX、T-AOC和MDA随饲料中硫辛酸不同添加量的变化情况来看,800 mg/kg是饲料中硫辛酸的适宜添加量,当添加量达到3 200 mg/kg时,有降低体内抗氧化能力而提高氧化胁迫的趋势。在其它的一些研究中也发现硫辛酸具有促氧化作用[3],这主要取决于氧化应激的形式和机体的生理状态。饲料中过量添加硫辛酸对皱纹盘鲍机体造成潜在的氧化胁迫的机理值得开展进一步的研究。
GSH是体内GPX分解过氧化物必需的底物,被认为是衡量机体抗氧化能力的重要指标[27]。在本研究中,GSH随着硫辛酸添加量的增加而升高,这与GPX、SOD和T-AOC的变化趋势不同。GSH的持续升高可能与硫辛酸促进了用于合成GSH的半胱氨酸的运输有关[28],或是因为硫辛酸增加了GSH合成酶的活性[10]。由此可见,如何正确使用体内GSH的变化情况来评价硫辛酸影响下机体的抗氧化能力,需要进一步的商榷。
硒作为GPX的活性中心,是GPX发挥抗氧化作用的重要部分。值得一提的是本研究结果显示在饲料中不添加硫辛酸时,硒显著提高了肝胰脏中GPX活性,这与万敏等[13]对皱纹盘鲍的研究结果一致。但当饲料中添加800和3 200 mg/kg硫辛酸时,硒对GPX没有显著影响,说明硒对皱纹盘鲍GPX的作用是有条件的,本试验中受到硫辛酸的影响。另外,本研究中当饲料中不添加硫辛酸或硫辛酸添加过量(3 200 mg/kg)时,硒显著提高肝胰脏中T-AOC的值。而在添加适量硫辛酸(800 mg/kg)时,硒对T-AOC的影响不显著,说明硫辛酸也影响了硒对T-AOC的作用。反之,硒也影响了硫辛酸对T-AOC的作用,当饲料中没有添加硒时,硫辛酸(800 mg/kg)显著提高了肝胰脏中TAOC水平,但当饲料中添加硒后,硫辛酸(800 mg/kg)对肝胰脏中T-AOC水平影响不显著。由此可见,尽管没有达到统计学上的显著性,饲料中硫辛酸和硒之间对皱纹盘鲍机体抗氧化状态的影响有潜在的交互作用。为了更好的揭示这种交互作用,在今后的研究中应该增加饲料中硒和硫辛酸的添加梯度。
[1] Freidovich I.Fundamental aspects of reactive oxygen species,or w hat’s the matter with oxygen?[J].New Yo rk:Academy of Sciences,1999,893:13-18.
[2] M cCo rd J M.The evolution of free radicals and oxidative stress[J].The American Journal of Medicine,2000,108(8):108-652.
[3] Packer L,Witt E H,Tritschler J.A lpha-lipoic acid as a biological antioxidant[J].Free radical biology medicine,1995,19:227-250.
[4] Biewenga G P,Haenen G R,Bast A.The pharmacology of the antioxidant lipoic acid[J].General Pharmacology,1997,29:315-331.
[5] Bast A,Haenen G.Lipoic acid:amultifunctional antioxidant(reprinted from Thio Metabolism and Redox Regulation of Cellular Functions)[J].Bio Factors,2003,17:207-213.
[6] Cakatay U.Pro-oxidant actions of alpha-lipoic acid and dihydrolipoic acid.[J].Medical Hypotheses,2006,66:110-117.
[7] A rivazhagan P,Shila S,Kumaran S,et al.Effect of DL-α-lipoic acid on the status of lipid peroxidation and antioxidant enzymes in various brain regions of aged rats[J].Exerimental Gerontology,2002a,37:803-811.
[8] A rivazhagan P,Shila S,Narchonai E,et al.α-Lipoic acid enhances reduced glutathione,ascorbic acid,and alpha-tocopherol in aged rats[J].Anti-aging Medicine,2002b,5:265-269.
[9] Chae C H,Shin C H,Kim H T.The combination ofα-lipoic acid supplementation and aerobic exercise inhibits lipid peroxidation in rat skeletal muscles[J].Nutrition Research,2008,28:399-405.
[10] Fujita H,Shiosaka M,Ogino T,et al.α-Lipoic acid suppresses 6-hydroxydopa mine-induced ROS generation and apoptosis through the stimulation of glutathione synthesis but not by the exp ression of heme oxygenase-1[J].Brain Research,2008,1206:1-12.
[11] Wang Y B,Han J Z,Li W F,et al.Effect of different selenium source on grow th performances,glutathione peroxidase activities,muscle composition and selenium concentration of allogynogenetic crucian carp(Carassius auratus gibelio)[J].Animal Feed Science and Technology,2007,134:243-251.
[12] Tirosh O,Sen C K,Roy S,et al.Neurop rotective effectsofα-lipoic acid and itspositively charged am ide analogue[J].Free Radical Biology&Medicine,1999,26:1418-1426.
[13] 万敏,麦康森,马洪明,等.硒和维生素E对皱纹盘鲍血清抗氧化酶活力的影响[J].水生生物学报,2004,28(5):496-503.
[14] 付京花,张文兵,麦康森,等.维生素D对皱纹盘鲍生长和体组织抗氧化反应的影响[J].高技术通讯,2006,16(12):1306-1311.
[15] Fu J H,Zhang W B,Mai K S,et al.Effectsof dietary vitamin A on antioxidant responses of abalone Haliotis discus hannai Ino[J].Acta Oceanologica Sinica,2006,25(5):141-150.
[16] Fu J H,Zhang W B,Mai K S,et al.Effectsof vitamin Eon antioxidant enzyme activities and fatty accompositions in juvenile abalone Haliotis discus hannai Ino[J].Journal of Shellfish Research.2007,26(3):809-814.
[17] Mai K S,Zhang W B,Tan B P,et al.Effectsof dietary zinc on the shell biomineralization in abalone Haliotis discus hannai Ino[J].Journal of Experimental Marine Biology and Ecology,2003,283:51-62.
[18] Association of Official Analytical Chemists(AOAC).Official methods of analysis of official analytical chemists international[M].Arlington,VA,USA:Association of Official Analytical Chemists,1995.
[19] Zhang W,Mai K,Xu W,et al.Interaction between vitamins A and D on grow th and metabolic responses of abalone Haliotis discus hannai,Ino[J].Journal of Shellfish Research,2007,26:51-58.
[20] Bradford M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Analytical Biochemistry,1976,72:248-254.
[21] Sahin M,SagdIc G,Elmas O,et al.Effect of chronic restraint stress and alpha-lipoic acid on lipid peroxidation and antioxidant enzyme activities in rat peripheral organs[J].Pharmacol Research,2007,54:247-252.
[22] Benzie I F,Strain J J.The ferric reducing ability of plasma(FRAP)as ameasure of“Antioxidant Power”:the FRAP assay[J].Analytical Chemistry,1996,239:70-76.
[23] Anderson M E.Determination of glutathione and glutathione disulfide in biological samples[J].Methods in Enzymology,1985,113:548-55.
[24] Oliveros L,Vega V,Anzulovich A C,et al.Vitamin A deficiency modifies antioxidant defense and essential element contents in rat heart[J].Nutrition Research,2000,8:1139-1150.
[25] 方展强,王春凤.硒对汞致剑尾鱼鳃和肝组织总抗氧化[J].实验动物和比较医学,2005,25(3):136-139.
[26] Kowluru R A,Odenbach S.Effect of long-term administration of α-Lipoic acid on retinal capillary cell death and the development of retinopathy in diabetic rats[J].Diabetes,2004,53:3233-3238.
[27] 朱选,曹俊明,赵红霞,等.饲料中添加谷胱甘肽对草鱼组织中谷胱甘肽沉积和抗氧化能力的影响[J].水产科学,2008,15(1):160-166.
[28] Han D,Handelman G,Marcocci L,et al.Lipoic acid increases denovo synthesis of cellular glutathione by improving cystine utilization[J].Bio Factors,1997,6:321-338.

