噻唑烷酸对肝组织GSH含量的影响及其作用机制的研究*
刘 吉,蔡文娣,杨 艳**,刘万顺,韩宝芹,常 菁
(1.中国海洋大学海洋生命学院,山东青岛266003;2.潍坊医学院,山东潍坊261042)
外源性毒物、药物进入体内,在肝脏中经过肝脏代谢酶系统催化产生大量活性中间代谢物和自由基。肝脏既是药物浓集、生物转化、代谢的主要器官,又是机体代谢和免疫的重要器官,因此,药源性肝疾病已成为中毒性肝损伤的重要原因。
谷胱甘肽(Glutathione,GSH)是细胞内重要的三肽化合物,是非蛋白类巯基的主要构成成分,细胞内90%以上的非蛋白结合巯基由GSH组成。GSH在体内发挥重要抗氧化功能,它能使细胞免受各种有害物质,包括氧化剂、亲电子物质、异生性物质等的伤害[1],当GSH被大量清除时就会对机体造成损伤[2]。药物经肝脏代谢生成的亲电子物质及自由基均与GSH结合而灭活。当细胞内GSH的含量发生显著变化,必须供给外源性GSH或者促进体内GSH的生物合成才能维持正常的机体功能。因此,维持谷胱甘肽含量稳定具有重要意义。国内外研究报道表明,L-半胱氨酸前体化合物能在体内通过释放出相应的L-半胱氨酸,促进GSH的合成,从而保护机体。其中,噻唑啉衍生物就是一类重要的L-半胱氨酸前体化合物。
本课题组研究合成了1种新的噻唑烷酸衍生物(GlcNAcCys),并对其体内外抗氧化、提高巯基含量、保护高剂量扑热息痛诱导的肝功能损伤进行了研究。前期研究结果表明,GlcNAcCys具有较好的抗氧化活性,能够清除自由基,保护生物大分子(蛋白质,脂质,脱氧核糖)免受自由基的损害[3];提高小鼠体内巯基含量,保护高剂量扑热息痛诱导的肝损伤[4]。但是Glc-NAcCys的作用机理有待于进一步研究。丁胱亚磺酰亚胺(BSO)是GSH从头合成抑制剂,可抑制GCL酶的活性,降低细胞内GSH含量[5]。本文在前期研究的基础上利用BSO诱导的小鼠肝损伤模型进一步研究了GlcNAcCys提高肝组织GSH含量的作用机制。
1 材料与方法
1.1 动物和试剂
动物:选用雄性昆明小鼠40只,体质量18~22 g,购自青岛实验动物中心,合格证号:SCXK(鲁)20030010;
试剂:GCL、β-actin引物购自上海博尚生物技术有限公司;溴化乙锭(EB)、5,5’-二硫代双-(2-硝基苯甲酸(D TNB)、GSH购自Sigma公司;DL 2000 marker、10×loading buffer、琼脂糖购自Takara公司;牛血清白蛋白(BSA)购自北京拜尔迪生物公司;N-乙基马来酰亚胺(NEM)购自天津市化学试剂研究所;邻苯二甲醛(OPA)购自上海山浦化工有限公司;乙二胺四乙酸(EDTA)购自南京化学试剂有限公司;谷胱甘肽还原酶(GR)、谷胱甘肽-S转移酶(GST)活性测定试剂盒购自南京建成生物工程研究所;肝组织总RNA提取试剂盒、DNA酶试剂盒、反转录试剂盒和PCR试剂盒购自天根生化科技有限公司。
1.2 仪器
紫外可见光分光光度计,北京普析通用仪器有限公司产品;M IKRO 22R Hettich离心机,上海捷惠科学仪器有限公司产品;Bio-RAD power pactm-basic电泳仪及水平电泳槽,Bio-Rad公司产品;PCR仪,Bio-Rad公司产品;BT-232H5S凝胶成像系统,上海培清科技有限公司产品;970CRT荧光分光光度计,上海现科分光仪器有限公司;Synchron CX-7全自动生化分析仪,美国Beckman有限公司。
1.3 实验设计
小鼠随机分为正常对照组、BSO组和GlcNAcCys低、中、高剂量组,每组8只。正常对照组小鼠腹腔注射生理盐水,BSO组及GlcNAcCys低、中、高剂量组小鼠腹腔注射BSO(6 mmol/kg体质量)。注射BSO 2 h后,正常对照组和BSO组小鼠腹腔注射生理盐水,Glc-NAcCys低、中、高剂量组小鼠分别腹腔注射GlcNAc-Cys,剂量分别为200、400和900 mg/kg体质量。实验6 h后,小鼠断颈处死,分离肝组织,部分肝组织迅速液氮冷冻并于-80℃冻存,待提取组织总RNA,用RTPCR研究谷氨酰半胱氨酸连接酶催化亚基(GCL)基因表达情况。剩余肝组织,用冷生理盐水冲洗后称取0.5 g,放入匀浆器内,加5 m L Tris-HCl缓冲液(p H=7.4),制成10%的组织匀浆并取上清冷冻保存,待测肝脏中GR、GST活性以及总巯基(T-SH)、GSH含量。
1.4 测定方法
1.4.1 肝匀浆中T-SH含量的测定 采用Ellman’s的测定方法进行[6]。巯基和DTNB反应,在412 nm处有最大光吸收,412 nm处摩尔消光系数为13100。巯基含量以nmol/mg p rot表示。
1.4.2 肝匀浆中GSH含量的测定 参照P.J.Hissin等人的方法[7]进行。利用在p H=8.0时GSH与邻本二甲醛(OPA)结合可发荧光物质,从而对肝匀浆中GSH进行定量测量。N-乙基马来酰亚胺(NEM)用0.1 mol/L磷酸钠含0.005 mol/L ED TA的缓冲液(p H=8.0)配制,GSH标准物用偏磷酸配制,每日制备新鲜原液(1 mg/mL),用前稀释至所需浓度。邻苯二甲醛(OPA)溶液,用分析纯无水甲醇每日新鲜制备。取100μL肝匀浆加入100μL NEM,30 min后加入100μL OPA荧光试剂,充分混合,室温放置15 min后,在荧光分光光度计上设置激发波长334 nm,发射波长420 nm,测定荧光强度。GSH浓度用μg/mg蛋白表示。
1.4.3 肝匀浆中GR、GST活性的测定 分别取300 μL小鼠肝匀浆液,并按血清及组织中GR、GST测定试盒中的操作步骤进行。GR活力定义为:每克组织蛋白每分钟使反应体系中底物NADPH的浓度改变1 mmol/L所需的酶量为1个酶活力单位。GST活力定义为:扣除非酶促反应,每毫克组织蛋白,在37℃反应1 min使反应体系中GSH浓度降低1μmol/L为1个酶活力单位。
1.4.4 肝匀浆液中蛋白质含量的测定 参照Low ry等[8]的方法进行,从牛血清白蛋白(BSA)的标准曲线计算出肝匀浆中蛋白质的浓度。
1.4.5 肝组织GCL m RNA表达 肝脏总RNA的提取、DNA酶的去除、RNA的纯化、逆转录以及PCR反应均按照试剂盒中的操作步骤进行。
总RNA的提取及纯化:按照试剂盒中的操作依次进行总RNA提取、DNA酶去除、RNA纯化,纯化后的RNA样品,采用紫外分光光度法测定其在260和280 nm的紫外吸收值。根据OD260/OD280光密度值定量判定RNA样品的纯度,并用电泳法鉴定其分子完整性。根据260 nm处1 OD光吸收值相当于40μg/m L RNA确定逆转录反应时RNA的用量。
逆转录:取纯化后的RNA,利用Olig(d T)反逆转录成cDNA,体系包括(总体积为20μL):Olig(d T)2μL,2.5 mmol/LdN TPs 2μL,总RNA 3μg,Rnasefree H2O补足体积至13.5μL,70℃反应5 min后迅速在冰上冷却2 min。然后加入5×First-Strand Buffer 4μL,0.1mol/LDTT 1μL,Rnasin 0.5μL,逆转录酶TIANScrip t M-MLV 1μL,42℃反应50 min,95℃加热5 min终止反应。
PCR反应:利用GCL正反引物A GA CAC GGC A TC CTC CAG TT(正向)和CTG ACA CGT AGC CTC GGT AA(反向)(见表1),以β-actin为内参,检测肝组织GCL m RNA的表达。PCR反应条件如下:逆转录产物3.5μL;正向、反义链引物各1μL;2×Master M ix 12.5μL;ddH2O补足25μL。混匀,高速离心10 s后置于PCR仪中开始PCR反应,反应条件为:94℃预变性5 min;94℃30 s;55℃30 s;72℃30 s;30个循环;72℃延伸7 min。

表1 大鼠GCL序列扩增与检测所用寡核苷酸引物[9]Table 1 Oligonucleotide p rimers for the amp lification and detection of rat GCL
电泳结果分析:配制1.5%的琼脂胶(含溴化乙锭0.5μg/mL),产物、β-actin和DL 2000各上样3μL,200 V电泳30 min,紫外灯下观察照片。
结果计算:电泳结束后用凝胶成像系统拍照并进行电泳条带光密度分析。某标本靶基因条带光密度与内参基因(β-actin)条带的光密度之比值作为该标本m RNA的表达水平。
1.5 数据统计分析:
实验数据表示为M ean±S.D.。所有组间差异显著性分析用SPSS 11.0软件中Dunnett’s t检验进行处理,以P<0.05为具有显著性差异。
2 实验结果
2.1 GlcNAcCys对肝匀浆中T-SH含量的影响
结果见图1。BSO组小鼠腹腔注射BSO后,肝组织T-SH含量显著降低。与正常对照组相比,肝脏TSH的含量降低了40%(P<0.05)。GlcNAcCys能够提高肝组织T-SH含量,其中低剂量组作用效果最显著,肝T-SH含量升高至BSO组的2.14倍(P<0.05)。

图1 GlcNAcCys对肝匀浆中T-SH含量的影响Fig.1 Effects of GlcNAcCys on liver homogenate T-SH content
2.2 GlcNAcCys对肝匀浆中GSH含量的影响
GSH浓度的标准曲线如图2所示。
GlcNAcCys对肝匀浆中GSH含量的影响见图3。从图3中可以看出,BSO组GSH含量显著降低,与正常对照组相比,GSH含量降低了29%。GlcNAcCys(200 m g/kg体质量)能够显著提高GSH含量,与BSO组比较,GSH含量提高了40%。

图2 GSH浓度标准曲线Fig.2 Standard curve for GSH concentration
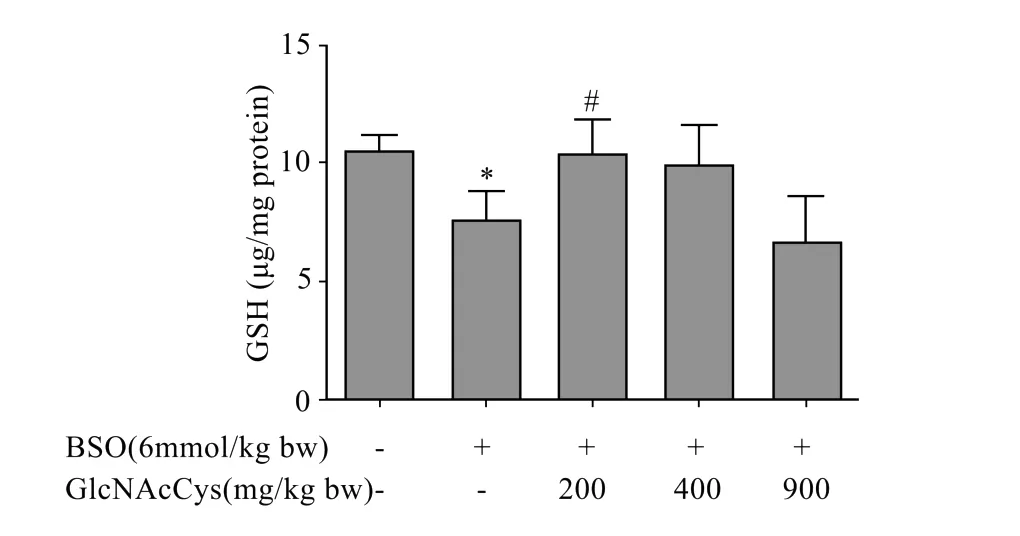
图3 GlcNAcCys对肝匀浆中GSH含量的影响Fig.3 Effect of GlcNAcCyson liver homogenate GSH content
2.3 GlcNA cCys对肝匀浆中GR活性的影响
结果见图4。腹腔注射BSO对肝匀浆GR活性没有显著影响。低剂量GlcNAcCys能够显著提高GR活性,GR活性与BSO组相比提高了43%,与正常对照组相比提高了54%。
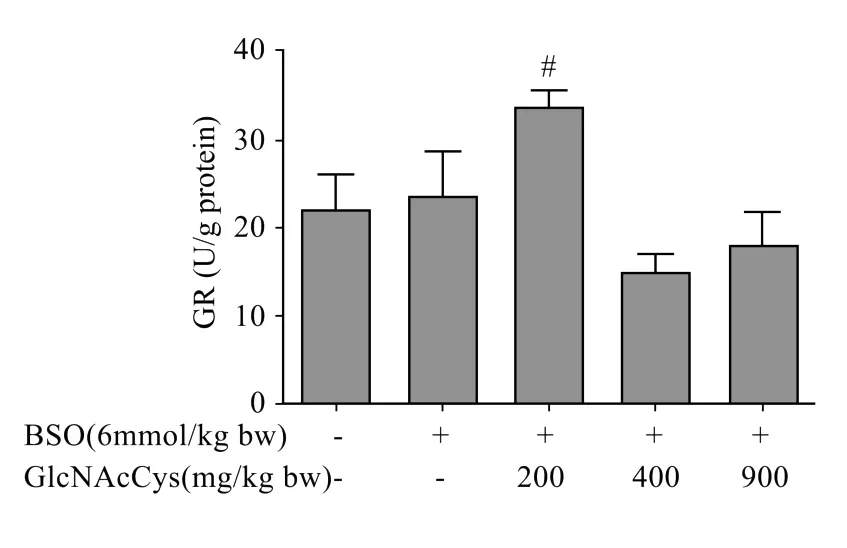
图4 GlcNAcCys对肝匀浆中GR活性的影响Fig.4 Effectsof GlcNAcCys on liverhomogenate GR activities
2.4 GlcNAcCys对肝匀浆中GST活性的影响
结果见图5。从图5中可以看出BSO能够抑制GST活性。与正常对照组比较,BSO组GST活性降低了33%。GlcNAcCys各剂量组GST活性均高于BSO组,其中低剂量组GST活性提高至BSO组的2.3倍(P<0.05)。

图5 GlcNAcCys对肝匀浆中GST活性的影响Fig.5 Effectsof GlcNAcCys on liver homogenate GST activities
2.5 GlcNAcCys对肝脏GCL m RNA表达的影响
1%琼脂糖凝胶电泳鉴定总RNA纯度结果见图6。28 S荧光亮度约为18 S的2倍,无其它大分子条带,表明总RNA无蛋白污染,无降解。经紫外分光光度计检测显示,260/280的比值介于1.8~2.0之间,纯度符合要求。

图6 肝脏总RNA抽提结果Fig.6 Result of liver to tal RNA extraction
BSO、GlcNAcCys对大鼠肝脏GCL m RNA表达的影响见图7。RT-PCR结果显示小鼠腹腔注射BSO后,与正常对照组相比较,肝组织GCL m RNA表达量没有发生明显变化,提示BSO降低肝脏GSH含量与抑制GCL m RNA表达无关,BSO可能通过其他途径降低肝脏GSH含量。GlcNAcCys(400、900 mg/kg体质量)能够诱导GCL m RNA表达。
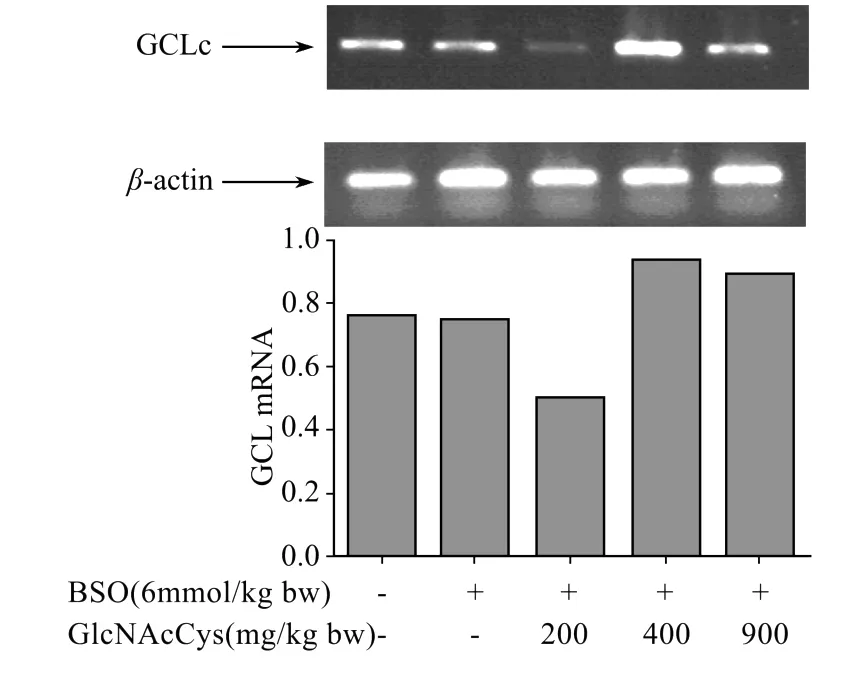
图7 肝脏GCLm RNA表达的变化Fig.7 Effects of GlcNAcCys on GCL m RNA expression
3 讨论
单糖的醛基能够和半胱氨酸的-SH和-NH2发生环缩合反应,生成噻唑烷酸衍生物,噻唑烷酸衍生物可作为L-半胱氨酸的前体化合物,通过非酶解的开环水解反应逐渐释放出L-半胱氨酸和相同摩尔的糖基。释放出的L-半胱氨酸在体内能够促进谷胱甘肽的从头生物合成,发挥抗氧化作用,保护机体。关于噻唑烷酸糖衍生物的抗氧化功能已有过报道,左旋-2-氧-4-羧噻唑烷作为半胱氨酸的前体,可增加GSH的合成[10]。Lang CA等发现羧酸噻唑烷镁(Mg TC)能大大提高果蝇、蚊子、小鼠的GSH含量,延长寿命[11]。William son等报道,L-2-氧-4-噻唑烷酸能明显升高小鼠肝组织的GSH水平,恢复过量扑热息痛中毒小鼠肝组织的GSH水平[12]。本文在前期研究的基础上,利用BSO降低小鼠肝GSH含量动物模型研究了GlcNAcCys对肝脏T-SH、GSH含量和抗氧化酶(GST、GR)活性的影响及相应机制。
BSO是GSH合成强有力的抑制剂,Sen CK等给大鼠注射BSO(6 mmol/kg体质量)后,肝脏、肺、血浆总GSH含量下降50%,骨骼肌、心脏总GSH下降80%~90%[13]。本文研究结果显示小鼠腹腔注射BSO后,肝匀浆中T-SH及GSH含量显著降低,表明肝脏GSH耗竭动物模型建立成功。
巯基是体内重要的还原性基团,能够清除自由基,具有重要的解毒功能。细胞内的总巯基(T-SH)主要包括两类,一类为蛋白巯基(PB-SH),是多种酶的活性中心。一类是非蛋白巯基(NP-SH),90%以上由还原型谷胱甘肽(GSH)组成。GSH是体内重要的小分子物质,它能使细胞免受各种有害物质,包括氧化剂、亲电子物质、异生性物质等的伤害,能减轻机体由于上述物质导致的炎症反应,同时还有提高机体抗氧化能力的作用。从本研究中可以看出,BSO可降低肝脏TSH、GSH含量。肝脏是机体重要的解毒器官,GSH含量降低将使肝脏更容易受到各种毒性中间代谢物的损伤。GlcNAcCys能够显著提高肝脏T-SH、GSH含量,使T-SH、GSH含量趋于稳定。GlcNAcCys在体内可以通过水解,释放半胱氨酸,进而促进GSH的合成,维持细胞处于还原状态,使以巯基为活性中心的酶处于活性状态,提高组织的抗氧化能力。
GR是1种黄素酶,可催化氧化型谷胱甘肽转变为还原型谷胱甘肽,增加细胞液中还原型谷胱甘肽的含量,有抵抗自由基氧化对机体损伤的作用。GST是肝脏Ⅱ相代谢反应中重要的转移酶,可催化外源毒物、药物在肝脏的代谢。GST能够催化还原型谷胱甘肽与一系列亲电子化合物(包括各种致癌物)结合成无毒的结合物排出体外,从而发挥解毒功能[14]。本实验发现低剂量GlcNAcCys(200 m g/kg)可显著提高肝脏GR的活性,催化谷胱甘肽由氧化型变为还原型,从而提高GSH含量,增强肝脏抗氧化能力;腹腔注射GlcNAc-Cys(200 m g/kg)能显著诱导GST的活性,增强肝脏的解毒功能,保护肝脏免受外源化合物代谢产生的毒性中间代谢物的损伤。
谷氨酰-L-半胱氨酸连接酶(glutamyl-L-cysteine ligase,GCL),是GSH从头合成过程第一步反应的催化酶,也是GSH从头合成的限速酶,GCL酶活的调节可在基因转录水平、转录后水平、翻译后水平等环节,主要在基因转录水平[15]。Kitteringham NR等[16]报道,BSO对小鼠肝脏GCL m RNA水平和蛋白水平没有影响。本研究结果显示,BSO组与正常对照组相比,GCL基因表达没有显著差异。当GSH含量低于正常水平时,GlcNAcCys(400,900 mg/kg)能显著诱导GCL基因的转录。这一结果表明,GlcNAcCys提高GSH含量的功能可能与其诱导GCL m RNA表达有关。而200 mg/kg GlcNAcCys剂量组GSH含量升高的同时,GCL m RNA表达受到抑制,这可以从两方面来解释:第一,GCL基因表达的诱导是控制GSH合成,维持GSH含量稳定的重要途径,但是,机体内可能存在一种“初始生化应答反应”来调节GSH的合成[17]。第二,GCL m RNA表达受细胞内GSH含量的影响,当细胞内GSH增多时,减少了GCL重、轻链间的二硫健连结,从而引起反馈调节,抑制GCL的表达[18]。
总之,GlcNAcCys能够提高肝组织T-SH、GSH含量,增强GST、GR酶活力,提高肝脏的抗氧化能力和解毒功能,保护肝脏免受毒性中间代谢物的损伤。GlcNAcCys提高肝脏T-SH、GSH含量的机制可能与其诱导GCL m RNA的表达有关。
[1] He P Y,Jiao H W,Huang Z Z,et al.Cloning and characterization of the 5’-flanking region of the rat glutamate-cysteine ligase catalytic subunit[J].Biochem J,2001,357(2):447-455.
[2] Recknagel R O,Glende E A,Dolak J A,et al.Mechanism s of carbon tetrachloride toxicity[J].Pharmacol Ther,1989,43:139-154.
[3] Yang Y,Liu W S,Sun H Z,et al.Antioxidative p roperties of a new ly synthesized 2-glucosamine-thiazolidine-4(R)-carboxylicacid(GlcNH2Cys)in mice[J].Nutri Res,2006,26:369-377.
[4] Yang Y,Liu WS,Han B Q,et al.Synthesis of two new thiazolidines and evaluation of their hepato protective effects[J].Hitech Lett,2005,11(1):57-62.
[5] Griffith O W,Meister A.Potent and specific inhibition of glutathione synthesis by buthionine sulfoximine[J].J Biol Chem,1979,254:7558-7560.
[6] Sedlak J,Lindsay R H.Estimation of total protein-bound and nonprotein sulfhydryl groups in tissue with Ellman’s reagant[J].Anal Biochem,1968,25:192-205.
[7] Hissin PJ,Hilf R.A fluorometricmethod for determination of oxidized and reduced glutathione in tissues[J].Anal.Biochem,1979,74:214.
[8] Low ry O,Rosebrough N,Farr A,et al.Protein measurement with the Folin phenol reagent[J].JBiol Chem,1951,193:265-275.
[9] Mao L J,Xu H W.Effect of glutathione depletion on glutathione system in myocadium of rat[J].Chin J Sports Med,2004,23(3):266-270.
[10] Moberly J B,Logan J,Borum P R,et al.Elevation of w holeblood glutathione in peritoneal dialysis patients by L-2-oxothiazolidine-4-carboxylate,a cysteine prodrug(Procysteine)[J].J Am Soc Nephrol,1998,9(6):1093-1099.
[11] Lang C A.The impact of glutathione on health and longevity[J].Journal of anti-aging medicine,2001,4(2):137-144.
[12] Williamson J M,Boettcher B,Meister A.Intracellular cysteine delivery system that p rotects against toxicity by p romoting glutathione synthesis[J].Proc Natl Acad Sci.USA,1982,79(20):6246-6249.
[13] Sen C K,A talay M,Hanninen O.Exercise-induced oxidative stress:Glutathione supplementation and deficiency[J].J ApplPhysiol,1994,77:2177-2181.
[14] Gyamfi M A,Wan YJ.The effect of ethanol,ethanolmetabolizing enzyme inhibitors,and Vitamin E on regulating glutathione,glutathione S-transferase,and S-adenosyl methionine in mouse primary hepatocyte[J].Hepatol Res,2006,35(1):53-61.
[15] Rahman I,MacNee W.Regulation of redox glutathione levels and gene transcription in lung inflammation:therapeutic approaches[J].Free Radic Biol Med,2000,28:1405-1420.
[16] Kitteringham N R,Powell H,Clement Y N,et al.Hepatocellular response to chemical stress in CD-1 mice:induction of early genes and gamma-glutamylcyseine synthetase[J].Hepatology,2000,32:321-333.
[17] Dikran Toroser,Connie S Yarian,William COrr.Mechanisms of γ-glutamylcysteine ligase regulation[J].Biochimica et Biophysica Acta,2006,1760:233-244.
[18] Huang C S,Chang L S,Anderson M E,et al.Catalytic and regulatory properties of the heavy subunit of rat kidneyγ-glutamylcysteine synthetase[J].JBiol Chem,1993,268:19675-19680.

