饥饿对金鱼卵巢型和脑型芳香化酶基因表达的影响研究*
温海深,王宇龙,姜 龙,李吉方,何 峰,刘 淼
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
细胞色素P450芳香化酶(P450arom)作为P450细胞色素酶超家族中的一员,是类固醇生成途径中的末端酶,它是雄激素向雌激素转化的关键限速酶[1]。它能够催化某些雄激素(如睾酮和雄烯二酮)转化为雌激素,对调节整个性类固醇激素的平衡有重要意义[2]。在大多数脊椎动物中,P450arom由CYP19单基因编码,但在鱼类中存在2种P450芳香化酶,分别为性腺型芳香化化酶(P450arom A)和脑型芳香化酶(P450aromB),它们由不同的基因(CYP19A和CYP19B)编码,具有独特的功能[3]。至今,已经在10余种鱼类中克隆了CYP19基因,并对功能进行了初步研究[4]。
由于环境条件改变、个体差异及食物分布不均等原因,鱼类经常遭受饥饿胁迫。近年来,饥饿胁迫对鱼类生理机能变化研究成为鱼类营养与环境生理学交叉学科的热点问题之一,特别是饥饿后的消化生理机能研究报道较多,例如补偿生长现象。鱼类补偿生长现象是鱼类遇到饥饿胁迫,恢复摄食后生长率高于正常摄食状态,体重增加最终达到或超过正常投喂鱼的现象。鱼类补偿生长的研究可用来指导制订科学的投食制度而获得更好的经济效益,迄今为止,国内外先后研究了鲑科鱼类、鲤科鱼类、鳕科鱼类、鲽科鱼类等近30余种鱼类的补偿生长。在我国1990年代以后开始研究,涉及鱼类如南方鲇(Silurusmerid ionalis)[5]、鲤鱼(Cyprinus carpio)[6]、美国红鱼(Sciaenops ocellatus)[7]、异育银鲫(Carassius auratus gibelio)[8]、锦鲤(Cyprinus carpio,variation)[9]。真鲷(Pagrus major)[10]、草鱼(Ctenopharyngodon idellus)[11]。但是,关于鱼类补偿生长过程中繁殖生理机能变化研究未见报道。本文以繁殖生理研究的模式动物金鱼(Carassius auratus,variation)为对象,侧重研究性激素合成关键酶基因(CYP19A和CYP19B)表达对饥饿的响应机制,通过这些研究,在理论上丰富鱼类繁殖生理学内容,在实践上为制定科学合理的亲鱼投喂计划提供科学依据。
1 材料与方法
1.1 实验材料
实验所用的金鱼于2009年11月5日购于青岛市某金鱼养殖场,为同一批亲鱼孵化。选用同一规格的健康活泼的雌性个体84尾,在4个规格为30 cm×60 cm×30 cm的玻璃水族箱内暂养(每箱21尾)10 d,每日投喂同种配合饲料2次至饱食。暂养后金鱼体长为(6.6±0.8)cm,体质量为(38.8±10.1)g,卵巢发育为III期。暂养及实验期间连续充气,日换水量2/3,日光照时间12 h。暂养及实验用水为提前经过2 d曝气并调好水温的自来水,水温(18.1±0.8)℃,p H值为7.84~8.12,硬度为4.46 mmol/L。
1.2 实验分组及取样
设1个对照组和3个饥饿处理组,分别为A组(对照组,持续投喂15d,放鱼48尾)、B组(饥饿5 d,放鱼12尾)、C组(饥饿10 d,放鱼12尾)和D组(饥饿15 d,放鱼12尾)。实验持续时间为15 d。取样时间:第0天,取A组;第5天,取B组;第10天,取C组;第15天,取D组。每次取样每组取3尾,每尾采集的组织为心、肝、脾、肾脏、卵巢、鳃、脑、头肾、肠和肌肉,采集时放入液氮中速冻,然后转移至-80℃超低温冰箱中保存备用。
1.3 试剂来源
本实验所用18S和PCR特异性引物均由上海生工生物技术公司合成。Taq酶、DNase(RNasefree)、RNasin、RNA提取试剂Trizol Reagent、M-MLV购自TaKaRa公司,普通琼脂糖凝胶、Marker、购自北京天根生化科技有限公司,其余为国产分析纯试剂。
1.4 基因表达
1.4.1 组织总RNA的提取及RNA中DNA去除取-80℃保存的肠、鳃、心、脾、肾、头肾、精巢、肝、肌肉、脑组织各100 m g,用RNAiso Reagent抽提总RNA,通过1%琼脂糖凝胶电泳检测RNA完整性。以DNase I酶去除基因组DNA,紫外分光光度计测定RNA浓度。
1.4.2 RNA反转录为cDNA 根据TaKaRa公司的M-MLV反转录体系(RNA 1μg,Oligo-d T18 1μL,补充RNase-free水至6μL)进行cDNA第一链的合成。70℃加热10 min,后迅速在冰上冷却。继续加入MMLV Buffer 2μL,M-MLV 1μL,Rnase inhibito r 0.25 μL,dN TPs 0.5μL。经过42℃60 min,70℃15 min,95℃加热5 m in,反应结束。合成的cDNA保存于-20℃备用。
1.4.3 CYP19基因的组织表达 将cDNA稀释10倍后取1μL作为模板进行PCR扩增。利用Primer 5.0软件设计2对PCR特异性引物CYP19A F、CYP19AR、CYP19B F和CYP19BR(见表1和2),特异性片段长162 bp。PCR反应条件为94℃5 min,94℃30 s、61.2℃(A)&60.9℃(B)30 s、72℃30 s共45个循环,72℃10 min。18S rRNA作为反应的内参照物。取5μL的PCR产物进行电泳。对电泳结果采用Tanon GIS凝胶图象处理系统进行分析。
1.4.4 饥饿对CYP19基因在脑和卵巢中表达的影响
随机选饥饿0(对照组)、5、10和15 d的金鱼各3条,取每条鱼的脑和性腺2个组织提取RNA,反转录得到cDNA,并稀释后进行不同饥饿时间的CYP19A和CYP19B基因表达分析,反应条件同上。
1.5 数据处理
所有数据均采用平均值±标准差(Mean±S.D.)表示,不同处理组数据采用ANOVA单因素方差分析进行显著性检验。实验数据统计分析使用SPSS l2.0软件。某组织的CYP19基因相对表达量=该组织CYP19基因表达量/该组织18S rRNA基因表达量。

表1 雌性金鱼性腺型芳香化酶基因(CYP19A)的表达所用引物Table 1 Primers used fo r goldfish CYP19A gene cloning and m RNA exp ression analysis
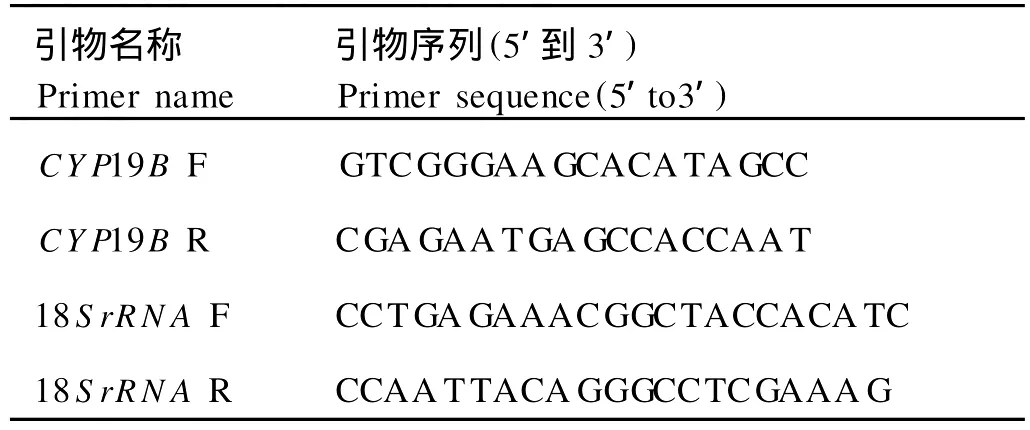
表2 雌性金鱼脑型芳香化酶基因(CYP19B)的表达所用引物Table 2 Primers used for goldfish CYP19B gene cloning and m RNA exp ression analysis
2 结果
2.1 雌性金鱼CYP19A基因的组织表达
取正常投喂的金鱼的卵巢、脑、肝脏、肠、心、脾、头肾、肾、鳃和肌肉10个组织,用以上半定量RT-PCR的方法测定其CYP19A基因的表达情况。结果表明,该基因在上述10种组织中都有表达;但只是表达量有所差异:性腺中表达最丰富,心脏中最少(见图1,2)。
2.2 饥饿对雌性金鱼CYP19A基因在脑和卵巢中表达的影响
随机选饥饿5、10和15 d的金鱼各3条,取每条鱼的脑和性腺2个组织用以上半定量RT-PCR的方法测定其CYP19A基因的表达情况;得出数据再同对照组的结果相比较,结果见图3。对照组中性腺表达水平显著高于脑中(P<0.05),说明性腺型芳香化酶主要在性腺中表达。CYP19A基因在脑和性腺中的表达规律相似:饥饿5 d时表达量显著降低至较低的水平(P<0.05),饥饿期间,表达水平无显著差异(P>0.05)。

图1 CYP19A基因m RNA在雌性金鱼各组织表达Fig.1 Them RNA exp ression of CYP19A gene in tissues of female goldfish

图2 CYP19A基因m RNA在雌性金鱼各组织的相对表达量Fig.2 Relative exp ression level of CYP19A in tissuesof female goldfish

图3 饥饿胁迫对雌性金鱼CYP19A基因m RNA在脑和卵巢中表达的影响Fig.3 Effects of starvation stress on relative exp ression level of CYP19A in ovary and brain of goldfish
2.3 雌性金鱼CYP19B基因的组织表达
取正常投喂的金鱼的卵巢、脑、肝脏、肠、心、脾、头肾、肾、鳃和肌肉10个组织,用以上半定量RT-PCR的方法测定其CYP19B基因的表达情况。结果表明,CYP19B基因仅在以下6种组织中有表达:肌肉、脑、心、头肾、脾和性腺。表达量也有差异:脑中表达最丰富,其余依次为:头肾、性腺、脾、肌肉和心脏(见图4,5)。
2.4 饥饿对雌性金鱼CYP19B基因在脑和卵巢中表达的影响
随机选饥饿5、10和15 d的金鱼各3条,取每条鱼的脑和性腺2个组织用以上半定量RT-PCR的方法测定其CYP19B基因的表达情况;得出数据再同对照组的结果相比较,结果见图6。对照组中脑表达水平显著高于性腺中(P<0.05),说明脑型芳香化酶主要在脑中表达。CYP19B基因在脑的表达规律:饥饿5 d时表达量显著降低至较低的水平(P<0.05),饥饿期间,表达水平无显著差异(P>0.05)。CYP19B基因在性腺的表达规律:饥饿5 d时表达量显著降低至较低的水平(P<0.05);饥饿10~15 d,表达水平显著上升(P<0.05),但仍然显著低于对照水平(P<0.05)。

图4 CYP19B基因m RNA在雌性金鱼各组织表达的凝胶成像图Fig.4 The m RNA exp ression of CYP19B gene in tissues of female goldfish

图5 CYP19B基因m RNA在雌性金鱼各组织的相对表达量Fig.5 Relative Expression level of CYP19B in in tissues of female goldfish
3 讨论
CYP19A基因在金鱼卵巢中具有非常高的表达水平,说明卵巢型芳香化酶主要在性腺中发挥作用,这与先前在其它鱼类所取得的研究结果是一致的。除性腺外,肝脏内的表达量位居第二,原因可能在于,肝脏中多量的芳香化酶通过促使循环血液中的雄激素转化为雌二醇,进而刺激肝脏合成卵黄蛋白原[4]。脑中的表达量相对较低,推测可能与硬骨鱼类2种芳香化酶基因的组织特异性表达有关,即在脑组织中,表达量更大、发挥更多作用的是CYP19B基因。M eital等[19]通过测定不同卵巢发育阶段的丝足鱼2种CYP19基因的表达水平,认为2种芳香化酶在功能上存在差异。李广丽等研究表明[4],赤点石斑鱼(Epinephelus akaara)雌鱼性腺型芳香化酶的表达量依次是性腺、垂体、鳔、鳃、头肾、中脑,本研究与该结果一致,也与金鱼[12]、虹鳟(Oncorhynchus m ykiss)[13]、半滑舌鳎(Cynog lossus sem ilaevis)[14]的研究结果类似。但是徐跑等报道[15],P450arom A在黄颡鱼(Pelteobagrus fulvidraco)前脑、下丘脑、脑垂体、精巢、肝脏中不表达,只在卵巢中表达,并推测其对卵巢发育起着重要作用,与金鱼、赤点石斑鱼等表达规律不同。M akoto等[20],使用RT-PCR技术定量分析大西洋庸鲽(H ippog lossus hippog lossus)卵巢型和脑型芳香化酶基因表达,发现CYP19A基因在卵巢中表达量最高,其次为脾脏,在肝脏及心脏中未见表达。这些不同实验结果存在差异的原因,可能在于采样时鱼体所处生长发育阶段的不同(是否达到性成熟、性腺发育周期),或是鱼类的种间差异(不同的产卵类型)。

图6 饥饿胁迫对雌性金鱼CYP19B基因m RNA在脑和卵巢中表达的影响Fig.6 Effects of starvation stress on relative exp ression level of CYP19A in ovary and brain of goldfish
CYP19B基因表达以脑中最多,证明脑型芳香化酶直接参与了脑组织中雌激素的合成;CYP19B在卵巢中表达量也较高,说明脑型芳香化酶也参与卵巢发育过程的调节。李广丽等报道[4],赤点石斑鱼雌鱼脑型芳香化酶表达量在脑组织最高,与本研究结果相似。徐跑等则发现[16],P450arom B在脑、卵巢和精巢均有表达,脑部表达量高于性腺,与本实验结果完全一致。Tchoudakova和Callard)证实[17],金鱼P450arom B只在脑中表达,在卵巢中没有检测到,可能与性腺发育期有关。本研究用于实验的雌性金鱼卵巢发育期为III期,即正处于卵黄积累时期,卵巢中2种基因表达均处于活跃期,与卵巢发育期吻合。
经过饥饿处理5、10、15 d的金鱼,其CYP19A和CYP19B基因m RNA在卵巢和脑中的表达水平,与正常投喂的对照组相比,均呈现显著降低(P<0.05)。但是在3个饥饿处理组之间,基因表达水平无显著差异(P>0.05),相对表达量始终维持在相对稳定的水平。
雌激素参与性别分化、性腺的生长和发育、调控繁殖行为以及卵黄蛋白原的肝脏合成(Lange等)[21]。而芳香化酶的主要功能是催化雄激素转化为雌激素。因此,可以推断在饥饿胁迫条件下,CYP19基因表达水平显著降低可能使雌激素合成受阻,并且进一步影响卵黄蛋白原的合成以及卵巢组织的发育。
沈文英等[22]报道,饥饿延缓了银鲫卵巢的发育:饥饿4周以及饥饿2周后再投喂2周的银鲫,其性腺成熟系数均显著低于投喂组;饥饿1~4周其卵径均显著低于投喂组,饥饿2周后再投喂2周卵径仍显著低于投喂组。任岗等[23]在对异育银鲫的研究中发现,处理组饥饿1周,鱼体GSI极显著低于投喂组。在对血液中SPP和SPC含量测定后,发现饥饿2周,导致SPP和SPC含量均极显著低于投喂组。说明饥饿使异育银鲫的卵巢发育受到了抑制。在恢复投喂后异育银鲫的GSI、LSI、SPP、SPC含量均有所回升,但仍明显低于投喂组的水平。
但是,对于饥饿导致芳香化酶基因表达水平下降的机制,目前尚无报道。推测金鱼在受到饥饿胁迫后,由于缺乏卵巢发育所必须的营养物质、甚至产生发育停滞退化,从而削弱了机体对于雌激素的需求,故导致芳香化酶基因表达水平下降。若以上假设成立,则能够解释在饥饿后再次投喂产生的补偿生长过程中,卵巢发育的恢复滞后于身体生长的现象[22-23]。也能够说明,在饥饿胁迫下,鱼体处于1种“生存应激”状态下,尽量抑制繁殖活动以安全度过饥饿应激时期。
在本研究中,5 d内鱼体就能够及时调控内分泌并强烈抑制性腺发育,可能体现了鱼体在进化上应对饥饿胁迫高度的敏感性和适应性。金鱼雌鱼在饥饿胁迫5 d之后,性腺发育基本停滞甚至退化,开始分解较成熟卵母细胞的卵黄囊以维持基本生命活动(姜龙,2010年未发表的数据)。这一过程可能与芳香化酶活性受到抑制的现象相适应,因为芳香化酶的主要功能是促进卵黄积累和卵母细胞成熟分化,当卵巢处在发育缓慢、停滞和退化的过程中,雌激素的合成受到抑制,卵巢和脑部芳香化酶基因的表达也经过复杂的调节之后被反馈抑制。可见,芳香化酶基因的表达及其所作用效果,始终受到复杂而又精密的神经-内分泌调节,这一生理机制有待于进一步研究。
因此,金鱼脑型芳香化酶在脑和卵巢中的表达受到饥饿胁迫后的变化规律:饥饿5 d时表达量显著降低至较低的水平(P<0.05),随后表达水平维持稳定。推测雌鱼在饥饿条件下,雌激素合成量锐减,卵巢发育缓慢甚至停滞,以度过饥饿期。
[1] John MT,Sonja G,Jared A,et al.Developmental expression of cytochrome P450 aromatase genes(CYP19a and CYP19b)in Zebrafish fry(Danio rerio)[J].J Exp Zool,2001,290:475-483.
[2] Yu J H,Tang Y K,Li J L.Cloning,structure,and expression pattern of the P-450 aromatase gene in rice field eel(Monopterus albus)[J].Biochem Genet,2008,46:267-280.
[3] Piferrer F,Bla′zquez M.A romatase distribution and regulation in fish[J].Fish Physiol Biochem,2005,31:215-226.
[4] 李广丽,刘晓春,张勇,等.赤点石斑鱼两种芳香化酶cDNA的克隆及其表达的组织特异性[J].动物学报,2004,50(5):791-799.
[5] 邓利,张波,谢小军.南方鲇继饥饿后的恢复生长[J].水生生物学报,1999,23(2):168-173.
[6] 王燕妮,张志蓉,郑曙明.鲤鱼的补偿生长及饥饿对淀粉酶的影响[J].水利渔业,2001,21(5):6-7.
[7] 姜志强,贾泽梅,韩延波.美国红鱼继饥饿后的补偿生长及其机制[J].水产学报,2002,26(1):67-71.
[8] 崔正贺,王岩.不同体重异育银鲫(Carassius auratus gibelio)的补偿生长[J].海洋与湖沼,2007,38(1):8-14.
[9] 柴鹏,李吉方.饥饿和再投喂对锦鲤幼鱼几种消化酶活性的影响[J].水利渔业,2007,27(4):12-14.
[10] 张波,孙耀,唐启升.饥饿对真鲷生长及生化组成的影响[J].水产学报,2000,24(3):206-210.
[11] 沈文英,林浩然,张为民.饥饿和再投喂对草鱼鱼种生物化学组成的影响[J].动物学报,1999,45(4):404-412.
[12] Callard GV,Tchoudakova A.Evolutionary and functional significance of two CYP19 genes differentially exp ressed in brain and ovary of goldfish[J].J Steroid Biochem&Mol Biol,1997,61(3-6):387-392.
[13] Belvedere L P,Dalla Valle A,Lucchetti A,et al.Extra glandular expression of genes encoding steroidogenic cytochromes in rainbow trout(Oncorhynchus mykiss Walbaum)[J].Ann N Y Acad Sci,1998,839(1):559-589.
[14] 邓思平,陈松林,刘本伟,等.半滑舌鳎脑芳香化酶基因cDNA克隆及表达分析[J].动物学研究,2008,29(1):17-24.
[15] 徐跑,俞菊华,唐永凯,等.黄颡鱼卵巢P-450arom基因的克隆及组织表达[J].中国水产科学,2005,12(5):542-548.
[16] 徐跑,俞菊华,李建林,等,黄颡鱼脑P-450芳香化酶基因的克隆和组织表达[J].水产学报,2005,29(50):591-598.
[17] Tchoudakova A,Callard G V.Identification of multiple CYP919 genes encoding different cytochrome P459 aromatase isozymes in brain and ovary[J].Endocrinology,1998,139(4):2179-2189.
[18] 姜龙.饥饿对金鱼雌鱼卵巢发育及性腺型芳香化酶基因(CYP19A)表达的影响[D].青岛:中国海洋大学水产学院,2010.
[19] Meital Ezagouri,Svetlana Yom-Din,et al.Expression of the two cytochrome P450 aromatase genes in the male and female blue gourami(Trichogaster trichopterus)during the reproductive cycle[J].General and Comparative Endocrinology,2008,159:208-213.
[20] Makoto P,Matsuoka,Solveig van Nes,et al.Real-time PCR analysis of ovary-and brain-type aromatase gene-and brain-type aromatase gene expression during Atlantic halibut(Hippog lossus hippoglossus)development[J].Comparative Biochemistry and Physiology,Part B144(2006)128-135,2006,144B:128-135.
[21] Lange IG,Hartel A,Meyer H H.Evolution of oestrogen functions in vertebrates[J].Steroid Biochem Mol Biol,2002,83:219-226.
[22] 沈文英,张利红,郑永萍,等.饥饿对银鲫血液组分和卵巢发育的影响[J].动物学研究,2003,24(6):441-444.
[23] 任岗,寿建昕,沈文英.饥饿和恢复投喂对异育银鲫生长和卵巢发育相关指标的影响[J].水产科学,2010,29(9):515-518.

