HIF-1α和VEGF蛋白及其mRNA在猪胆肠吻合口组织中的表达及意义
杨宏强,彭心宇,张示杰,陈琳,张志伟,梁慧芳,李江,张宏伟,陈孝平
(1石河子大学医学院第一附属医院肝胆外科,石河子832002;2华中科技大学同济医学院附属同济医院肝脏外科中心,武汉430030)
HIF-1α和VEGF蛋白及其mRNA在猪胆肠吻合口组织中的表达及意义
杨宏强1,2,彭心宇1,2,张示杰1,2,陈琳2,张志伟2,梁慧芳2,李江1,张宏伟1,陈孝平2
(1石河子大学医学院第一附属医院肝胆外科,石河子832002;2华中科技大学同济医学院附属同济医院肝脏外科中心,武汉430030)
为了观察猪胆肠吻合术模型的吻合口愈合过程中HIF-1α和VEGF的表达及其意义,建立猪的胆肠吻合手术模型,大体及组织HE观察吻合口的愈合情况,用免疫组化和Real-time PCR法检测胆肠吻合口组织中HIF-1α和VEGF蛋白及其mRNA分别在术后7、30、90和180d的表达。结果显示:1例术后胆瘘死亡外,其余29例均存活。术后7、30、90和180d组胆肠吻合口均有不同程度的狭窄,180d狭窄最严重;HE染色观察180d组狭窄的吻合口均有瘢痕组织增生。术后7d吻合口组织中HIF-1α和VEGF的蛋白及其mRNA的表达量最高(P<0.05),30d及90d表达量降至很低水平,180dHIF-1α和VEGF的表达略有增高。结论:HIF-1α和VEGF参与了胆肠吻合口早期愈合过程及后期的瘢痕形成。
胆肠吻合术;缺氧诱导因子-1α;血管内皮细胞生长因子;动物模型
胆肠吻合术是腹部外科常用的胆道重建方式,其术后主要并发症是狭窄和胆瘘,术后胆肠吻合口的愈合情况直接影响治疗效果和患者的生活质量,胆肠吻合口愈合过程就是创伤愈合的过程,血管再生是创伤愈合过程中的一个重要环节,直接影响愈合的过程。细胞生长因子对这一过程的发生和发展具有重要的调节作用。因此了解吻合口愈合过程中细胞生长因子的表达及作用,可以有针对性地干预治疗,以促进吻合口的愈合,减少瘢痕,提高愈合质量。
缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)和血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)是与血管再生密切相关的细胞因子,能够刺激和调节内皮细胞增殖和新生血管的生成[1-3]。HIF-1α和 VEGF 在哺乳动物皮肤损伤愈合过程中起着重要的作用,但在胆肠吻合口的愈合过程中的研究较少。本研究通过建立猪的肝肠吻合手术模型,应用病理学和分子生物学方法观察胆肠吻合术后不同时间段胆肠吻合口组织中HIF-1α和VEGF蛋白及其mRNA的表达变化,初步探讨其在胆肠吻合术后吻合口愈合过程中的作用及意义。
1 材料与方法
1.1 材料
1.1.1 实验动物
选取同种系3月龄、质量(20±1)kg的普通雌性家猪22只作为实验动物。
1.1.2 主要试剂
HIF-1α鼠抗单克隆抗体和VEGF鼠抗单克隆抗体(美国Novus Biologicals公司),Envision免疫组化试剂盒、DAB免疫组化显色试剂盒(丹麦DAKO Cytomation公司),Trizol(Invitrogen 公司);逆转录酶试剂盒和SYBR Green反应混合物购自TOYOBO公司(日本);安氟醚吸入剂(250mL,上海雅培制药有限公司),盐酸氯胺酮注射液(0.1 mg,江苏恒瑞医药股份有限公司),盐酸阿托品注射液(1mg,山东华信制药集团股份有限公司),盐酸丙泊酚(静安)注射液(20mL,北京费森尤斯卡比医药有限公司),地西泮(安定)注射液(10mg,甘肃兰药药业集团有限责任公司),甲氰咪胍注射液(200 mg,海南皇隆制药厂有限公司)。
1.2 方法
1.2.1 实验动物分组
将22只实验用猪分为4组,分别为7d组、30d组、90d组和180d组,7d组和30d组各5只,90d组和180d组各6只,均行Roux-en-Y胆肠吻合术[4]。
1.2.2 胆肠吻合术动物模型的建立
1.2.2.1 术前处理
实验用猪术前禁食12h,禁水6h。术前0.5h肌内注射安定5mg,西咪替丁0.6g。术前术野脱毛。
1.2.2.2 麻醉方法
采用气管插管全身麻醉,先用氯胺酮2mg/kg进行诱导麻醉,阿托品1mg肌注后行气管插管,用安福醚吸入和异丙酚5(mg/kg)/h静脉滴入复合麻醉。麻醉效果满意后,行右侧颈内静脉置管备静脉输液用。术中全程监测生命体征的变化。
1.2.2.3 手术方法
取上腹正中切口,逐层开腹,游离胆总管及肝总管,切除胆囊、肝总管下段及胆总管中上段,结扎胆总管远端。用5-0可吸收线将肝总管断端与小肠肠管行端侧全口粘膜对粘膜、连续缝合,缝合边距1.0~1.5mm、缝合间距1.0~1.5mm,以不漏胆汁为宜,并以Roux-en-Y方式进行肠道重建,无菌生理盐水冲洗腹腔后关腹。术中不放置胆管支撑引流管及腹腔引流管。
1.2.2.4 术后处理
术后第1~2天禁食水,经颈静脉插管给予抗生素预防感染和补液治疗。第3天给予限制半流饮食,第4天后不再限量饮食,术后1周内每日用碘酒进行腹部切口消毒。
1.2.2.5 观察指标
各组分别饲养至术后7、30、90和180d处死,大体观察吻合口愈合情况,取吻合口部位组织部分液氮冻存,另一部分用4%中性多聚甲醛溶液固定,制备石蜡标本;用免疫组化和Real-time PCR法检测胆肠吻合口组织内HIF-1α和VEGF的蛋白及其mRNA在术后不同时期的表达。
1.2.3 实验方法
1.2.3.1 HE染色
取吻合口组织石蜡标本常规4m切片,采用常规HE染色,显微镜下观察不同时期吻合口组织病理学变化。
1.2.3.2 免 疫 组 织 化 学 方 法 分 析 HIF-1α 和VEGF蛋白的表达
采用DAKO公司两步法(ELPS法):滴加一抗HIF-1α1∶500;VEGF 1∶200,4℃过夜。以Envision,Peroxidase,Goat孵育30min。DAB孵育1 min。苏木素复染。结果评价:HIF-1α蛋白以细胞核或胞浆中有棕黄色颗粒为阳性,无反应为阴性。VEGF蛋白以细胞浆内见棕黄色颗粒为阳性,无反应为阴性。低倍镜视野下观察染色面积:<25%记为1分,26%~50%记为2,51%~70%记为3分,>71%记为4分;染色强度:无色记为1分,浅棕黄色记为2~3分,棕黄色记为4~5分,棕褐色记为6~7分,由2位病理科医师分别独立镜检。统计时记录每张切片的染色面积、染色强度分值之和。以已知的阳性的组织切片做阳性对照。
1.2.3.3 实时荧光定量PCR检测 HIF-1αmRNA和VEGF mRNA的表达
总RNA的提取和逆转录:采用TOYOBO公司的RT-PCR试剂盒逆转录合成cDNA,严格按试剂盒说明书进行操作。取0.1g吻合口组织放入匀浆器中,加入1mL TRIZOL reageant在冰上匀浆30 min,抽取上清提取总RNA并逆转录为cDNA。
荧光定量PCR检测:HIF-1α、VEGF及内参βactin的基因引物序列利用Primer5.0软件设计。
HIF-1α 引 物 上 游:5′TTGAAGATGAAATGAAGGCACAGA 3′,
下 游:5′ATGGTCGCACGGATGAGTAAA 3′;
VEGF引物上游:5′GCCGTCCAATCGAGACCCT 3′,
下游:5′CATGGCGATGTTGAACTCCTC 3′。
内参β-actin引物上游:退火温度均为60℃。荧光定量PCR采用ABI公司的SYBRGreen PCR Master Mix试剂盒,25μL体系用ABI Prism7000 Sequence Detection System检测。利用比较ct值法检测HIF-1αmRNA、VEGFmRNA在组织中的表达情况。
1.2.4 数据处理
数据采用SPSS11.0统计学软件进行分析,观察结果指标以描述,实验组左右肝管数据比较采用配对t检验,术后个时间点比较采用成组设计资料的t检验或t`检验,以P<0.05为差异有统计学意义。
2 结果分析
2.1 术后不同时期吻合口愈合情况
除90d组1例于术后第5天死于吻合口胆瘘外,其余实验猪均成活。各组分别于术后7d、30d、90d和180d处死,大体病理观察吻合口愈合情况。7d组吻合口水肿较明显,吻合线尚未脱落,未出现明显狭窄;30d、90d和180d组吻合口依术后时间递增,出现不同程度的吻合口环形狭窄,180d组狭窄最明显。
2.2 吻合口组织HE染色镜下观察
术后7d吻合口粘膜层基本对合,粘膜下层、肌层及浆膜层对接处有肉芽组织填充,连接紧密,内可见大量的炎性细胞、成纤维细胞浸润,大量的新生毛细血管增生。术后30d胆管与肠管粘膜层完全对合,粘膜下层、肌层及浆膜层对接处有大量的胶原纤维组织填充,连接紧密,炎性细胞成分明显减少,可见少量成熟的小血管及小胆管。术后90d胆管与肠管粘膜层对合良好,其内见少量炎性细胞浸润,吻合口粘膜下层见粗大的胶原纤维组织隆起,排列较杂乱。术后180d吻合口部分粘膜层脱落变薄,其内见较多量炎性细胞浸润,吻合口粘膜下层见纤维瘢痕组织隆起,胶原纤维粗大,排列杂乱,周围可见少量小血管增生。
2.3 免疫组化检测术后不同时期吻合口组织中HIF-1α和VEGF蛋白的表达
术后7d吻合口组织中阳性表达最多,HIF-1α和VEGF蛋白在粘膜上皮细胞、炎性细胞、成纤维细胞及新生小血管内皮细胞的细胞浆内均有不同程度的阳性表达,与其他时期比较,差异有统计学意义(P 值均小于0.05)(图1)。术后30、90d时,HIF-1α和VEGF在吻合口组织中无明显阳性表达。术后180d时,HIF-1α和VEGF蛋白在吻合口瘢痕组织周围小血管内皮细胞的细胞浆内有少量弱阳性表达。
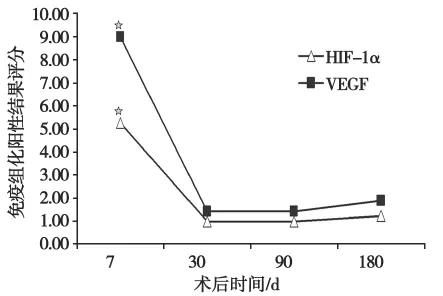
图1 免疫组化染色HIF-1α和VEGF蛋白在不同时期胆肠吻合口组织中的表达Fig.1Expression of the proteins of HIF-1αand VEGF in bilioenteric stoma of all the groups by Immunohistochemisty
2.4 Realtime PCR检测术后不同时期吻合口组织中HIF-1αmRNA和VEGF mRNA的表达
结果见图2。

图2 Real time PCR检测HIF-1α和VEGF mRNA在不同时期胆肠吻合口组织中的表达Fig.2Levels of HIF-1αand VEGF mRNA in bilioenteric stoma of all the groups were measured by realtime PCR
由图2可见,术后不同时期HIF-1αmRNA和VEGF mRNA的表达量不同,但表达趋势相同。术后7dHIF-1α和VEGF mRNA的表达量最高;术后30d及90d,其表达量均较低,术后180d其表达量略有升高,但与术后30d及90d比较,差异无统计学意义。术后7d与其他时期比较,其差异有统计学意义(P值均小于0.05)。
3 讨论
血管再生是创伤愈合的一个重要环节,细胞生长因子VEGF和HIF-1α对这一过程的发生和发展具有重要的调节作用。参与创伤修复的很多类型的细胞都能产生VEGF,如内皮细胞、成纤维细胞、平滑肌细胞、血小板、中性粒细胞和巨噬细胞等[5-6]。VEGF是一类作用于血管内皮细胞的糖蛋白,是主要的血管生成因子之一,具有强烈的促进内皮细胞增殖,诱导血管生成的作用。目前发现,VEGF参与许多病理、生理过程,包括创伤愈合、肿瘤生长等[7-10]。VEGF通过多种机制促进伤口愈合,包括:血管形成、胶原沉积、和上皮化等。VEGF具有促血管内皮细胞分裂、增殖作用,增加血管的通透性,诱导内皮细胞Bcl-2基因表达,提高内皮细胞抗凋亡能力。
HIF-1α是 HIF-1所特有的受低氧调控的亚基。正常氧饱和度下的组织细胞中,HIF-1α亚基在翻译后易被蛋白酶降解。在组织缺氧时,HIF-1α亚基的降解被抑制,使得HIF-1α的含量明显增加,得以和HIF-1β亚基结合形成有活性的复合物HIF-1,HIF-1是缺氧状态下血管生成的核心调控因子,能够控制多种促血管生成因子的合成,如血管内皮生长因子(VEGF)、促红细胞生成素、内皮素-1等二十多种因子,直接参与血管生成的全过程[11]。
HIF-1对 VEGF的调控表现在多个层面上[12-13],既 能 启 动 VEGF 的 转 录,又 可 以 上 调VEGF受体Flt-1的转录,加强VEGF的生物学效应[14]。Albina等[15]的研究结果表明,HIF-1α在创伤愈合的初期即开始表达,VEGF在其后在创伤组织中表达,HIF-1α促进了VEGF的表达,在创伤的修复过程中协同发挥作用。Elson等[1]研究表明,HIF-1αmRNA的表达与其调控的VEGF mRNA的表达保持一致性,均在创伤区域上皮化以前高表达,上皮化后表达明显减少。本研究的结果显示:胆肠吻合术后7d吻合口组织水肿,镜下可见大量的肉芽组织、炎细胞、成纤维细胞存在,并可见大量的新生毛细血管,HIF-1αmRNA和VEGF mRNA及其蛋白在吻合口肉芽组织、及粘膜层中均有较高表达,提示在此时局部组织仍处于缺氧阶段,HIF-1α诱导VEGF合成,加速新生血管的形成及肉芽组织成熟,促进伤口愈合。随着新生血管的成熟和组织再灌注,局部组织缺氧状态明显改善,至术后30d,吻合口上皮化已完成,愈合良好,局部未见HIF-1α和VEGF蛋白水平的明显表达。因此,VEGF mRNA与HIF-1αmRNA及其的表达在时间和空间上保持一致性,参与了胆肠吻合口的早期愈合,起着重要作用。
胆肠吻合术后180d,由于肠液、胆汁刺激所致吻合口局部长期慢性炎症,吻合口处增生性瘢痕不断增多,HIF-1α和VEGF又出现少量表达,有研究表明,VEGF能促进胶原的沉积,参与了增生性瘢痕的发生与发展[16],所以,HIF-1α和 VEGF有可能在此时期加速增生性瘢痕的形成。
Liu等[2]的研究结果表明:愈合早期增强HIF-1α的表达及活性,能促进VEGF的合成,从而加速损伤部位的血管生成及上皮化,进一步促进和加速伤口愈合。Ishii等[17]的研究结果表明VEGF可以加速结肠吻合术后的愈合。因此,HIF-1α和VEGF可以作为促进胆肠吻合口早期愈合的靶点。VEGF对吻合口瘢痕形成和转归有一定调节作用,但其机制尚不明确,还有待经一步研究。
[1]Elson D A,Ryan H E,Snow J W,et al.Coordinate up regulation of hypoxia inducible factor(HIF)-1alpha and HIF-1target genes during multi-stage epidermal carcinogenesis and wound healing[J].Cancer Res,2000,60(21):6189-6195.
[2]Liu L,Marti G P,Wei X,et al.Age-dependent impairment of HIF-1alpha expression in diabetic mice:Correction with electroporation-facilitated gene therapy increases wound healing,angiogenesis,and circulating angiogenic cells[J].J Cell Physiol,2008,217(2):319-327.
[3]Santos S C,Miguel C,Domingues I,et al.VEGF and VEGFR-2(KDR)internalization is required for endothelial recovery during wound healing[J].Exp Cell Res,2007,313(8):1561-1574.
[4]吴在德,吴肇汉.外科学[J].7版.北京:人民卫生出版社,2008:547.
[5]Gavard J,Gutkind J S.VEGF controls endothelial-cell permeability by promoting the beta-arrestin-dependent endocytosis of VE-cadherin[J].Nat Cell Biol,2006,8:1223.
[6]Brkovic A,Sirois M G.Vascular permeability induced by VEGF family members in vivo:role of endogenous PAF and NO synthesis[J].J Cell Biochem,2007,100:727.
[7]Stojadinovic O K A,Golinko M,Tomic Canic M,et al.A novel,non-angiogenic mechanism of VEGF:stimulation of keratinocyte and fibroblast migration[J].Wound Repair Regen,2007,15:30.
[8]李志刚,马辉,黄桂林,等乳腺癌外周血中VEGF-C与癌组织中CerbB-2蛋白的表达及临床意义[J].石河子大学学报:自然科学版,2008,26(3):338-342.
[9]吴广胜,孙福金.急性白血病患者血清VEGF水平与临床关系的研究[J].石河子大学学报:自然科学版,2008,26(4):473-476.
[10]陈磊,王维山,王永明,等.膝关节镜下所见血管翳患者滑膜中VEGF、TGF-b1的表达及其意义[J].石河子大学学报:自然科学版,2010,28(1):72-75.
[11]Mace K A,Yu D H,Paydar K Z,et al.Sustained expression of Hif-1alpha in the diabetic environment promotes angiogenesis and cutaneous wound repair[J].Wound Repair Regen,2007,15:636.
[12]Pugh C W,Ratcliffe P J.Regulation of angiogenesis by hypoxia:role of the HIF system[J].Nat Med,2003,9:677-684.
[13]Mazure N M,Brahimi Horn M C,Pouyssegur J.Protein kinases and the hypoxia-inducible factor-1,two switches in angiogenesis[J].Curr Pharm Des,2003,9(7):531-541.
[14]Gerber H P,Condorelli F,Park J,et al.Differential transcriptional regulation of the two vascular endothelial growth factor receptor genes Flt-1,but not Flk-1/KDR,is up-regulated by hypoxia[J].Biol Chem,1997,272:23659-23667.
[15]Albina J E,Mastrofrancesco B,Vessella J A,et al.HIF-1expression in healing wounds:HIF-1alpha induction in primary inflammatory cells by TNF-alpha[J].Am J Physiol Cell Physiol,2001,281(6):1971-1977.
[16]TAN Zhaoyun,ZHAO Baicheng,QIAN L i,et al.Expression of COX-2and VEGF in hypertrophic scar and its clinical signif icance[J].Chin J Aesth Plast Surg,2008,19(5):348-352.
[17]Ishii M,Tanaka E,Imaizumi T,et al.Local VEGF administration enhances healing of colonic anastomoses in a rabbit model[J].Eur Surg Res,2009,42(4):249-57.
Role of HIF-1αmRNA and VEGF mRNA and Their Protein in the Local Tissues of Bilioenteric Stoma of Roux-en-Y
Cholangiojejunostomy Experimental Model in Pigs
YANG Hongqiang1,2,PENG Xinyu1,2,ZHANG Shijie1,2,CHEN Lin2,ZHANG Zhiwei2,LIANG Huifang2,LI Jiang1,ZHANG Hongwei1,CHEN Xiaopin2
(1Department of Hepatobiliary Surgery,First Affiliated Hospital,Medical College of Shihezi University,Shihezi 832008,China;2Hepatic Surgery Center,Tongji Hospital,Huazhong University of Science and Technology,Wuhan 430030,China)
To observe the role of HIF-1αand VEGF in the local tissues of bilioenteric stoma of Roux-en-Y cholangiojejunostomy experimental model in pigs,22cases Roux-en-Y cholangiojejunostomy experimentation animal model in pigs were established.According to the day of postoperation,the cases were divided into 4groups:7-day group (n=5),30-day group(n=5),90-day group(n=6)and 180-day group(n=6).In the corresponding time,pigs of each group were put to death and the local tissues of bilioenteric stoma were observed by general pathology and HE staining.The amplification and expression of HIF-1αand VEGF gene were determined with and immunohistochemistry and realtime PCR in the different period postoperationly.The results showed that 21cases were alive,except one case in the 90-day group dead from biliary fistula at the 5th day post-operation.Different stage stenosis in bilioenteric stoma were present in all of the groups(7-day,30-day,90-day and 180-day group),the most serious stenosis was in the cases of the 180-day group.The scar tissues in bilioenteric stoma of all the groups were observed by HE staining.The most obvious scar tissue was present in the local tissues in bilioenteric stoma of the cases in 180-daygroup.The expression of HIF-1αand VEGF protein and their mRNA in the local tissues in bilioenteric stoma of the 7-day group were higher than that in the other groups significantly(P<0.05).The expression of HIF-1αand VEGF protein and their mRNA in the 30-day group and 90-day were down to very low level,and the expression in the 180-day group were increased slightly.The conclusion is that HIF-1αand VEGF play an important role in the early healing process of Roux-en-Y cholangiojejunostomy and cicatrization in the later healing process of bilioenteric stoma.
Roux-en-Y cholangiojejunostomy;hypoxia-inducible factor-1;vascular endothelial growth factor;animal experimentation
R656
A
1007-7383(2011)06-0722-05
2011-09-26
新疆兵团卫生科技攻关重点项目(2010GG54),石河子大学重大科技攻关项目(gxji2008-zdgg06)
杨宏强(1972-),副主任医师,副教授,博士生,从事肝胆外科学研究;e-mail:hongq01@hotmail.com。
陈孝平(1953-),教授,主任医师,博士生导师,从事肝脏外科学研究。

