大肠杆菌分泌表达重组水蛭素Ⅲ的新方法研究
黄翠翠,吕静,吴梧桐,谭树华,王鑫
(中国药科大学生命科学与技术学院,江苏南京 210009)
水蛭素(hirudin)是从医用水蛭唾液腺中分离得到的一类抗凝血多肽物质,它是由65~66个氨基酸组成的小分子蛋白质(多肽)。水蛭素对凝血酶有极强的抑制作用,是迄今为止所发现最强的凝血酶天然特异抑制剂[1]。
大肠杆菌是应用最早的原核表达系统,其表达方式主要有3种形式:非融合表达、融合表达以及分泌表达。已有的分泌表达载体,如PIN-Ⅲ-ompA,所采用的是大肠杆菌外膜蛋白(ompA)信号肽序列,其后是用来插入外源基因的多克隆位点,当外源基因插入后,信号肽基因与目的基因间往往存在一段多余的连接序列,这样,为了得到N-端正确的目的产物,必须采用定点诱变技术,以去除信号肽基因与目的基因间的多余序列,操作十分繁琐。为了解决这一问题,谭树华等[2]创建了一种新型分泌表达载体pTASH,该表达载体含有tac启动子、L-门冬酰胺酶信号肽简并基因(L-asp)以及pUC18高拷贝复制原点,其中的L-asp 3'端与水蛭素编码基因5'端直接拼连组建成重组质粒,该质粒载体可分泌表达基因重组水蛭素及其突变体[3]。国外已成功构建双表达盒提高降钙素的表达[4],国内也有文献报道已成功构建双表达盒人骨唾液酸蛋白毕赤酵母工程细胞[5]。本研究在pTASH基础上构建了一种包含两个串联的水蛭素基因表达盒单元的分泌表达载体p(TASH)2,转化大肠杆菌后摇瓶培养,上清液抗凝血酶活性可达 3 500 ATU·ml-1。
1 材料与方法
1. 1 质粒
模板质粒pTASH由本室构建[2]。
1. 2 工具酶及主要生化试剂
限制酶、pMD-19T SimpleVector载体及DL2,000TMDNA Marker购自TaKaRa(大连宝生物工程有限公司),pfu酶、Taq酶及UNIQ-10柱式DNA胶回收试剂盒等购自上海生工生物有限公司,纤维蛋白原冻干粉购自上海莱士血液制品有限公司,凝血酶冻干粉购自南京南大制药有限公司,其余试剂均为进口或国产分析纯。
1. 3 仪器
Effendorf PCR仪(德国 Eppendorf),EPS 300电泳仪(上海天能科技有限公司),UV2000紫外分析仪(上海天能科技有限公司)。
1. 4 方法
1.4.1 表达载体pTASH中表达盒基因的扩增
依据模板质粒pTASH基因序列设计合成引物。正向引物 pkk223-3TAC-f:5'GGATCCAAGCTGTGG TATGGCTGTGCAGGTCGTAAATC-3'(下划线指示BamHⅠ酶切位点);反向引物pkk223-3rrnBT2-r:5'GGATCCAGCGTTTCTGGGTGAGCAAAAACAGGAAG-3'(下划线指示BamHⅠ酶切位点)。以质粒pTASH为模板,在Pfu DNA聚合酶的作用下进行PCR反应。50 μl PCR反应体系为:正向引物及反向引物各20 pmol,Pfu DNA 聚合酶5 U,10 × 反应缓冲液5 μl,dNTP(10 mmol·L-1)1 μl,MgCl2(25 mmol·L-1)3 μl,质粒 DNA 0.3 μg,用无菌水补足到 50 μl。反应条件如下:95℃变性5 min,进入循环反应(95℃ 30 s,55℃ 30 s,72℃ 2 min,反应30个循环),最后在72℃延伸10 min。用乙醇沉淀PCR产物,待乙醇挥发后,用Taq DNA聚合酶在PCR产物两端加A尾。
加完A尾的PCR产物,经琼脂糖凝胶电泳分离,并以DL2,000TMDNA Marker作为对照,检测基因片段大小正确后回收目的片段。目的片段与T载体在T4 DNA连接酶的作用下连接,连接产物转化大肠杆菌宿主菌。采用菌落PCR法筛选阳性克隆,从阳性克隆中提取质粒进行测序,测序反应由Invitrogen公司完成。经测序验证序列正确的质粒,命名为pMD-19T-TASH(图1)。

图1 pMD-19T-pTASH质粒图谱Fig 1 Plasmid pMD-19T-pTASH
1.4.2 双表达盒重组水蛭素质粒的构建
1.4.2.1 双表达盒菌种的构建 用碱裂解法提取质粒pMD-19T-TASH,BamHⅠ酶切,以 DL2,000TMDNA Marker作为对照,经1.5%琼脂糖凝胶电泳分离,并回收酶切片段,得到大小约1.1 kb的表达盒片段。抽提模板质粒pTASH,用BamHⅠ酶切,以得到具有与表达盒片段相同的黏性末端的线性化pTASH。为防止线性化的pTASH在连接反应中发生自身环化,需要使用去磷酸酶CIAP将其5'磷酸基团转变为羟基。线性化的pTASH 在40 μl反应体系(10× 反应缓冲液 4 μl,CIAP 2 μl)中于37℃反应4 h,65℃ 30 min灭活处理终止反应,然后用乙醇沉淀得到较纯的去磷酸化的线性pTASH。将表达盒片段与去磷酸化的线性pTASH在T4 DNA连接酶的作用下于16℃连接过夜,连接产物直接转化大肠杆菌宿主细胞。
1.4.2.2 菌种的筛选 筛选双表达盒质粒采用BamHⅠ酶切方法。此外,新插入的表达盒片段可以正向和反向两种方式插入原始质粒pTASH中(图2、3)。为了检测新插入表达盒的插入方向,选用EcoRⅠ酶切进行验证。
1.4.3 重组水蛭素Ⅲ的高效分泌表达
挑选菌种筛选为阳性的重组水蛭素Ⅲ双表达盒克隆p(TASH)2,接入30 ml LBA液体培养基中进行种液培养,37 ℃、220 r·min-1振荡培养14 h。然后以2%接种量转接至发酵培养基(胰蛋白胨1%,酵母粉0.5%,谷氨酸钠 4%,麦芽粉 1.0%,Amp 100 μg·ml-1,KH2PO40.374%,Na2HPO4·12H2O 1.75%,pH 7.0)中,37 ℃、220 r·min-1振荡培养 24 h,测定发酵液上清中的抗凝血酶活力。
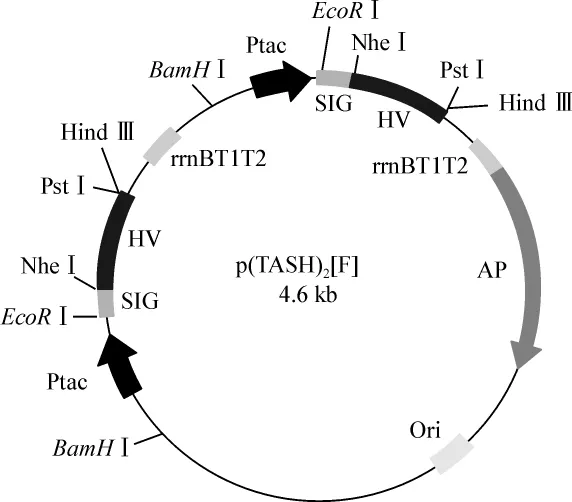
图2 正向插入质粒图谱Fig 2 Insertion of expression cassette in forward orientation
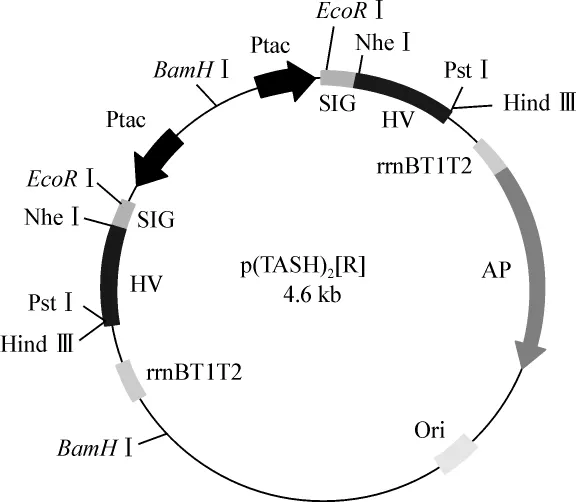
图3 反向插入质粒图谱Fig 3 Insertion of expression cassette in reverse orientation
水蛭素生物活性测定参照Markwardt的凝血酶滴定方法[6]进行:于酶标板小孔中加200 μl 0.5%牛血纤维蛋白原(50 mmol·L-1,pH7.4 的 Tris-cl配制),再加入10~100 μl水蛭素溶液,充分混匀。用微量进样器吸取标准的凝血酶溶液(生理盐水配制成100 IU·ml-1)进行滴定,每次滴定量为 5 μl(0.5 IU),时间间隔为1 min,若在1 min内纤维蛋白原发生凝固,说明已达到终点。由于水蛭素与凝血酶是1∶1结合,故每消耗一个凝血酶单位(IU)相当于一个抗凝血酶单位(ATU)。因此,可由凝血酶的消耗量换算出水蛭素的单位数。
2 结 果
2. 1 表达盒基因的扩增
2.1.1 菌落PCR筛选
以阳性转化子为模板,在25 μl反应体系中进行PCR反应:95℃ 5 min,进入循环反应(95℃ 30 s,55℃ 30 s,72℃ 2 min,反应30个循环),72℃延伸10 min。反应产物进行琼脂糖凝胶电泳检测(图4),可见大小约1.1 kb的片段,与目的基因大小相同。

图4 菌落PCR筛选阳性克隆Fig 4 Screening of positive clones by PCR
2.1.2 目的片段测序
从菌落PCR反应为阳性的克隆中挑选一个测序,测序反应由Invitrogen公司完成。双向测序验证显示序列正确(图5、6)。
2. 2 双表达盒菌种的构建
2.2.1 BamHⅠ酶切筛选含有双表达盒的阳性克隆
由于在新插入的表达盒两端均为BamHⅠ酶切位点,因此酶切后有1.1 kb大小片段的克隆即为双表达盒阳性克隆(图7)。由图7可见,所筛选的7、17、18以及20号菌均为含有双表达盒的阳性克隆。
2.2.2 EcoRⅠ酶切检验插入方向
用EcoRⅠ酶切法验证新插入的表达盒片段的插入方向。若为正向插入,可切出大小为1 162 bp的片段,若为反向插入,则可切出大小为462 bp的片段。在BamHⅠ酶切验证为阳性的4个克隆中,7、17、18号菌都为正向插入,而20号菌则为反向插入(图8)。

图5 正向测序图谱Fig 5 DNA sequencing analsis on p(TASH)2(forward)

图6 反向测序图谱Fig 6 DNA sequencing analsis on p(TASH)2(reverse)
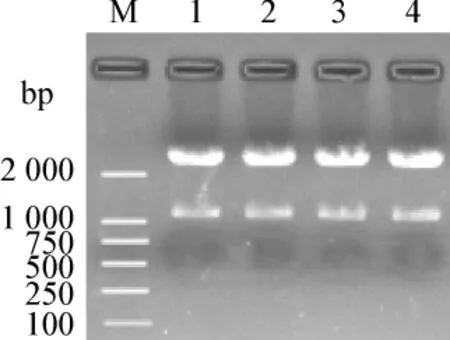
图7 BamHⅠ验证双表达盒阳性克隆Fig 7 Screening of clones with dual expression cassettes by BamHⅠ

图8 EcoRⅠ检验表达盒插入方向Fig 8 Insert trend detection of expression cassette by EcoRⅠ
2. 3 重组水蛭素Ⅲ的高效分泌表达
挑选双表达盒菌种p(TASH)2连续进行3批培养,同时以单表达盒菌种pTASH为对照,在同样条件下进行培养,分别检测重组水蛭素Ⅲ的表达水平。用Markwardt的凝血酶滴定方法测得活性数据如表1、2所示。
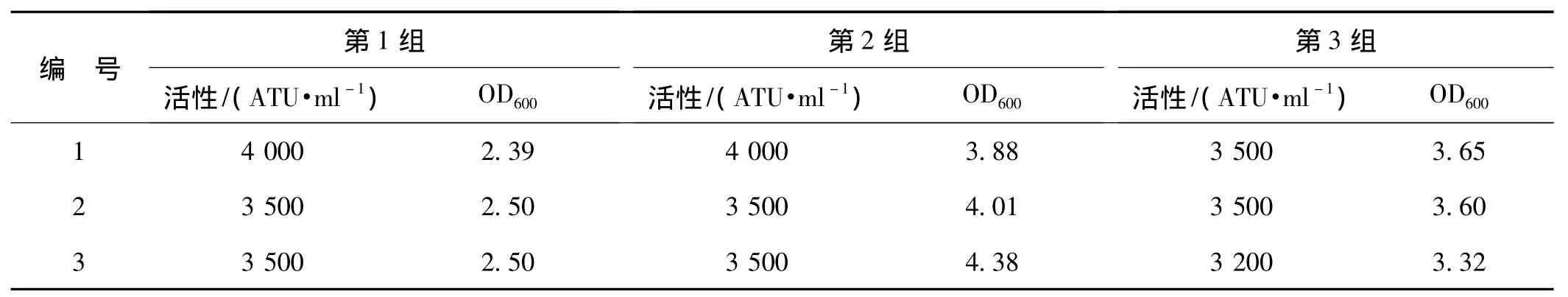
表13 组双表达盒菌种p(TASH)2活性测定Tab 1 Anti-thrombin activity of p(TASH)2
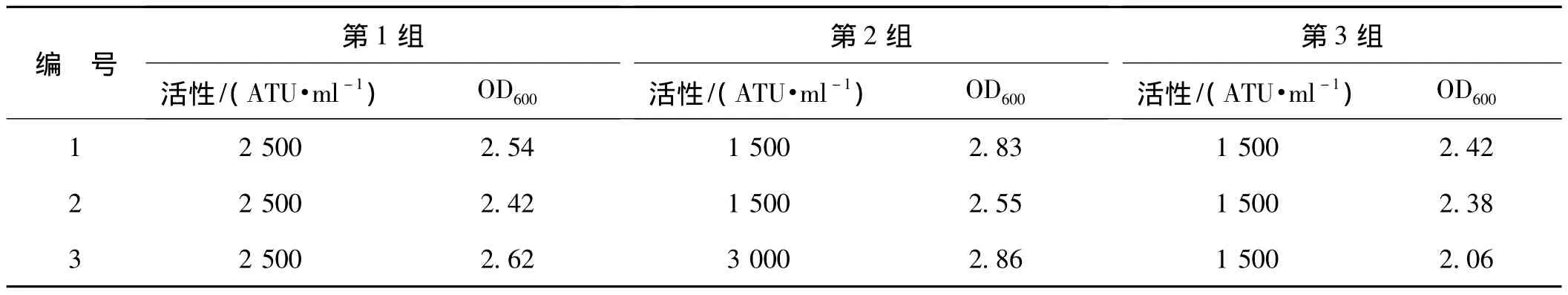
表2 3组单表达盒菌种pTASH活性测定Tab 2 Anti-thrombin activity of pTASH
将单表达盒菌种pTASH及双表达盒菌种p(TASH)2表达重组水蛭素的活性数据用Graph pad prism软件作图分析比较(图9),结果显示双表达盒菌种分泌表达重组水蛭素的抗凝血酶活性平均水平可达3500 ATU·ml-1,而单表达盒菌种表达重组水蛭素的抗凝血酶活性平均为2 000 ATU·ml-1。可见双表达盒菌种p(TASH)2的表达水平整体高于单表达盒菌种pTASH。

图9 双表达盒克隆p(TASH)2与单表达盒克隆pTASH分泌表达重组水蛭素Ⅲ水平比较Fig 9 Comparison of the anti-thrombin activity of rHirudinⅢsecreted by p(TASH)2and pTASH
经分析,双表达盒菌种p(TASH)2表达活性3组数据差异无统计学意义,组间P值为0.000 6,数据有意义,活性均值为 3 578 ATU·ml-1(表3)。

表3 双表达盒菌种p(TASH)2活性数据分析Tab 3 Analysis of activity data of p(TASH)2
3 讨 论
本研究在原大肠杆菌高效分泌表达系统的基础上,通过高保真PCR技术复制水蛭素基因表达盒单元,再将该表达盒单元与原质粒相连,形成具有两个串联表达盒单元的双表达盒质粒。该质粒转化大肠杆菌后,其摇瓶培养的上清液抗凝血酶活性可达3 500 ATU·ml-1,为单表达盒菌种的 1.75 倍。
崔莉等[7]采用正交实验法确定了水蛭素Ⅲ工程菌的较佳培养基组分(蛋白胨1%,酵母提取物0.5%,谷氨酸钠4%,麦芽汁10%),由于麦芽汁存放时间较短且批间差异较大,本次实验使用麦芽粉代替,确定了较合适的发酵培养基组分为蛋白胨1%,酵母提取物0.5%,谷氨酸钠4%,麦芽粉1%,并在培养基中添加了磷酸盐成分,以减少在大肠杆菌生长过程中pH值的变化对细菌的生长以及重组蛋白表达的不利影响。
摇瓶水平的培养已证实双表达盒p(TASH)2的分泌表达活性高于单表达盒pTASH,其生物反应器水平的表达量还需进一步验证。
[1]郑琳,郭长虹,马军,等.重组水蛭素研究进展[J].中医药学报,2007,35(8):59-60.
[2]谭树华,吴梧桐,刘景晶.新型大肠杆菌融合表达系统表达水蛭素Ⅲ基因研究[J].中国生化药物杂志,1999,20(1):10-12.
[3]TAN S H,WU W T,LIU J J,et al.Efficient expression and secretion of recombinant hirudin Ⅲ in E.coli using the L-asparaginase Ⅱ signal sequence[J].Protein Expr Purif,2002,25(3):430-436.
[4]RAY M V L,MEENAN C P,CONSALVO A P,et al.Production of salmon calcitonin by direct expression of a glycine-extended precursor in Escherichia coli[J].Protein Expr Purif,2002,26(2):249-259.
[5]王征,王捷,杨静,等.双表达盒人骨唾液酸蛋白毕赤酵母工程细胞构建[J].中国生化药物杂志,2005,26(5):264-269.
[6]MARKWARDT F.Hirudin as an inhibitor of thrombin[J].Methods in Enzymology,1970,19:9241.
[7]崔莉,谭树华,吴梧桐.重组水蛭素Ⅲ的工程菌的培养及高密度发酵[J].药物生物技术,2004,11(1):22-24.

