D-环修饰去氢表雄酮衍生物的合成与表征
汪心想,吴 亚,陶 燕,陶京朝
(1.河南省化工研究所有限责任公司,郑州 450052;2.郑州大学 化学系,郑州 450052;3.河南省中医学院 药学院,郑州 450008)
D-环修饰去氢表雄酮衍生物的合成与表征
汪心想1,吴 亚2,3,陶 燕2,陶京朝2
(1.河南省化工研究所有限责任公司,郑州 450052;2.郑州大学 化学系,郑州 450052;3.河南省中医学院 药学院,郑州 450008)
以去氢表雄酮(DHEA)为起始物,通过“一锅”多步反应,开发了一种在其D环上立体选择性地引入羟基、羟甲基和含醚键支链的简易合成方法;合成了3种新型DHEA衍生物,经IR,NMR,HRMS表征和晶体结构测定,确定了新化合物的结构和立体构型.
去氢表雄酮;D-环修饰;羟甲基化;“一锅”多步反应
甾体药物具有很强的抗感染、抗病毒和抗休克等药理作用,广泛用于治疗风湿病、心血管病、癌症、皮肤病等[1].甾体药物是仅次于抗生素的第二大类药物,它的发现及成功合成是近半个世纪以来医药工业取得最引人注目的两大进展之一.因甾体药物都含有一个相同的母核结构,在甾体分子结构上进行微小的改变就可能引起活性变化,如疗效增加、副作用减少、甾体药物作用的专属性变化等,从而创新出一个新的甾体药物,而这些改变了结构的甾体药物,在医疗上的应用范围日渐扩大[2].
去氢表雄酮(DHEA)是人体血液循环中最为丰富的甾体物质,主要以其硫酸酯(DHEA-S)的形式进入血液循环中,在相关外周组织中转化为雄激素或雌激素发挥间接生物学效应[3].近年国内外对DHEA和DHEA-S的基础与临床作用进行了大量的研究,DHEA的生物学作用不仅限于作为甾体激素前体,其在中枢神经与精神、免疫、代谢、骨质、心血管及血脂等方面也有独特作用[4].DHEA类甾体药物结构上的改性,主要集中在A环、D环C-17位置及母核的修饰与改造上,通过在D环的修饰改造,已合成出各种比其母体活性更强的甾体药物[5].在开发新型雄激素、雌激素、螺甾内酯、皮质激素及口服避孕药等甾体药物方面,DHEA因独特的结构较其它甾体原料有明显的优越性.因此,有效地在17-酮基甾体上接枝上碳原子侧链是开发以DHEA为原料合成甾体药物的关键所在,也是合成相关甾体药物的新途径[6].鉴于此,本工作开发了一种在DHEA的D环上立体选择性地引入羟基、羟甲基和含醚键支链的简单合成方法,通过“一锅”多步反应合成了4种结构新颖的DHEA衍生物,其中3种化合物未见文献报道.
1 实验的意外结果与讨论
在试图以去氢表雄酮1(DHEA)为原料,于乙醇钠的乙醇溶液中与甲醛进行羟醛缩合反应,合成16-羟甲基取代去氢表雄酮2的过程中,出乎意料地在此反应条件下,高收率(90%)和立体定向地得到了一种结构特殊的化合物3(图1).
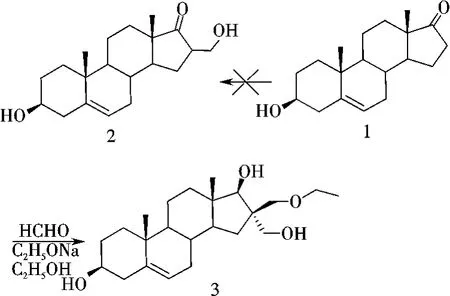
图1 化合物3的合成Figure 1 Synthesis of compound 3
从化合物3的红外光谱数据可以看出,17位羰基的伸缩振动吸收信号消失,3 478 cm-1处羟基的吸收信号明显增强,而且在1 126和1 098 cm-1处出现C—O—C键的信号.化合物3的核磁共振氢谱显示,在δ3.77-3.47范围内出现8个H的化学位移信号,应为与氧相连C上的氢,而且在δ1.19和δ3.54处出现了乙氧基的特征信号.另外其核磁共振碳谱也证实了羰基碳消失,同时增加了4个与氧原子相连的饱和碳信号.高分辨质谱显示其[M+H]+峰为379.284 5,可推测该化合物分子式为C23H38O4.根据起始化合物的结构特征和所用实验条件,可以初步确定化合物3中17-位羰基被还原成羟基,而且在其它位置有可能引入了羟甲基和乙氧基,但取代基的位置和构型尚无法确定.为了进一步证实产物的的结构、取代基位置和新形成部位的绝对构型,在乙酸乙酯中培养了化合物3的单晶,经X-射线单晶衍射分析确定了其绝对构型(图2).
从化合物3的晶体结构可以看出,正如以上推测的那样,17位的羰基被还原成羟基,16位同时引入了一个羟甲基和一个乙氧甲基.17位新生成的羟基与13位上的甲基及16位的乙氧基甲基互为顺式取向,而与16位的羟甲基互为反式取向.分子中其它部位的取代基均保持了DHEA原有的结构和构型.另外,化合物3的晶体结构表明,分子中C(16)和C(17)处形成了两个新的手性碳,其构型分别为S和R型.此结果与文献[7]报道的实验结果一致.
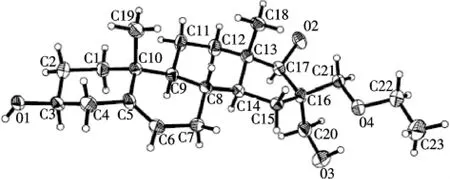
图2 化合物3的X-射线单晶衍射图Figure 2 Molecular structure of compound 3
根据实验条件,可以认为16位引入的乙氧甲基应该是由其中一个新生成的羟甲基与C2H5ONa/C2H5OH作用转化形成.可以设想,如果改变反应体系,用甲醇/甲醇钠代替乙醇/乙醇钠,就有可能得到相应的甲醚化产物.因此,以去氢表雄酮(DHEA)为原料,在甲醇钠的甲醇溶液中与甲醛反应,得到了相应的甲醚化产物4(图3).
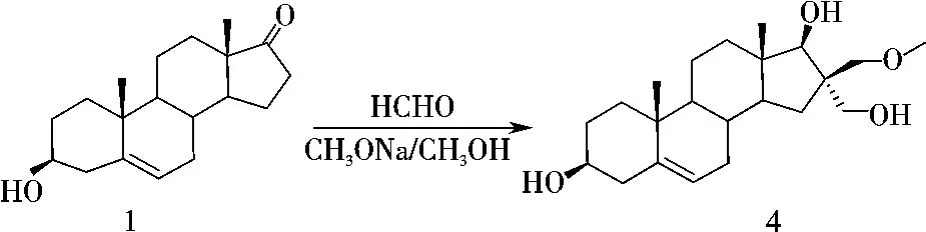
图3 化合物4的合成Figure 3 Synthesis of compound 4
从以上两个反应可看出,当DHEA在不同的醇/醇钠体系中与甲醛发生反应时,可经一锅多步反应得到相应的羟甲基醚化产物,从而为合成含醚键结构的化合物提供了简便的途径.另外,17位羰基还原形成的羟基和16位引入的羟甲基互为反式的实验事实表明,16位第二个羟甲基的引入和羰基的还原可能是协同进行的.基于上述分析,作者对这种“非正常反应”提出可能的反应机理见图4.
在前期工作[8]中发现,特殊结构的反式邻羟甲基环戊醇(反式的1,3二醇)在酸性条件下与丙酮作用,可以得到相应的邻烷氧甲基酮.上述合成的DHEA衍生物正好存在反式的1,3二醇结构,因此,作者分别以化合物3和4为起始物,浓硫酸作催化剂,在乙腈溶剂中与丙酮反应,成功地合成了化合物5和6(图5).
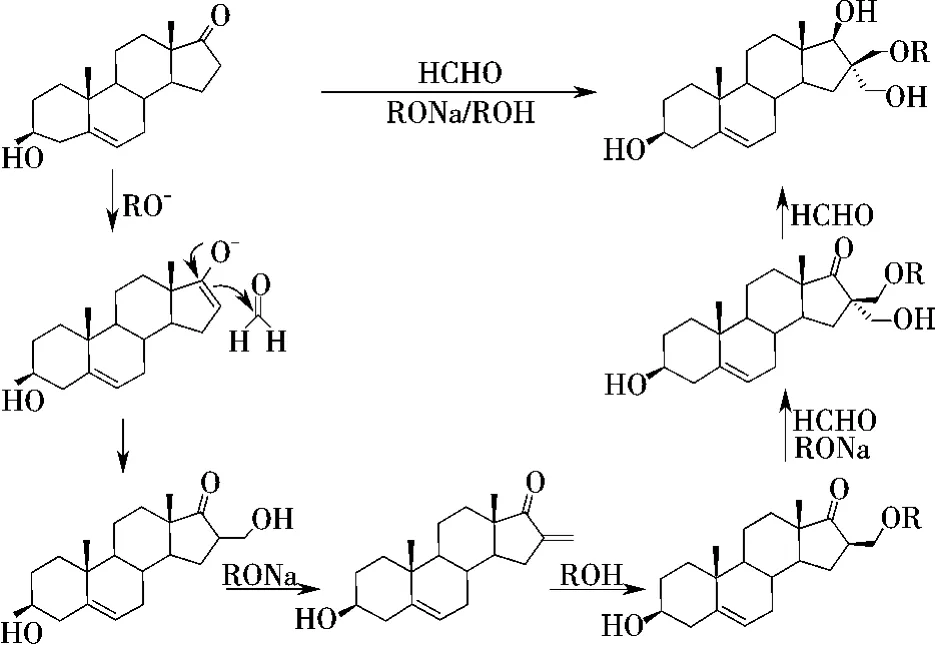
图4 化合物3,4合成的可能反应机理Figure 4 Proposed mechanism for synthesis of compound 3,4
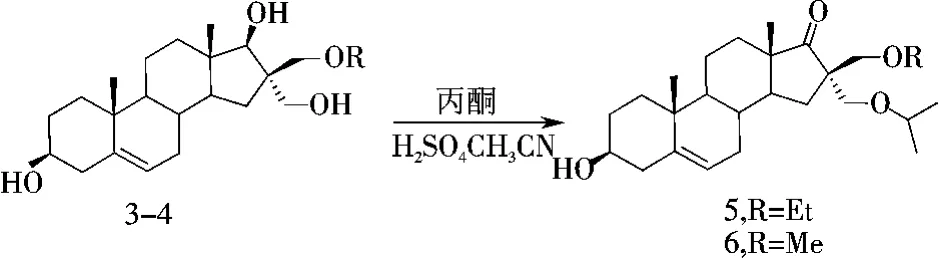
图5 化合物5-6的合成Figure 5 Synthesis of compound 5-6
从化合物5和6的红外光谱数据可以看出,在1 736 cm-1处附近出现羰基的强吸收峰,在1 110~1 250 cm-1处的C—O—C吸收峰进一步增强.其核磁共振氢谱中一个仲醇CH信号消失,但出现了异丙氧基的信号.其核磁共振碳谱显示,出现一羰基的信号(δ223.1),并且比原料多了3个碳峰.高分辨质谱测定其[M+H]+峰也分别与相应产物的分子量相符.由以上表征数据不难推测,反应物中17-羟基被氧化,16-羟甲基转化成相应的异丙醚化产物.
2 实验部分
2.1 主要试剂、仪器和一般测试条件
所用试剂和溶剂均为分析纯或化学纯.柱层析硅胶和薄层层析硅胶为青岛海洋化工厂生产.
熔点用XT5 A显微熔点测定仪测定,温度计未经校正.红外光谱用Thermo Nicolet IR200型红外光谱仪测定,KBr压片.核磁共振氢谱和碳谱用Bruker DPX 400(100 MHz)型超导核磁共振仪测定,TMS为内标.高分辨质谱用 Waters Micromass Q-Tof MicroTM高分辨质谱仪测定.X-射线单晶衍射使用日本Rigaku RAAXIS-IV面探仪测定.
2.2 化合物3的合成
加20 m L无水乙醇于50 m L三口烧瓶中,加入金属钠(0.4 g,1.7 mmol),反应完全后加入化合物1(0.288 g,1 mmol),在40℃油浴上搅拌5 min后,加入37%甲醛水溶液(0.2 m L).TLC跟踪反应进程,8 h后停止反应.旋蒸除去过量的乙醇,加入适量水,用氯仿萃取(30 m L×3).合并有机相,用饱和氯化钠水溶液洗涤(20 m L×2).有机相用无水硫酸镁干燥,过滤,浓缩,残余物经硅胶柱层析分离纯化(洗脱剂:V石油醚∶V乙酸乙酯=5∶1),得化合物3(0.34 g,90%).熔点:213~214℃.
IR(KBr):3 478,3 293,2 978,2 958,2 931,2 847,1 486,1 462,1 374,1 347,1 126,1 098,1 042,1 029,954,740,689 cm-1.1H NMR(400 MHz,CDCl3):δ5.33 (d,J= 5.2 Hz,1 H),3.77(d,J=8.8 Hz,1H),3.64(s,1H),3.58(t,J= 10.8 Hz,2H),3.54-3.47 (m,4 H),2.30-2.22(m,5H),1.94-1.82(m,4H),1.55-1.48(m,5 H),1.32 (q,J= 4.4 Hz,1 H),1.19(t,J= 7.2 Hz,3H),1.19-1.02 (m,2 H),1.01(s,3 H),1.00-0.88(m,1 H),0.86(s,3H).13C NMR (100 MHz,CDCl3):δ141.2,120.5,83.9,73.1,70.1,66.8,66.1,50.0,48.5,47.8,44.1,42.3,37.6,37.1,36.3,32.6,31.5,31.3,30.9,20.3,19.2,15.2,12.1.HRMS(ESI,m/z)calcd for C23H39O4[M+H]+379.284 8;Found:379.284 5.
2.3 化合物4的合成
合成方法同化合物3,收率89%.熔点:212~213℃.
IR(KBr):3 342,2 929,2 894,2 855,1 461,1 378,1 359,1 293,1 148,1 084,1 063,1 036,803,740,671,587 cm-1、1H NMR (400 MHz,CDCl3):δ5.33(d,J=5.2 Hz,1H),3.73(d,J=8.8 Hz,1 H),3.62(d,J=10.8 Hz,1 H),3.57(s,1H),3.55-3.49 (m,3H),3.37 (s,3 H),2.28-2.17 (m,2 H),1.93-1.82 (m,4H),1.75-1.45 (m,5H),1.37-1.03 (m,3 H),1.01(s,3 H),1.00-0.88(m,3 H),0.86(s,3H).13C NMR (100 MHz,CDCl3):δ141.4,120.6,83.7,75.4,70.1,66.6,58.9,50.1,48.6,47.9,44.2,42.4,37.6,37.1,36.4,33.0,31.6,31.4,31.0,20.3,19.3,12.3.HRMS(ESI,m/z)calcd for C22H36O4Na [M+Na]+387.251 1;Found:387.251 5.
2.4 化合物5的合成
称取化合物3(0.378 g,1.0 mmol)和丙酮(1.5 mmol)溶于10 m L乙腈中,搅拌至溶解,加入催化量的浓硫酸(0.1 mmol),室温搅拌,TLC监测反应进程.反应5 h后,减压蒸去乙腈.加入适量水,用氯仿萃取(20 m L×3).合并有机相,用饱和碳酸钠水溶液洗涤有机相(20 m L×2),再用饱和氯化钠水溶液洗涤(20 m L×2).有机相用无水硫酸镁干燥,过滤,浓缩,残余物经硅胶柱层析分离(洗脱剂:V石油醚∶V乙酸乙酯=7∶1),得无色粘稠物5(0.355 g,85%).
IR(KBr):3 448,2 971,2 933,2 896,2 864,1 736,1 666,1 457,1 374,1 335,1 298,1 225,1 117,1 086,1 009,938,832,811,593 cm-1.1H NMR(400 MHz,CDCl3):δ5.33(d,J=5.2 Hz,1H),3.54(m,1 H),3.47-3.39(m,4H),3.36(d,J= 8.8 Hz,2H),3.28 (d,J= 8.8 Hz,1 H),2.34-1.96(m,4 H),1.86-1.77(m,4H),1.68-1.45 (m,7H),1.31-1.22 (m,1 H),1.12(t,J=7.2 Hz,3H),1.09(d,J=6.4 Hz,3H),1.07(d,J=6.4 Hz,3H),1.04(s,3H),1.02-0.97 (m,1 H),0.93 (s,3 H).13C NMR (100 MHz,CDCl3):δ222.1,141.0,121.2,72.6,72.3,71.6,70.9,66.8,55.8,50.6,48.3,48.2,42.2,37.1,36.7,32.0,31.6,31.1,31.0,28.9,21.9,21.8,20.3,19.3,14.9,12.9.HRMS(ESI,m/z)calcd for C26H43O4[M+H]+419.3161;Found:419.317 2.
2.5 化合物6的合成
合成方法同化合物5,无色粘稠液体,收率83%.
IR(KBr):3 442,2 970,2 935,2 866,1 738,1 663,1 455,1 374,1 336,1 298,1 226,1 113,
1 085,1 011,936,835,810,595 cm-1.1H NMR(400 MHz,CDCl3):δ5.32 (d,J= 5.2 Hz,1 H),3.66(m,1 H),3.57(m,1 H),3.55-3.48(m,4H),3.40(s,3H),2.30-2.09(m,4H),1.94-1.85(m,4H),1.75-1.45(m,7H),1.32-1.23(m,1H),1.10(d,J= 6.4 Hz,3H),1.08(d,J=6.4 Hz,3H),1.05(s,3H),1.02-1.00(m,1H),0.95(s,3H);13C NMR (100 MHz,CDCl3):δ223.0,140.3,121.8,75.6,72.4,71.6,67.4,58.8,57.6,49.3,48.2,43.2,37.7,36.9,32.5,31.8,31.3,31.0,28.8,22.9,21.8,20.6,19.5,14.7,12.8.HRMS(ESI,m/z)calcd for C25H41O4[M + H]+405.292 7,Found:405.292 3.
[1] 仉文升,李安良.药物化学[M].北京:高等教育出版社,2001:415-451.
[2] Somdatta D,Kristiina W.Rapid synthesis of long chain fatty acid esters of steroids in ionic liquids with microwave irradiation:Expedient one-pot procedure for estradiol monoesters[J].Steroids,2010,75:740-744.
[3] 贾悦,王晓东.脱氢表雄酮的研究进展[J].国外医学,2003,24(4):174-177.
[4] 杨雄文,以AD/DHEA为原料甾体药物的合成及生物活性研究[D].天津:天津大学,2005.
[5] Mitchell H J,Dankulich W P,Hartman G D,et al.Design,synthesis,and biological evaluation of 16-substituted 4-azasteroids as tissue-selective androgen receptor modulators(SARMs)[J].J Med Chem.2009,52:4578-4581.
[6] 李合平,梁冬松,戴桂馥,等.7-羟基去氢表雄酮的合成与活性测定[J].中国药学杂志,2008,43(20):1596-1598.
[7] Vincze I W,Kovacs O,Deak A,et al.IX.Base-catalyzed reaction of androst-5-en-3-ol-17-one with formaldehyde[J].Journal Europeen des Steroides,1967,2(3):139-55.
[8] 吴亚.异斯特维醇衍生物的合成及活性研究[D].郑州:郑州大学,2009.
Synthesis and characterization of novel D-ring modified dehydroepiandrosterone derivatives
WANGXinxiang1,WUYa2,3,TAOYan2,TAOJingchao2
(1.Henan Research Institute of Chemistry and Engineering Co.Ltd.,Zhengzhou 450052,China;
2.Department of Chemistry,Zhengzhou University,Zhengzhou 450052,China;
3.School of Pharmacy,Henan College of Traditional Chinese Medicine,Zhengzhou 450008,China)
A novel and simple synthetic method for preparation of dehydroepiandrosterone(DHEA)derivativesviaan“one-pot”multistep reaction process was developed,by which a hydroxyl group,a hydroxymethyl and an alkyloxymethyl group can be simultaneously and stereoselectively introduced to the 16-an 17-positions in the D ring of DHEA.Three new DHEA derivatives were synthesized with the method,and characterized by IR,1H-NMR,13C NMR,HRMS as well as X-ray crystallographic analysis.
DHEA;D-ring modification;hydroxymethlation;“one-pot”multistepreaction
O623.7
A
1671-1114(2011)03-0080-04
2011-02-11
国家自然科学基金资助项目(20772113)
汪心想(1970—),男,高级工程师,主要从事有机化学和药物化学方面的研究.
陶京朝(1953—),男,教授,博士生导师,主要从事有机化学和超分子化学方面的研究.
(责任编校 纪翠荣)

