运动对骨骼肌线粒体去乙酰化酶3(SIRT 3)的影响
王海涛,刘玉倩,赵焕彬,赵 斌
运动对骨骼肌线粒体去乙酰化酶3(SIRT 3)的影响
王海涛,刘玉倩,赵焕彬,赵 斌
Sirtuins(SIRT)是NAD依赖的组蛋白去乙酰化酶,属于沉默信息调节因子家族,参与物质代谢及应激反应,与细胞寿命密切相关。Sirtuin 3(SIRT3)是哺乳动物线粒体中重要的去乙酰化酶,在骨骼肌中高表达,参与能量代谢并影响机体的衰老、细胞死亡和肿瘤发生。研究表明,适度运动会增加骨骼肌中的SIRT3含量并进一步影响脂肪代谢。目前,骨骼肌线粒体中SIRT3在运动中的变化引起学者的普遍关注。主要介绍了SIRT3的生理功能及运动对骨骼肌SIRT3的影响,深入研究运动中骨骼肌SIRT3的变化机制对运动抗衰老及运动防肥减肥具有重要的意义。
去乙酰化酶3;运动;线粒体;骨骼肌
Sirtuins(SIRT)是烟酰胺腺嘌呤二核苷酸(nicotimide adenosine dinucleotide,NAD)依赖的组蛋白去乙酰化酶,属于沉默信息调节因子2(silent information regulator 2,SIR2)家族,是第一个被定位在哺乳动物细胞线粒体的去乙酰化酶[12]。SIR2是一种高度保守,具有依赖性的组蛋白去乙酰基转移酶,调控酵母、蠕虫和果蝇的生命周期和哺乳动物的应激反应[13]。由于SIRT基因家族参与物质代谢及应激反应,与细胞寿命密切相关,引起研究者的极大兴趣,有学者称其为“长寿基因”。《Nature》近两年报道了多篇关于SIRT基因家族的研究[4,10]。近年研究发现,SIRT3位于线粒体基质,调节线粒体代谢酶的乙酰化水平,在细胞凋亡及细胞内的信号转导中发挥重要作用,参与调节线粒体代谢和能量产生,与适度运动和热量限制引起的生理适应密切相关[15,10]。因此,关于运动中SIRT3的变化,尤其是骨骼肌线粒体中SIRT3在运动中的变化引起学者的普遍关注。本文主要介绍了SIRT3的生理功能及运动对骨骼肌SIRT3的影响,深入研究运动对骨骼肌线粒体SIRT3的影响对阐明运动抗衰老及运动防肥、减肥的作用机制具有意义。
1 SIRT3的概述及其影响因素
1.1 SIRT3的分布
Sirtuins(SIRT)是NAD(+)依赖的组蛋白去乙酰化酶,调节细菌和哺乳动物的基因沉默和能量代谢及衰老进程,目前发现哺乳动物的SIRT基因家族有7个类型(SIRT1-7)[4,13,31],这7种SIRT在细胞内的分布和功能各不相同。SIRT1存在于常染色质,SIRT6存在于异染色质,SIRT7存在于核仁[31],SIRT2存在于胞浆中,SIRT3、SIRT4和SIRT5位于线粒体基质中[32]。SIRT1是研究最广泛的,调节葡萄糖和脂肪代谢。SIRT1可与p53相互作用并使其去乙酰化,抑制p53的转录活性及其介导的氧化应激和DNA损伤并提高细胞存活率[9]。SIRT3、SIRT4和SIRT5是线粒体的去乙酰化酶,它们是机体能量代谢的传感器,通过调节蛋白的脱乙酰作用或ADP核糖基化而调节代谢酶的活性[12]。SIRT4通过调节谷氨酸脱氢酶活性而调节胰岛素分泌,SIRT5参与了尿素循环[22]。SIRT3分布非常广泛,在脑、肝脏、脾脏、睾丸、骨骼肌、肾脏、心脏、胸腺、肺、骨髓、子宫和卵巢等器官中均检测到SIRT3 mRNA的表达,在物质代谢活跃的组织如肌肉、肝脏、肾脏和心脏中高表达[15]。SIRT3通过控制关键的代谢酶的脱乙酰作用而参与尿素循环、ATP合成及脂肪酸的有氧氧化过程,是线粒体中强大的脱乙酰酶,在基因保护、能量代谢、细胞存活及延长寿命中发挥重要作用[30]。
1.2 SIRT3的作用
骨骼肌线粒体基质中SIRT3表达量较高,能有效调节骨骼肌细胞的衰老与能量代谢。SIRT3在慢肌纤维的表达量明显高于快肌纤维[23]。全长的SIRT3在线粒体基质中没有活性,当其氨基端部分被线粒体水解酶切割后具有组蛋白的去乙酰化酶活性,从而参与线粒体能量代谢酶活性的调控。SIRT3可以调节乙酰-CoA合成酶2(acetyl-CoA synthetase,AceCS2)的活性,在禁食情况下促进外周组织对乙酸的利用[29]。同时,Hallow s等人(2006)也报道SIRT3对AceCS2的去乙酰化作用激活了其活性[9]。SIRT3在调节和保持机体ATP水平方面发挥重要作用,缺乏SIRT3基因的小鼠,心脏、肾和肝的安静ATP水平下降了50%以上[1,24]。与SIRT4和SIRT5基因敲除的小鼠相比,SIRT3基因敲除的小鼠肝脏中的线粒体蛋白有较高的乙酰化水平,说明线粒体中SIRT3具有较强的脱乙酰酶活性。SIRT3调节线粒体的机能,它的高表达可提高线粒体的呼吸作用,降低活性氧(ROS)的生成产物。SIRT3可通过提高线粒体MnSOD的活性而抑制肿瘤细胞的生长。缺乏SIRT3会导致线粒体ROS增加,从而加速细胞转化及肿瘤细胞的生长[25,26]。SIRT3基因敲除的小鼠胚胎纤维原细胞表现出线粒体功能异常、应激诱发的过氧化损伤加剧、基因不稳定等特征[16]。心肌中的SIRT3可阻止心肌细胞肥大的发生,保护心肌细胞免于发生过氧化损伤[24]。骨骼肌中的SIRT3成为重要的疾病诊断指标和药物作用靶点而影响人类的健康和寿命。
1.3 SIRT3的影响因素
年龄、运动、温度、饮食等外界刺激因素均能改变SIRT3的表达。对不同年龄人群的检测发现,胎儿脑内SIRT3 m RNA的表达量高于成年人,而老年人SIRT3表达量低。在骨骼肌中,随年龄增长SIRT3表达也呈现逐渐下降的趋势,而且由于缺乏运动的人能量输出少,也表现为骨骼肌中SIRT3表达下降,而通过运动锻炼可以逆转SIRT3随年龄而下降的情况[19]。SIRT3可被寒冷刺激诱导并在棕色脂肪组织中表达。Shi等(2005)研究表明,冷暴露会增加小鼠棕色脂肪SIRT3 mRNA水平[28],SIRT3的脱乙酰基酶活性需要解偶联蛋白1(uncoupling protein, UCP-1)的诱导。限制饮食动物的肝脏和棕色脂肪组织中SIRT3表达量上升。而高脂膳食则引起骨骼肌SIRT3表达降低[10]。
1.4 SIRT3的作用机制
目前,关于SIRT3的作用途径许多学者做了相关研究。Shi等(2010)的研究认为,SIRT3通过激活人肝细胞系(HepG2)腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)而减少脂肪在肝脏中的积累[27]。在骨骼肌, AMPK作为机体能量监测器,能够通过磷酸化激活过氧化物酶体增殖物激活受体γ(Peroxisome p roliferator-activated receptor-γ,PPARγ)辅助激活因子1α(coactivator-1α,PGC-1α)。因此,AMPK也是肌肉能量代谢的感受器和调节器。PGC-1α是近年发现的一种新型辅助转录激活因子,其与棕色脂肪细胞的分化及其生理功能关系密切。PGC-1α以辅转录激活因子身份发挥生理作用,可与PPARγ受体、甲状腺素受体、核呼吸因子、线粒体转录激活因子、肌细胞增强子等结合后产生生物协同效应,启动相关靶基因表达,促进机体适应性产热、脂肪酸β氧化、肌肉中葡萄糖的转运、骨骼肌肌纤维类型转化和肝糖原异生。因此,PGC-1α在代谢调节中起着多重作用,它可刺激线粒体发生,诱导肌纤维类型的改变,增加骨骼肌细胞的有氧氧化能力。PGC-1α主要在心脏、肌肉、肾脏和棕色脂肪(Brow n adipose tissue,BAT)等能量消耗较大的组织中表达,而在白色脂肪组织(White adipose tissue,WAT)中表达较低[23,25]。此外, SIRT3也可通过激活环腺苷酸应答元件结合蛋白(CREB),这一经典的核内转录因子,而响应外界的信号,启动下游基因的转录。研究表明,SIRT3敲除的小鼠, AMPK和CREB磷酸化程度降低,PGC-1α表达下降,说明在SIRT3介导的生物信号中,AMPK和CREB、PGC-1α发挥重要作用。Palacios等2009年提出了骨骼肌细胞SIRT3的调控示意图[23](图1)。
运动、高脂膳食、热量限制(caloric restriction,CR)及禁食(Fasting)等外界刺激可通过SIRT3激活AMPK(腺苷酸活化蛋白激酶)和PGC-1α(PPARγ辅助激活因子1α)途径而影响肌肉能量代谢的动态平衡。SIRT3可能通过AceCS2(乙酰-CoA合成酶2)和泛醌细胞色素C还原酶铰链蛋白(Ubiquinol-cytochrome C reductase hinge protein, UQCRH)及ATP等作用于AMPK,间接作用于PGC-1α。SIRT3可刺激CREB磷酸化直接激活PGC-1α。当然,目前有人也提出SIRT3是PGC-1α的下游目的基因,介导PGC-1α对细胞ROS产生及线粒体发生中的作用[17]。
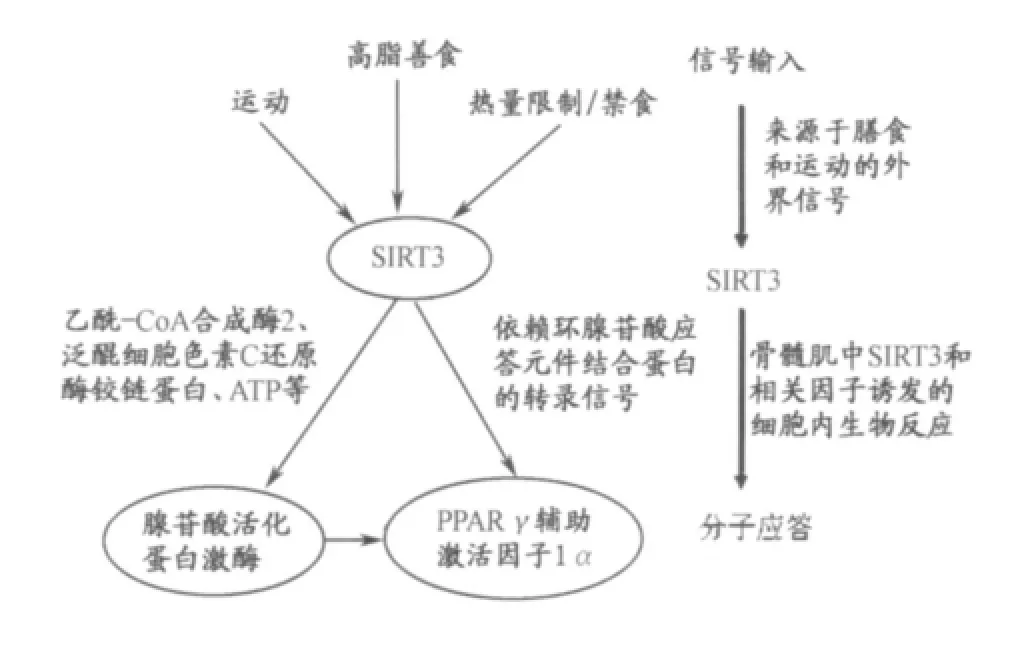
图1 骨骼肌细胞SIRT3的调控示意图Figure 1. Schematic Diagram of Potential SIRT3 Action in the Skeletal M yocyte[23]
2 运动对骨骼肌SIRT3的影响及调节机制
2.1 运动对骨骼肌SIRT3的影响
运动中机体对能量的需求量增加,因此,运动会影响骨骼肌SIRT3的表达量,而且,不同强度的运动对骨骼肌SIRT3的表达量影响是有差别的,不同性别在运动后SIRT3的表达量也存在差别。近年来多项研究表明,适度的运动可有效提高骨骼肌中SIRT3的表达。Palacios等(2009)报道,转笼训练使小鼠小腿三头肌SIRT3表达量增加,而雌性小鼠增加幅度高于雄性小鼠。跑台训练也使小鼠腓肠肌SIRT3表达量增加,即使只有1周的训练,也会引起类似的结果[23]。肌肉的收缩活动会刺激大鼠骨骼肌SIRT3蛋白的表达[11]。雄性大鼠以20 m/min、60 min/ day,7天/周进行了4周跑台运动,由于SIRT3在以有氧氧化供能为主的慢肌中高表达,结果其比目鱼肌和跖肌中SIRT3的表达分别增加了49%和41%,安静组大鼠由于维持正常姿势需要募集比目鱼肌,因此,其比目鱼肌中SIRT3和细胞内NAD生物合成的限速酶(nicotinamide phospho ribosyltransferase,Nampt)蛋白表达量都比跖肌和小腿三头肌高,而SIRT3在固定腿的比目鱼肌中含量低于对侧的肌肉[11]。久坐的老年人SIRT3表达量低,而耐力训练可以增加SIRT3的表达[19]。运动训练会增加SIRT3的表达,CREB磷酸化和PGC-1α表达增强,这也说明存在图1的调控通路。24名游泳运动员(15名男性,9名女性)参加了1 h运动强度为75%~80%的最大吸氧量的游泳运动,结果男性淋巴细胞谷胱甘肽过氧化物酶的活性在运动后显著增加。PGC-1α与SIRT3含量和过氧化氢酶活性正相关。这可能是由于运动引起了嗜中性粒细胞的过氧化损伤,诱发了淋巴细胞抗氧化的防御功能,在运动诱发的淋巴细胞的适应性反应中PGC-1α和SIRT3是关键的调节因素。女性嗜中性粒细胞和淋巴细胞对运动的反应稍弱于男性[6]。而长时间大强度的运动则会降低SIRT3的表达。Marfe等(2010)发现,16名男性长跑业余爱好者在马拉松运动后Mn-SOD、Cu-ZnSOD、诱导型NOS(Inducible Nitric-Oxide Synthase,iNOS)和SIRT1的表达增加了,而SIRT3和SIRT4的表达显著下降,SIRT3 m RNA表达量降低[21]。过表达SIRT3或PGC-1α在小鼠骨骼肌细胞系(C2C12)会降低ROS水平,而敲除SIRT3会增加ROS水平,并阻碍了PGC-1α对ROS产生的抑制作用[17]。
也有研究报道,在人体骨骼肌中运动诱导的线粒体发生与SIRT1活性提高有关。6周的高强度间歇训练(90%最大吸氧量,每次4 min,休息2 min,共进行10组,3天/周)增加了线粒体能量代谢酶(柠檬酸合成酶、辅酶A脱氢酶和细胞色素C氧化酶)的活性,PGC-1α蛋白在训练4天后增加了16%,总的肌肉SIRT1活性提高31%[8]。SIRT3和SIRT1会通过PGC-1α促进线粒体发生和脂肪酸的有氧氧化,但具体途径有差别。SIRT3促进PGC-1α的表达,而SIRT1通过脱乙酰作用激活PGC-1α[7]。在外界信号刺激下,在不同组织中SIRT3和SIRT1是如何起作用的,目前尚不清楚。
2.2 运动对SIRT3的调节机制
在不同强度的运动中,SIRT3出现了不同的变化,关于运动对SIRT3的调节机制提出了一些假说,但均有待进一步证实。NO可能是SIRT3的上游调控因子。研究表明,iNOS基因敲除的小鼠PPARγ辅助激活因子1α(PGC-1α)m RNA表达量增加,同时,SIRT1和SIRT3表达增加[2]。已有研究表明,运动可影响机体NOS的活性,进而改变NO含量,但在不同强度运动中机体是如何通过NO调控SIRT3表达还不明确。还有研究表明,适度运动引起SIRT3表达增加,可能与运动增强机体对抗自由基的能力有关。因为发现有些植物提取物如白藜芦醇可促进SIRT3的表达,与降低自由基损伤有关[5]。运动是否通过调控自由基表达而改变SIRT3的含量,有待进一步研究。
3 研究展望
关于运动中SIRT3的变化,虽然目前有一些研究报道,但其具体的调节通路还有待进一步证实。此外,SIRT催化剂和抑制剂的研究更能为深入探讨其在运动适应、肿瘤、代谢疾病,心血管疾病和神经退行性疾病方面的作用提供依据[2]。对小鼠C2C12骨骼肌细胞系的研究表明,在SIRT的N 1位存在着重要的维持其活性的结构[20]。此外,SIRT3的小分子催化剂目前正在研究中[19]。SIRT3在骨骼肌和其他组织中的过表达可进一步说明其作用,这也许会成为人类对抗2型糖尿病或其他代谢性疾病及乳腺癌(SIRT3表达异常)的方法。Sirtuins的过表达与帕金森氏症、某些类型的癌症有关,而抑制剂可通过抑制肿瘤生长和促进细胞凋亡用来治疗癌症[18]。静息状态下骨骼肌70%的能量来源于脂肪的分解代谢,因此,骨骼肌中SIRT3的表达对脂肪代谢具有重要影响[30]。这也许能为各种普遍发生的疾病提供新的关键的治疗途径,模仿运动或/和热量限制引起的人体有益的分子适应。因此,研究肌肉中SIRT3如何进行能量代谢的调控及运动对SIRT3的影响将有助于更好地理解运动延缓衰老及运动防肥、减肥的机制。
[1]AHN B H,KIM H S,SONG S,et al.A role for the mitochondrial deacetylase Sirt3 in regulating energy homeostasis[J].Proc Natl Acad Sci USA,2008,105(38):14447-14452.
[2]BALCERCZYK A,PIROLA L.Therapeutic potential of activators and inhibitors of sirtuins[J].Biofactors,2010,36(5):383-393.
[3]BECERRIL S,RODRÍGUEZ A,CA TALÁN V,et al.Deletion of inducible nitric-oxide synthase in lep tin-deficient mice improves brown adipose tissue function[J].PLoS One,2010,5(6): e10962.
[4]DANGW,STEFFEN K K,PERRY R,et al.Histone H4 lysine 16 acetylation regulates cellular lifespan[J].Nature,2009,459 (7248):802-807.
[5]DAS D K,M U KHERJEE S,RA Y D.Resveratrol and red w ine, healthy heart and longevity[J].Heart Fail Rev,2010,15(5): 467-77.
[6]FERRER M D,TAULER P,SUREDA A,et al.Antioxidant regulatory mechanisms in neutrophils and lymphocytes after intense exercise[J].J Spo rts Sci,2009,27(1):49-58.
[7]GERHART-H IN ES Z,RODGERSJ T,BAREO,et al.M etabolic control of muscle mitochondrial function and fatty acid oxidation through SIRT1/PGC-1alpha[J].Embo J,2007,26(7):1913-1923.
[8]GURD B J,PERRY C G,HEIGENHAUSER GJ,et al.High-intensity interval training increases SIRT1 activity in human skeletal muscle[J].App l Physiol Nutr M etab,2010,35(3):350-357.
[9]HALLOWSW C,LEE S,DENU J M.Sirtuins deacetylate and activatemammalian acetyl-CoA synthetases[J].Proc Natl Acad Sci U S A,2006,103(27):10230-20235.
[10]H IRSCHEYM D,SH IMAZU T,GOETZMAN E,et al.SIRT3 regulatesmitochondrial fatty-acid oxidation by reversible enzyme deacetylation[J].Nature,2010,464(7285):121-125.
[11]HOKARI F,KAWASA KIE,SAKA IA,et al.M uscle contractile activity regulates Sirt3 p rotein expression in rat skeletal muscles[J].J Appl Physio l,2010,109(2):332-340.
[12]HUANG J Y,H IRSCHEY M D,SH IMAZU T,et al.Mitochondrial sirtuins[J].Biochim Biophys Acta,2010,1804(8): 1645-1651.
[13]IMA IS,ARMSTRONG C M,KAEBERLEIN M,et al.Transcriptional silencing and longevity p rotein Sir2 is an NAD-dependen t histone deacetylase[J].Natu re,2000,403(6771):795-800.
[14]JIN L,GALONEK H,LSRAEL IAN K,et al.Biochemical characterization,localization,and tissue distribution of the longer form of mouse SIRT3[J].Protein Sci,2009,18(3):514-525.
[15]JIN L,WEIW,JIANG Y,et al.Crystal structures of human SIRT3 displaying substrate-induced conformational changes [J].JBiol Chem,2009,284(36):24394-24405.
[16]KIM H S,PA TEL K,MULDOON-JACOBS K,et al.SIRT3 is a m itochondria-localized tumo r supp resso r required fo r m aintenance of mitochondrial integrity and metabolism during stress [J].Cancer Cell,2010,17(1):41-52.
[17]KONG X,WANG R,XUE Y,et al.Sirtuin 3,a new target of PGC-1alpha,plays an important role in the suppression of ROS and mitochondrial biogenesis[J].PLoS One,2010,5(7): e11707.
[18]KUCI SKA M,PIOTROWSKA H,MURIASM.Sirtuins-modulation of their activity as a novel therapeutic target[J].Pol M erkur Lekarski,2010,28(165):231-235.
[19]LANZA IR,SHORTD K,SHORT K R,et al.Endurance exercise as a countermeasure for aging[J].Diabetes,2008,57 (11):2933-2942.
[20]MA IA,VALENTE S,M EADE S,et al.Study of 1,4-dihydropyridine structural scaffold:discovery of novel sirtuin activators and inhibito rs[J].J M ed Chem,2009,52(17):5496-5504.
[21]MARFE G,TAFAN IM,PUCCIB,et al.The effect of marathon on mRNA expression of anti-apoptotic and p ro-apoptotic p roteins and sirtuins family in male recreational long-distance runners[J].BMC Physiol,2010,10(1):7.
[22]NAKAGAWA T,LOMB D J,HA IGIS M C,et al.SIRT5 deacetylates carbamoyl phosphate synthetase 1 and regulates the urea cycle[J].Cell,2009,137(3):560-570.
[23]PALACIOSO M,CARMONA J J,M ICHAN S,et al.Diet and exercise signals regulate SIRT3 and activate AM PK and PGC-1alpha in skeletal m uscle[J].Aging(A lbany N Y),2009,1(9): 771-783.
[24]PILLA I V B,SUNDARESAN N R,JEEVANANDAM V,et al.M itochondrial SIRT3 and heart disease[J].Cardiovasc Res, 2010,88(2):250-256.
[25]RAFFAELLO A,RIZZU TO R.M itochondrial longevity pathways[J].Biochim Biophys Acta,2010,12:Epub ahead of p rint.
[26]SCHUMACKER PT.A tumor supp resso r SIRTainty[J].Cancer Cell,2010,17(1):5-6.
[27]SH IT,FAN GQ,XIAO SD.SIRT3 reduces lipid accumulation via AM PK activation in human hepatic cells[J].J Dig Dis, 2010,11(1):55-62.
[28]SH I T,WANG F,STIEREN E,et al.SIRT3,a mitochondrial sirtuin deacetylase,regulates mitochondrial function and thermogenesis in brown adipocytes[J].J Biol Chem,2005,280 (14):13560-13567.
[29]SH IMAZU T,H IRSCHEY M D,HUANG J Y,et al.Acetate metabolism and aging:an emerging connection[J].Mech Ageing Dev,2010,131(7-8):511-516.
[30]SM ITH B C,SETTLESB,HALLOWSW C,et al.SIRT3 substrate specificity determined by peptide arrays and machine learning[J].ACSChem Biol,2010,14:Epub ahead of print.
[31]VAKHRUSHEVA O,BRAEUER D,L IU Z,et al.Sirt7-dependent inhibition of cell grow th and proliferation might be instrumental to mediate tissue integrity during aging[J].J Physiol Pharmacol,2008,59(S9):201-212.
[32]VERD IN E,H IRSCHEY MD,FINLEY LW,et al.Sirtuin regulation of mitochondria:energy production,apoptosis,and signaling[J].Trends Biochem Sci,2010,35(12):669-675.
Effects of Exercise on SIRT 3 in M itochondria of Skeletal M uscle
WANG Hai-tao,L IU Yu-qian,ZHAO Huan-bin,ZHAO Bin
Sirtuins belongs to the family of the silent info rmation regulator 2 p roteins(SIR2) that p lay a critical role in transcrip tional silencing.Sirtuins act as metabolic senso rs and influence metabolic adaptation but also many o ther processes such as stress response mechanism s, gene exp ression,and organismal aging.Sirtuin 3(SIRT3)is a majo r mitochondrial deacetylases and plays impo rtant roles in regulating mitochondrial metabolism and energy p roduction and has been linked to the beneficial effects of exercise and calo ric restriction.The result show s that moderate exercise can increase the content of SIRT3 and further affect the adipose metabolism.A t the p resent,the effect of exercise on SIRT3 in mitochondria of skeletal muscle has draw n the attention of researchers.This paper summarizes the physiological function of SIRT3 and the effects of exercise on SIRT3 in m itochondria of skeletal muscle,w hich has impo rtant significance to investigate the regulatory mechanism of SIRT3 during exercise.
sirtuin3(SIRT3);exercise;m itochondria;skeletalm uscle
G804.5
A
1000-677X(2011)01-0085-04
2010-11-03;
2010-12-18
国家自然基金资助项目(30700390);河北省自然基金资助项目(C2009000291);河北省教育厅资助项目(Z2008119)。
王海涛(1973-),男,河北廊坊人,副教授,博士,主要研究方向为运动与骨骼肌,Tel:(0311)80787711,E-mail:haitaoyq@126.com;刘玉倩(1973-),女,河北保定人,教授,博士,硕士研究生导师,主要研究方向为运动与铁代谢, Tel:(0311)85202256,E-mail:yuqianht@126.com。
河北师范大学体育学院,河北石家庄050024
Hebei Normal University,Shijiazhuang 050024,China.

