微波辅助高价锰还原浸出动力学研究
陶长元,孙大贵,刘作华,杜 军,刘仁龙
(重庆大学化学化工学院,重庆 400030)
0 前言
传统软锰矿生产电解金属锰需先经高温炭还原成一氧化锰,经与硫酸反应得到硫酸锰合格液后,电解而成金属锰。虽然煤还原焙烧过程简单,但能耗高,且产生SO2、粉尘等环境污染物。而湿法工艺条件温和、工艺简单、污染小,是有应用前景的生产工艺。湿法还原浸锰的关键是寻找一种廉价、高效的还原剂。已报道的还原剂有硫酸亚铁[1]、SO2[2]、葡萄糖[3~5]、蔗糖[6]、纤维素[7]、锯末[8]、废糖蜜[9]等。为强化矿石的浸取过程,微波助浸的报道不断增多[10~11],而微波在软锰矿浸出中的应用还鲜有报道。本文以葡萄糖为还原剂,研究微波辐射下还原浸出软锰矿的动力学行为。鉴于各地软锰矿矿源不同,成分、性质有较大差异,实验选取 EMD为研究对象,对其浸出实验结果与实际氧化锰矿的浸出实验结果进行了比较。
1 实验
1.1 实验材料及仪器
矿石采集自重庆某地,矿样粒度为70%过178 μm(80目筛),锰矿石主要化学成分列在表1。EMD由遵义双源化工提供,主要成分列在表2。

表1 锰矿的主要化学成分(wt%)
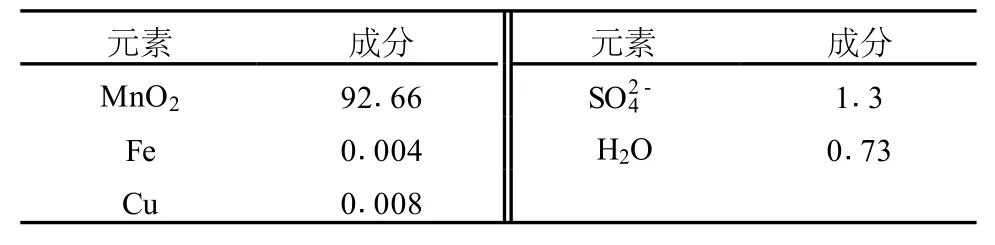
表2 EMD的主要化学成分(wt%)
图1是矿石及浸出后残渣的XRD图,测试条件 :Co-Kα射线 ,波长 0.178 89 nm,扫描范围 5(°)~90(°)(2θ)。锰矿的矿物学分析表明,主要的金属矿物包括软锰矿(MnO2),赤铁矿(Fe2O3)和磷镁铝矿[M gAl2(PO4)2(OH)2·8H2O],脉石矿物主要是二氧化硅(SiO2)和珍珠石[Al2Si2O5(OH)4]。

a 浸出前;b 化学浸出后
实验用微波反应器为北京祥鹄公司生产XH100-A,X衍射仪为日本理光D/MAX-IIIC,X荧光衍射仪为美国Innov-X systems Corporation公司生产Alpha 4000。化学试剂硫酸、葡萄糖等均为分析纯。
1.2 实验方法及原理
称取一定量的锰矿粉,按比例加入 EMD和稀硫酸,置于微波反应器中,开启磁力搅拌,在设定的温度和微波功率下反应一定时间后取样分析。葡萄糖还原MnO2的总反应方程式如下:

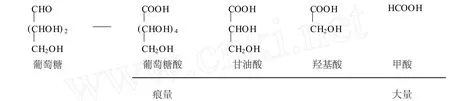
Furlani G[12]等通过 HPLC对反应产物进行了研究,证明反应是一个C链逐渐变短的过程,主要成分为甲酸,具体机理如下:
浸出液中锰测定采用国标方法 GB/T 1506-2002。
2 结果与讨论
浸出过程是一个复杂的多相(固—液或气—固—液)反应过程,宏观上是由反应剂的扩散、界面反应和生成物的扩散等多个单元过程构成。浸出过程的速率可由化学反应控制、扩散控制和混合控制3种基本速率控制步骤[13~14]。矿石浸出的速率过程,常用速率模型进行描述。在矿石颗粒浸出中,已发展出几个简单的反应速率过程模型及其速率表达式,这些典型动力学的表达式为:
化学反应控制时:

扩散控制时:

式中X——浸出率;
K——速率常数;
T——时间。
得到动力学模型的过程是:将反应时间和对应的浸出率带入模型进行拟合,如果模型中的浸出率函数y与时间函数x成线性关系,可以认为浸出过程属于该模型。
2.1 葡萄糖还原浸出EMD动力学
微波功率800 W,C6H12O6/EMD质量比1∶1,H2SO4/MnO2摩尔比2∶1,H2SO4浓度1 M。在温度313~343 K的范围内,得到不同温度下锰浸出率与时间的关系,结果见图2。进一步通过线性拟合,得到图3,1-(1-X)1/3~T的关系。

图2 反应温度对EMD浸出率的影响
从图2中可以看出,随温度的上升,反应的速率加快,在343 K反应40 min,锰浸出率达97.7%,而在313 K时,相同时间锰浸出率只有31.4%。由于EMD与葡萄糖反应无固体生成物生成。浸出过程控制步骤为化学反应步骤。

图3 EMD浸出动力学曲线
2.2 葡萄糖还原浸出软锰矿动力学
微波功率800 W,C6H12O6/锰矿质量比0.5,H2SO4/MnO2摩尔比2∶1,H2SO4浓度1 M。在温度323~363 K的范围内,得到不同温度下锰浸出率与时间的关系,结果见图4。

图4 温度对软锰矿浸出率的影响
进一步通过线性拟合,得到图5,1-(2/3)X-(1-X)2/3~T的关系图。
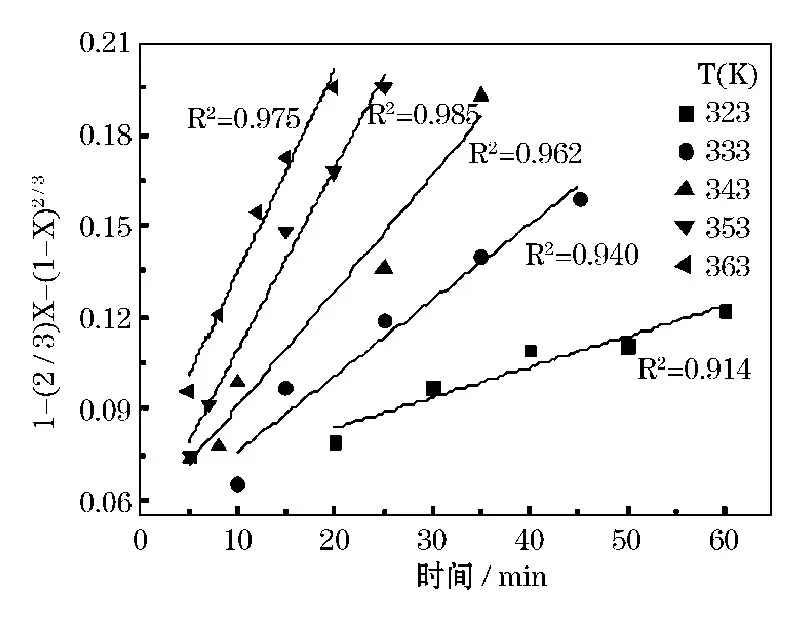
图5 软锰矿浸出动力学曲线
由图5得到不同温度下浸出反应速率的动力学方程列于表3。

表3 不同温度浸出反应的动力学方程
图5中拟合直线的斜率就是该温度下反应速率常数,将反应速率常数 k带入A rrhenius方程,得到浸出反应的表观活化能 E。

式中 A——频率因子,以lg k对1 000/T作图,结果见图6。
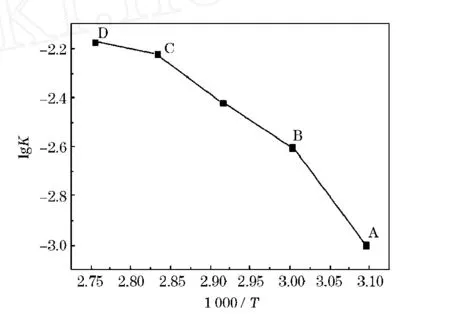
图6 软锰矿浸出的lg K-1 000/T关系图
分别求得AB、BC、CD段表观活化能为81.94,42.82,11.76 kJ/mol,可见表观活化能随温度升高而降低。在AB段表观活化能为81.94 kJ/mol,表观活化能介于45~800 kJ/mol,符合化学反应控制的特征;BC段为过渡区,BC段表观活化能为42.82 kJ/mol,符合15~45 kJ/mol混合控制的特征;CD段表观活化能11.76 kJ/mol,介于5~15 kJ/mol,符合扩散控制的特征。因此,整个浸出过程控制步骤是一个逐渐变化的过程。AB段,反应温度较低,反应速率较小,整个过程受化学反应步骤控制;随着温度的升高,BC段化学反应速率与扩散速率处于同一数量级,浸出过程属二者混合控制或过渡控制;随温度继续增加,化学反应速率迅速增加,以致超过扩散速度,因而过程转为受扩散步骤控制。同时,微波场的存在,可能使浸出过程固体膜厚度[式(5)中的δ]变薄,甚至被破坏,这也加速了浸出过程由扩散控制转为化学反应控制。

式中v——浸出剂通过固膜的扩散速率;
D——浸出剂在固膜中的扩散系数;
δ——固体膜厚度;
CS——固膜表面的浸出剂浓度;
C′S——通过固膜后浸出剂的浓度。
3 结论
1)微波辐射下,在硫酸介质中以葡萄糖为还原剂,EMD浸出过程符合反应核收缩模型,浸出过程控制步骤为化学反应速率控制。
2)氧化锰矿的浸出过程与 EMD并不相同,可能是由于脉石或杂质在浸出过程中生成产物扩散层,影响浸出过程。氧化锰矿浸出过程较为复杂,属化学反应和扩散共同控制的步骤。在温度较低时,整个过程化学反应步骤控制。随温度升高,化学反应速率迅速增加,以致超过扩散速度,过程转而受扩散步骤控制,导致浸出过程表观活化能的改变。
[1]王德全,宋庆双.用硫酸亚铁浸出低品位锰矿[J].东北大学学报(自然科学版),1996,17(6):606-609.
[2]张昭,刘立泉,彭少方.二氧化硫浸出软锰矿[J].化工冶金,2000,21(1):103-107.
[3]Veglio F,Trifoni M,Toro L.Leaching of Manganiferous Ores by Glucose in a Sulfuric Acid Solution:Kinetic Modeling and Related Statistical Analysis[J].Ind.Eng.Chem.Res.,2001,40:3 895-3 901.
[4]曹渊,白英豪,陶长元,等.还原剂对菱锰矿锰浸取率的影响研究[J].中国锰业,2008,26(1):24-26.
[5]孙大贵,刘伟,陶长元,等.微波辅助葡萄糖还原浸出氧化锰矿[J].压电与声光,2008,30(s2):86-88.
[6]Veglio F,Toro L.Fractional factorial experiments in the development of manganese dioxide leaching by sucrose in sulphuric acid solutions[J].Hydrometallurgy,1994,36:215-230.
[7]张小云,田学达.纤维素还原低含量软锰矿制备硫酸锰[J].精细化工,2006,23(2):195-197.
[8]Hariprasad D,Dash B,Ghosh M.K,et al.Leaching of manganese ores using saw dust as a reductant[J].Minerals Engineering,2007,20(14):1 293-1 295.
[9]粟海锋,孙英云,文衍宣,等.废糖蜜还原浸出低品位软锰矿[J].过程工程学报,2007,7(6):1 089-1 093.
[10]Al-Harahsheh M,Kingman S.The influence of microwaves on the leaching of sphalerite in ferric chloride[J].Chemical Engineering and Processing,2007,46(10):883-888.
[11]Al-Harahsheh M,Kingman S,Hankins N,et al.The influence of microwaves on the leaching kinetics of chalcopyrite[J].Minerals Engineering,2005,18(13-14):1 259-1 268.
[12]Furlani G,Pagnanelli F,Toro L.Reductive acid leaching of manganese dioxide with glucose:Identification of oxidation derivatives of glucose[J].Hydrometallurgy,2006,81 :234 240.
[13]方兆珩.浸出[M].北京:冶金工业出版社,2007.
[14]李洪贵.湿法冶金学[M].长沙:中南大学出版社,2002.

