碳化锰水解氧化法制备Mn3O4纳米粉
幸白云,倪建森,丁伟中,耿淑华,李其亭
(上海大学材料研究所,上海 200072)
进入21世纪后,信息、能源、国防现代化和环保的迅速发展对新材料新技术提出了更高的要求,选择纳米材料无疑是最佳的手段之一。国内外纳米氧化物粉体产业化的有 TiO2、SiO2、ZnO、ZrO2和Al2O3微粉等,还未见纳米Mn3O4微粉。锰的纳米氧化物由于其粒径小,比表面积大以及新颖的晶体结构和物理化学特性,引起了科学工作者的高度重视[1~2]。纳米Mn3O4微粉可用作锂电池的电极原料[3]。由于其高催化活性,纳米Mn3O4微粉可用于环保领域分解去除废气[4],含有Mn3O4的油漆或涂料喷洒在钢铁上比含有 TiO2或Fe2O3的油漆或涂料表现出更好的抗腐蚀性能,因此探寻一种简单易行、低成本、无污染和能大规模生产纳米Mn3O4微粉的方法一直是研究者努力方向,但至今未果。
制备纳米Mn3O4微粉的主要方法有水热法、化学沉淀法和锰盐法等[5~6],由于废水污染物的排放、产量小、反应条件苛刻、原料成本高和性价比等原因使得纳米Mn3O4微粉一直没有走向工业化。无论国内外,大部分工艺只停留在实验室阶段,实际工业中应用的只有电解金属锰微粉悬浮液法[7]生产微米级Mn3O4粉。该产品是生产锰锌铁氧体的重要原材料[8],而锰锌铁氧体用于制作高质量电感器、磁放大器、磁芯、磁盘和磁记录磁头等。目前,微米级Mn3O4普通粉国内生产能力已达年产7万t左右,大部分属于高硒(0.05%)和比表面积小(10 m2/g)的微米级Mn3O4普通粉。另外该方法使用酸、碱和催化剂等化学试剂,反应过程中的废水污染物的排放加大了企业对环保的投入,增加生产成本,无法与日本和南非等国生产的低硒和高比表面积微米Mn3O4粉竞争,可见我国虽然已是微米级Mn3O4普通粉生产大国,但还不是生产强国。
倪建森和丁伟中[9~10]另僻捷径,用碳化锰(过渡金属碳化物)水解氧化制备纳米Mn3O4微粉,由于不涉及催化剂、酸、碱等化学试剂,与电解金属锰粉悬浮液氧化法制备Mn3O4相比显然是一种名符其实的绿色工艺。本文旨在推出一种生产低硒高比表面积纳米Mn3O4微粉的新工艺。
1 试验
1.1 方法
将质量比92%(以下简同)的电解金属锰和8%的石墨用50 kg感应炉熔炼,选用石墨坩埚,石墨破碎成细粒使它尽可能多的熔解在液相合金中,待炉料充分溶化后保温一定时间,快速冷却得到碳化锰合金块。将合金块碾碎成粉,取 10 g粒径小于0.076 mm的合金粉倒入盛有100 mL去离子水的烧杯中进行水解氧化反应,然后将盛有样品的烧杯置于HJ-3型恒温搅拌器上,25℃恒温条件下以一定的速度搅拌,经过24 h搅拌反应,碳化锰合金细粉变成超细棕色微粉悬浮在液相中,最后经过滤、洗涤及80℃下烘干得到终产物。
1.2 测试
用D/max-220 X射线衍射仪进行物相分析。产物形貌用200CX透射电镜(TEM)和J EM-2010F场发射透射电镜(HRTEM)观察。用ASAP-2020M+C全自动比表面积、微孔吸附和化学吸附分析仪测定纳米Mn3O4微粉的比表面积。
2 结果与讨论
2.1 锰碳合金的制备过程分析
锰—碳两元相图见图1。

图1 M n-C二元相
由图1可知,化学计量比的Mn7C3相的碳含量为8.55%,实验的配方成分在Mn7C3和Mn23C6之间靠Mn7C3相处。在冶炼中石墨坩埚内可看到细小的石墨颗粒漂浮在合金液面上,表明液态碳化锰中的碳为饱和状态,然后快速冷却得到的脆性碳化锰合金表面和缺陷处也可看到析出的碳微粒。初步判定合金处于碳饱和状态。
为进一步确定合金相成分,取小块碳化锰合金用金相砂纸磨平作X射线衍射测试,其X射线衍射图谱如图2所示,衍射图谱与Mn7C3相的衍射卡片数据相吻合,说明碳化锰合金主相是Mn7C3。

图2 锰化碳合金的XRD
2.2 Mn3O4的制备过程分析
合金粉进入水中后立刻发生水解反应,放出小气泡,同时伴有少量反应热放出,产生类似于乙炔气味的气体,随着反应的进行,悬浮液由最初的中性逐渐呈现出碱性,最后pH值稳定在8~9之间。我们知道,金属锰粉悬浮液氧化法必须在胺盐催化作用下才能反应,而过渡金属碳化物由于其特殊的性能无需催化剂作用便可直接与水发生反应。过渡金属碳化物由于催化活性与 Pt等贵金属相似,被称为“准铂金催化剂”,它是由碳原子以间隙原子进入过渡金属晶格中形成的非计量间隙化合物。由于间隙原子加入使晶格扩展导致价电子增加,因此过渡金属碳化物表现出某些高催化活性。
随着搅拌时间的延长,样品颗粒越来越细。经过4 h连续搅拌反应(25℃恒温),碳化锰细粉变成超细灰白色粉末沉淀在容器底部,取出湿的超细灰白色粉末直接用于X射线衍射测试(因为该灰白色粉末极易氧化成棕色微粉),X射线衍射图谱如图3所示,该衍射图谱与氢氧化锰Mn(OH)2的衍射卡片数据相吻合,说明反应中间产物主相是氢氧化锰Mn(OH)2,Mn7C3的水解反应可写为:

图3 Mn(OH)2的X射线衍射图谱

气体样品的质谱分析表明碳氢化合物中有CH4、C2H4、C2H6、C3H6、C3H8、C4H8和 C4H10等气体,其中97%是可燃性气体。
Mn7C3的水解原理与其键的结合方式密切相关。有关研究表明Mn7C3中Mn-C键的结合方式以共价键结合为主,因而它的水解机理不同于一些盐类在弱酸或强碱中的水解。Bohumil Hajek[12]等人专门对 Mn7C3进行了研究,实验结果表明:Mn7C3的水解过程可以采用游离基机理加以解释,即反应过程实质为水分子撞击表面的Mn-Mn键和Mn-C键,从而形成Mn2+和OH-及氢原子。氢原子与最近的游离态孤立碳原子结合形成烃基,烃基再与其余的氢原子通过加成反应产生氢气,甲烷及其它一些饱和的碳氢化合物,与此同时溶液中的Mn2+也与OH-结合生成Mn(OH)2。

图4 Mn3O4微粉的X射线衍射图谱
图4是反应终产物的X射线衍射图谱,该衍射图谱与四方尖晶石型Mn3O4相吻合,与文献[11]沉淀粉末Mn(OH)2放在空气中氧化成“γ-Mn2O3”有所差别,水溶液中的Mn(OH)2被空气中的氧氧化成Mn3O4,其氧化反应方程为:
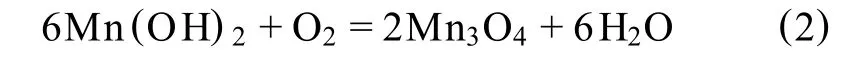
图5是纳米Mn3O4微粉的透射电镜形貌,粒径大小较均匀,纳米Mn3O4微粉颗粒大小在50~100 nm,颗粒发育较完整,基本上呈四方晶形,图6是几个小晶粒的Mn3O4高分辨透射电镜HRTEM晶格像,即使是20 nm左右的小颗粒也是发育较完整的小单晶,可见粒子为发育完好的单晶颗粒,一个颗粒晶格条纹之间的距离为0.486nm,对应Mn3O4微粉的面(101),另一个颗粒晶格条纹之间的距离为0.306 nm,对应的晶面为(112),其它视野中展现的大部分是(101)单晶,与文献[13~14]报导的四方尖晶石型纳米Mn3O4颗粒形貌相似。这可能是因为大部分颗粒是四方平板状,而非任意形状。

图5 24 h搅拌反应制备的纳米Mn3O4微粉 TEM形貌
该工艺制备的纳米Mn3O4微粉比表面积为25 m2/g,超过金属锰微粉悬浮液法的10 m2/g,纳米Mn3O4微粉中的Mn含量为70.8%,如果设法降低粒子团聚现象,可进一步提高其比表面积。硒元素从电解金属锰片的0.056%减少到纳米Mn3O4微粉的0.018%,下降了68%,纳米 Mn3O4微粉中的残留碳为0.06%。本工艺操作简单,可以批量生产纳米Mn3O4微粉。如果97%~99%的可燃性气体得到应用,性价比将更高。由于不涉及催化剂、酸、碱等化学试剂,是一种名符其实的绿色工艺。

图6 24 h搅拌反应制备的纳米Mn3O4微粉HRTEM晶格像
2.3 Mn3O4的热稳定性
实验还对纳米Mn3O4微粉热稳定性进行了测试,把纳米Mn3O4微粉放于陶瓷坩埚内,盖上埚盖,放在箱式炉中进行高温氧化试验,图7A是纳米Mn3O4微粉600℃/1 h氧化后的X射线衍射图谱。

图7 纳米 M n3O4微粉经热处理后的 XRD图谱(A:600℃/1 h,B:800℃/0.5 h)
从图7可以看出,纳米Mn3O4微粉经600℃/h处理后,部分 Mn3O4相已氧化成 Mn2O3相,图7B是纳米Mn3O4微粉经800℃/0.5 h氧化后的X射线衍射图,可见经800℃/0.5 h处理后,Mn3O4相已全部氧化成Mn2O3相,Mn3O4的氧化过程可表示为:
Mn3O4+1/4O2→3/2Mn2O3(3)经这两种温度氧化处理的纳米Mn3O4微粉颜色均从棕色转变成近黑色。
3 结论
1)92%的电解锰和8%的石墨用50 kg感应炉(石墨坩埚)熔炼,然后快速冷却得到活性较高的碳化锰合金。
2)碳化锰经24 h(25℃恒温)水解氧化反应成颗粒尺寸在50~100 nm纳米的Mn3O4微粉,而且纳米Mn3O4微粉为发育较完整的单晶颗粒,比表面积为 25 m2/g,纳米 Mn3O4微粉中的 Mn含量为70.82%,硒元素从电解金属锰片的0.056%减少到纳米Mn3O4微粉的0.018%,下降了68%,残留碳为0.06%。
3)纳米Mn3O4微粉经600℃/h氧化处理已有部分氧化成Mn2O3相,经800℃/0.5 h氧化处理后已全部氧化成Mn2O3相。
4)本工艺操作简单,可以批量生产,由于不涉及催化剂、酸、碱等化学试剂,与电解金属锰粉悬浮液氧化法生产四氧化三锰相比是一种名符其实的绿色工艺。
致谢:实验过程中得到上海大学微结构研究中心李强,鲁波,虞伟钧,褚于良,白琴,楼燕燕等同志的帮助,在此一并致谢。
[1]Michael H.Huang,Samuel Mao,Henning Feick,et al.Room-temperature ultraviolet nanowire nanolasers[J].Science,2001,292:1 897-1 899.
[2]Z.W.Chen,J.K.L.Lai,C.H.Shek.Shape-controlled synthesis and nanostructure evolution of single-crystal Mn3O4nanocrystals[J].Scripta Materialia,2006,55:735-738.
[3]T.Ozkaya,A.Baykal,H.Kavas,Y.K?seoelu,M.S.Top rak,A novel synthetic route to Mn3O4nanoparticles and their magnetic evaluation[J].Physica B:Physics of Condensed Matter,2008,403:3 760-3 764.
[4]G.Laugel,J.Arichi,M.Moliere,et al,Metal oxides nanoparticles on SBA-15:Efficient catalyst for methane combustion[J].Catalysis Today,2008,138:38-42.
[5]伍喜庆,丁九生.四氧化三锰的制备方法[J].中国锰业,1996,14(1):37-41.
[6]C.C.Hu,Y.T.Wu,K.H.Chang.Low-Temperature Hydrothermal Synthesisof Mn3O4and MnOOH Single Crystals:Determinant Influence of Oxidants[J].Chem.Mater.2008,20:2 890-2 894.
[7]郭玉刚,田庆华,郭学益.Mn3O4制备研究进展[J].金属材料与冶金工程,2008,36(2):60-64.
[8]潘其经.四氧化三锰的性质、用途及质量标准[J].中国锰业,1998,16(2):42-45.
[9]倪建森,丁伟中.一种用碳锰合金生产四氧化三锰的方法[P].中国专利,200810203968.9.
[10]倪建森,丁伟中.用碳锰合金一步法生产低硒和高比表面积四氧化三锰的方法[P].中国专利,200910044828.6.
[11]Hiroyasu I,Hiroyuki U,Satoshi M.Studies of“Manganese Cycle”for gasification of solid carbon resources.I.formation and hydrolysis of manganese carbides and their repetition[J].Bull Chem Soc.Jpn,1985,58:2 289-2 293.
[12]Hajek B,Karen P,Borzed V.Heptamanganese tricarbide Mn7C3[J].Collect.Czech.Chem.Commun,1983,48:2 740-2 750.
[13]Yang Li-Xia,Zhu Ying-Jie,Tong Hua,et al.Low temperature synthesis of Mn3O4polyhedral nanocrystals and magnetic study[J].Journal of Solid State Chemistry,2006,179:1 225-1 229.
[14]Pike J,Hanson J,Zhang L H,Chan S W.Synthesis and Redox Behavior of Nanocrystalline Hausmannite (Mn3O4) [J].Chem.Mater,2007,19:5 609-5 616.

