UV-B辐射对黄芩幼苗生长及生理生化指标的影响
唐文婷,刘 晓,房敏峰,岳 明
(西北大学西部资源生物与现代生物技术教育部重点实验室,陕西 西安 710069)
平流层臭氧的损耗可导致到达地球表面的太阳紫外线-B(UV-B,波长280~315 nm)辐射量增加,对人类健康和生态系统造成较大的危害。UV-B辐射能够对植物的光合器官、DNA、蛋白质及质膜造成生理损伤,并且能够使植物的生长发育和形态特征改变(如植株矮化、叶面积减小及生物量降低等)[1]。在长期的进化过程中,植物本身已形成了应对 UV-B辐射的保护机制,如增加体内黄酮类化合物含量以屏蔽UV-B辐射、通过增强抗氧化系统的抗氧化能力来减轻UV-B辐射造成的活性氧自由基损伤等[2]。
迄今为止,国内外研究人员已对近千种植物对UV-B辐射的响应进行了研究,研究对象以农作物和自然生态系统中的关键物种为主,对药用植物等资源植物的研究较少。目前,有少数研究小组就UVB辐射对药用植物的影响进行了相关研究和分析,其目的是借助UV-B辐射调控药用植物的生长并提高有效成分的含量[3-4]。
黄芩(ScutellariabaicalensisGeorgi)为唇形科(Labiatae)黄芩属(ScutellariaL.)多年生草本植物,为常用中药材之一,药用历史悠久,为国家三级保护野生药用植物[5]。黄芩以根入药,主要有抗菌、抗炎、免疫调节、解热镇痛、调节血脂和抗艾滋病病毒等功效[6]。近年来,随着临床用量的增加,黄芩野生资源锐减,栽培黄芩成为药材黄芩的主要来源[5]。笔者对增强UV-B辐射条件下栽培黄芩幼苗的生长及生理生化指标的变化进行了研究,以期探讨增强UVB辐射对黄芩幼苗生长及生理代谢的影响。
1 材料和方法
1.1 材料
实验于2009年7月至9月进行,供试黄芩种子购于陕西商州黄芩栽培基地。选择饱满健康的黄芩种子播种于直径28 cm、高10 cm的泥盆中,栽培基质为细砂和营养土(体积比2∶1)的混合基质;出苗后待幼苗生长至6片真叶时移入直径10 cm、高8.6 cm的塑料营养钵中,以沙壤土为栽培基质,每钵定植2株幼苗;移栽幼苗置于荫蔽环境下生长1周后移入515HD型人工气候室(美国 A-Plus公司生产)中进行培养,培养条件为光照时间12h·d-1、光照强度250μmo l·m-2·s-1、昼夜温度分别为25℃和20℃,栽培期间定时浇水。待幼苗苗龄为61 d时随机选取长势一致的植株进行实验。
1.2 方法
1.2.1 UV-B处理方法 2009年9月,将黄芩幼苗分为处理组(UV-B)和对照组(CK)2组(各组样本量均为24盆48株),均置于室内培养架上进行培养,培养温度为室温,以日光灯(功率30W,波长765nm)为光源进行光照,光照时间10h·d-1。其中,处理组同时采用UV-B灯(40W,波长313 nm,北京电光源研究所生产)进行增强UV-B辐射处理,连续辐照7d,每天辐照时间为10:00至16:00。辐照时将处理组幼苗置于灯管正下方,用紫外辐照计(北京师范大学光电仪器厂生产)测定此处的UV-B(波长297nm)辐照度为11.8μW·cm-2。为避免干扰,辐照时用厚度0.13mm醋酸纤维素膜(美国 Grafix公司生产)滤掉少量UV-C。
1.2.2 测定方法 UV-B辐照处理7d后取样,分别测定处理组和对照组黄芩幼苗的生长指标(株高和单株干质量)和各项生理生化指标。各指标均重复测定3次,结果取平均值。
在UV-B处理组及对照组中随机选取黄芩幼苗各3株,分别测定株高和单株干质量,其中,单株干质量为植株在60℃条件下干燥72h后称取的恒质量。
在UV-B处理组及对照组中随机采集不同幼苗的叶片进行各项生理生化指标的测定。参照A rnon[7]的方法测定光合色素含量;参照 Giannopo litis等的氮蓝四唑(NBT)光化还原法[8]测定SOD活性,以抑制50%的 NBT光化还原为1个酶活力单位(U);参照陈建勋等的愈创木酚法[9]测定 POD活性和CAT活性,其中,POD活性以470 nm处的吸光度1m in增加0.01为1个酶活力单位(U),CAT活性以240 nm处的吸光度1m in减少0.01为1个酶活力单位(U);采用2,6-二氯酚靛酚比色法[10]测定抗坏血酸(ASA)含量;采用茚三酮比色法[11]测定游离脯氨酸含量;参照邱枫等[12]和 Zucker[13]的方法提取并测定苯丙氨酸解氨酶(PAL)的活性,以1 mL酶液于290 nm处的吸光度1 h变化0.01为1个酶活力单位;采用 Sangtarash等[14]的方法测定紫外吸收物含量,以1 g样品在波长300 nm处的吸光值代表紫外吸收物的相对含量;参照 Predieri等[15]的方法测定MDA含量。
1.3 数据处理
使用 Excel2007软件对实验数据进行统计和分析,采用单因素方差分析方法对处理组和对照组间的差异显著性进行分析。
2 结果和分析
2.1 UV-B辐射对黄芩幼苗生长的影响
经过UV-B辐射7d后,黄芩幼苗的株高和单株干质量与对照组差异不大,处理组和对照组黄芩幼
苗的平均株高分别为8.3和8.1cm;单株平均干质量分别为0.027和0.026g。差异显著性分析结果表明,UV-B处理组黄芩幼苗的平均株高和单株平均干质量与对照组均没有显著差异,表明UV-B辐射对黄芩幼苗的生长影响不明显。
2.2 UV-B辐射对黄芩幼苗生理生化指标的影响
2.2.1 对黄芩幼苗光合色素含量的影响 经过7d的UV-B辐射后黄芩幼苗光合色素含量的变化见表1。由表1可见,与对照组相比,经UV-B辐射7d的黄芩幼苗叶片的叶绿素a、叶绿素b、总叶绿素及类胡萝卜素含量均极显著降低,而叶绿素a/b的比值以及类胡萝卜素/总叶绿素的比值则分别显著或极显著提高。
2.2.2 对其他生理生化指标的影响 UV-B辐射对黄芩幼苗叶片抗氧化酶(SOD、POD和 CAT)活性、苯丙氨酸解氨酶(PAL)活性以及抗坏血酸(ASA)含量、游离脯氨酸含量、紫外吸收物相对含量和MDA含量的影响见表2和表3。

表1 UV-B辐射(11.8μW·cm-2)对黄芩幼苗叶片光合色素含量的影响1)Table1 Effect of UV-Bradiation(11.8μW·cm-2)on photosyn thetic pigmentcon ten t in leaves of Scu tella ria ba ica lensis Georg i seed lings1)
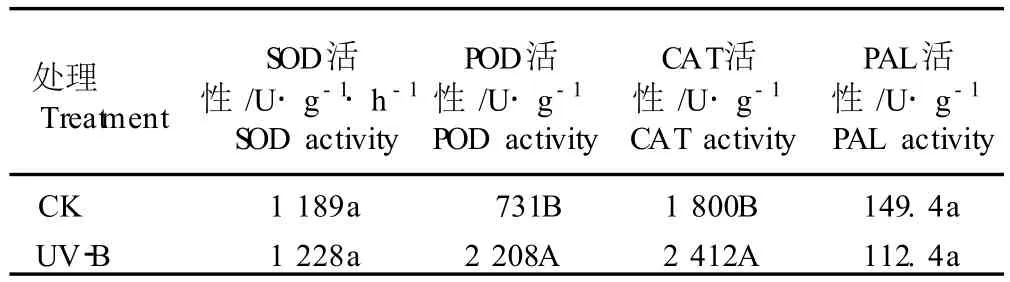
表2 UV-B辐射(11.8μW·cm-2)对黄芩幼苗叶片一些酶活性的影响1)Table2 Effect of UV-Brad ia tion(11.8μW·cm-2)on som e enzym e activ ities in leaves of Scu tella ria baica lensis Georg iseed lings1)
经过UV-B辐射7d后,黄芩幼苗叶片中的CAT和 POD活性均极显著高于对照组(P<0.01),SOD活性则比对照组略高,但差异不显著(P>0.05);UV-B处理组黄芩叶片的ASA和游离脯氨酸含量均显著高于对照组(P<0.05),PAL活性和紫外吸收物相对含量均低于对照组但差异不显著(P>0.05),而MDA含量却略高于对照组而且差异也不显著(P>0.05)。
从实验结果看,经过UV-B辐射后,黄芩幼苗叶片POD和CAT活性增强、ASA和游离脯氨酸含量升高,表明UV-B辐射条件下黄芩幼苗的抗氧化能力增强,从而能更有效地抵御UV-B导致的氧化损伤;经过UV-B辐射后黄芩幼苗叶片中MDA含量与对照组差异不显著,表明UV-B辐射没有加剧黄芩幼苗叶片的膜质过氧化程度,显示出黄芩幼苗能够耐受一定强度的 UV-B辐射。此外,经过UV-B辐射后,黄芩幼苗叶片中的PAL活性和紫外吸收物相对含量均没有显著变化,表明11.8μW·cm-2UV-B辐照7d对黄芩幼苗叶片中黄酮类化合物等的合成没有刺激作用。

表3 UV-B辐射(11.8μW·cm-2)对黄芩幼苗叶片中某些生理活性成分的影响1)Table3 Effect of UV-Brad ia tion(11.8μW·cm-2)on som e physiolog ica l active com pounds in leaves of Scu tella ria baica lensis Georg iseed lings1)
3 讨论和结论
研究结果显示,经过11.8μW·cm-2UV-B辐照7d后,黄芩幼苗叶片的叶绿素 a、叶绿素 b、总叶绿素及类胡萝卜素含量均极显著降低,而叶绿素 a/b比值以及类胡萝卜素/总叶绿素的比值则分别显著或极显著提高。根据以往的研究结果推测:UV-B辐射后,叶绿素含量的降低可能是叶绿素光氧化和(或)叶绿素合成受到抑制的结果[16];叶绿素 a/b比值的显著升高是由于叶绿素 b对UV-B辐射的敏感程度大于叶绿素 a[17]。有研究表明,UV-B辐射菜豆(PhaseolusvulgarisL.)和大麦(HordeumvulgareL.)幼苗后,相对于叶绿素含量的下降,类胡萝卜素的损失则相对较小,说明植物的叶绿素合成途径可能比类胡萝卜素的合成途径更容易受到 UV-B辐射的影响[17]。也有研究者认为[16],UV-B辐射条件下类胡萝卜素与叶绿素比值的升高表明植物自身能形成有效的保护机制,避免 UV-B辐射对重要的代谢器官和代谢过程的严重损伤。作者的研究结果与以上研究结果一致,表明在 UV-B辐射条件下类胡萝卜素可能对黄芩幼苗具有一定的保护作用。
UV-B辐射能够诱导植物体内产生活性氧和自由基,从而导致质膜、核酸和蛋白质的损伤,并诱导植物的抗氧化系统对此产生相应的响应,然而,UV-B辐射对植物抗氧化酶活性的影响是不同的。本实验中,经过11.8μW·cm-2UV-B辐照7d后黄芩幼苗叶片中的 POD和 CAT活性显著高于对照,SOD活性与对照差异不显著;Santos等[18]的研究结果表明,在UV-B辐射条件下,马铃薯(SolanumtuberosumL.)叶中过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和过氧化物酶(POD)活性均增加;而黄少白等[19]的研究结果显示,19.1 kJ·m-2·d-1UV-B辐射能显著抑制水稻(OryzasativaL.)2个品种叶片内的 CAT和SOD活性;陈拓等[20]的实验结果则显示,在增强 UV-B辐射条件下,小麦(TriticumaestivumL.)叶片中的CAT、原卟啉原氧化酶(PPOX)及 APX活性均明显升高,但 SOD活性几乎不受影响。综合分析后认为,经过UV-B辐射后,不同植物的抗氧化酶活性变化差异可能与2种因素有关:一是与所选植物种类本身的特性有关[21],包括体内抗氧化酶活性水平、生长状态以及遗传特性等;二是与 UV-B辐照度和辐照时间等实验条件的差异有关。
抗坏血酸(ASA)是植物体内主要的抗氧化物之一,用13 kJ·m-2·d-1UV-B辐照14 d后水稻叶片中的ASA含量升高[22],与 ASA的抗氧化作用有关。游离脯氨酸是植物体内的渗透调节物质之一,可以直接参与氧自由基(ROS)的淬灭反应,具有保护植物的潜力,在低强度UV-B辐射条件下,植物体内的游离脯氨酸含量升高[23]。本实验中,经过11.8μW· cm-2UV-B辐照7d后黄芩幼苗叶片中 ASA和游离脯氨酸含量均显著高于对照组,表现出为抵抗UV-B辐射伤害黄芩体内代谢系统所做出的应激反应。
研究结果表明,经过11.8μW·cm-2UV-B辐照7d后黄芩幼苗叶片中的苯丙氨酸解氨酶(PAL)活性降低,且紫外吸收物相对含量也同时降低,但均与对照组无显著差异。一般认为,在UV-B辐射条件下,不同植物体内紫外吸收物含量均增加,但紫外吸收物含量的变化存在种内及种间差异,其积累受植物基因型、生活型、生态型和环境因子的调节[24]。Kinnunen等[25]的研究结果表明,UV-B辐射降低了苏格兰松(PinussylvestrisL.)幼叶中UV-B吸收物质的含量,并且推测植物只有在需要且必须有防护作用时才会制造大量的UV-B吸收色素。紫外吸收物主要包括酚类化合物(如黄酮类化合物)以及烯萜类化合物(如类胡萝卜素、树脂等),其中,黄酮类化合物最主要。PAL是合成黄酮类化合物的一个关键酶,其活性变化可能导致黄酮类化合物含量的变化。本实验中,紫外吸收物相对含量的降低可能主要与 PAL活性的降低有关。这一结果也显示,用11.8μW·cm-2UV-B辐照7d不能促进黄芩幼苗叶片中总黄酮的积累,因此,若采用这一方法提高黄芩体内总黄酮的含量,必须对 UV-B辐照度及辐照时间进行深入细致的比较研究。
陈岚等[26]的研究结果显示,在温室条件下,采用0.4~0.6 W·m-2的 UV-B连续照射小白菜(Brassicacampestrisssp.chinensisMakino)7d,各处理组小白菜的鲜质量和株高均与对照无显著差异;另有研究表明,在一定的强度范围内紫外线照射对植物的生长发育无显著抑制作用,但具有控制植株徒长、缩短节间长度、增加分枝数量和促使叶片变厚等效应[27]。本研究中,经过UV-B辐射后黄芩幼苗的株高和单株干质量与对照组差异不大,也验证了这一观点。说明11.8μW·cm-2UV-B辐照7d对黄芩幼苗生长没有明显的抑制作用。
综上所述,黄芩幼苗能够通过自身的抗氧化系统有效地减轻一定强度(11.8μW·cm-2)UV-B辐射产生的氧化损伤,减少 UV-B辐射对其生长发育的影响,从而对UV-B辐射表现出一定的耐受能力。
[1]JansenMA K,Gaba V,Greenberg BM.H igher p lants and UV-Brad iation:balancing dam age,repair and acc lim ation[J].Trends in Plant Science,1998,3(4):131-135.
[2]Xu C P,Natarajan S,Su llivan J H.Impac t of so lar u ltravio let-Bradiation on the an tioxidant defense system in soybean lines differing in flavonoid conten ts[J].Environm ental and Experim entalBotany,2008,63(1/3):39-48.
[3]周丽莉,祁建军,李先恩.增强UV-B辐射对丹参产量和品质的影响[J].生态环境,2008,17(3):966-970.
[4]张 琪,王 俊,彭 励,等.中波紫外线辐射对甘草光合作用及有效成分积累的影响[J].农业科学研究,2008,29(1):11-15.
[5]李 欣.药用黄芩结构和黄酮类化合物及黄芩苷积累动态研究[D].西安:西北大学生命科学学院,2008.
[6]刘英学.黄芩的化学成分研究[D].沈阳:沈阳药科大学中药学院,2008.
[7]A rnon D I.Copper enzymes in isolated ch lorop lasts.Polyphenoloxidase inBetavulgaris[J].Plant Physiology,1949,24(1):1-15.
[8]Giannopo litis C N,Ries S K.Superoxide dism utases:Ⅰ.Occurrence in higherp lants[J].Plant Physio logy,1977,59(2):309-314.
[9]陈建勋,王晓峰.植物生理学实验指导[M].2版.广州:华南理工大学出版社,2006:72-73.
[10]李合生.植物生理生化实验原理和技术[M].1版.北京:高等教育出版社,2000.
[11]刘 萍,李明军.植物生理学实验技术[M].北京:科学出版社,2007.
[12]邱 枫,许 雷,高洪文.柠条幼苗发育中苯丙氨酸解氨酶活性[J].亚热带农业研究,2006,2(3):184-187.
[13]ZuckerM.Induction of phenylalanine deam inase by light and its relation to chlorogenic acid synthesis in potato tuber tissue[J]. Plant Physio logy,1965,40(5):779-784.
[14]SangtarashMH,QaderiMM,Chinnappa C C,etal.D ifferential sensitivity of cano la(Brassicanapus)seed lings to ultraviolet-Bradiation,water stress and abscisic acid[J].Environmental and ExperimentalBotany,2009,66(2):212-219.
[15]Predieri S,Norman H A,Krizek D T,et al.Influence of UV-Bradiation onmembrane lip id composition and ethylene of evolution in‘Doyenne d′H iver’pear shoots growninvitrounder different photosynthetic photo fluxes[J].Environmental and Experimental Botany,1995,35(2):151-160.
[16]LáposiR,Veres S,Lakatos G,et al.Responses of leaf traits of European beech(FagussylvaticaL.)sap lings to supp lementalUVBradiation and UV-Bexc lusion[J].Agricultural and Forest Meteorology,2009,149(5):745-755.
[17]TeviniM,IwanzikW,Thoma U.Some effects of enhanced UV-Birradiation on the growth and composition of p lants[J].Planta,1981,153(4):388-394.
[18]Santos I,Fidalgo F,A lmeida J M,et al.Biochem ical and ultrastructural changes in leaves of potato p lants grown under supp lem entary UV-B radiation[J].Plant Science,2004,167(4):925-935.
[19]黄少白,戴秋杰,刘晓忠,等.水稻对紫外光B辐射增强的生化适应机制[J].作物学报,1998,24(4):464-469.
[20]陈 拓,任红旭,王勋陵.UV-B辐射对小麦叶抗氧化系统的影响[J].环境科学学报,1999,19(4):453-455.
[21]姚晓芹,刘 庆.陆生植物体内酶系统对UV-B辐射增强的响应[J].应用生态学报,2006,17(5):939-942.
[22]DaiQ J,Yan B,Huang SB,et al.Response of oxidative stress defense system s in rice(Oryzasativa)leaveswith supp lemental UV-Bradiation[J].Physiologia Plantarum,1997,101(2):301-308.
[23]Parvanova D,Ivanov S,Konstantinova T,etal.Transgenic tobacco p lants accumulating osmolytes show reduced oxidative dam age under freezing stress[J].Plant Physio logy and Biochem istry,2004,42(1):57-63.
[24]林植芳,林桂珠,彭长连,等.亚热带植物叶片UV-B吸收化合物的积累[J].生态学报,1998,18(1):90-95.
[25]Kinnunen H,Laakso K,Huttunen S.Methanol-extractable UV-B-absorbing compounds in Scots p ine need les[J].Chemosphere: GlobalChange Science,1999,1(4):455-460.
[26]陈 岚,吴 震,蒋芳玲,等.紫外线-B照射对小白菜生长、产量及品质的影响[J].植物资源与环境学报,2008,17(1):43-47.
[27]李 元,王勋陵.UV-B辐射对田间春小麦生物量和产量的影响[J].农村生态环境,1999,15(2):28-31.

