布氏乳杆菌产生甘露醇的发酵研究
侯建革,王 芳,王丽丽,赵长新
(1.大连工业大学生物与食品工程学院,辽宁大连 116034;2.河北科技大学生物科学与工程学院,河北石家庄 050018)
布氏乳杆菌产生甘露醇的发酵研究
侯建革1,2,王 芳2,王丽丽2,赵长新1
(1.大连工业大学生物与食品工程学院,辽宁大连 116034;2.河北科技大学生物科学与工程学院,河北石家庄 050018)
实验研究布氏乳杆菌(Lactobacillus buchneri)CICC 6007发酵产生甘露醇。结果表明,在厌氧培养条件下,甘露醇的积累量与菌体生长量呈正相关性。在种子培养36 h,接种量(质量分数)为20%,p H值为6.5,温度为35℃,培养基总糖为150 g/L,其中果糖与葡萄糖的大约消耗比值为3∶1(质量比),培养48 h,甘露醇产量可达68.5 g/L,甘露醇对果糖转化率达到78.7%,为发酵法生产甘露醇奠定了基础。
甘露醇;发酵;布氏乳杆菌
甘露醇(mannitol),又称D-甘露糖醇,分子式为C6H14O6,熔点为166℃。甘露醇在自然界生物体内广泛存在,具有多种功能,被广泛用于食品、医药、轻工和化工等领域[1]。由于甘露醇在人体内代谢与体内胰岛素无关,可以作为低热值食品和低糖食品的甜味剂,适用于糖尿病患者、肝功能障碍者。甘露醇的主要生产工艺有天然提取法和化学催化法,自然界中还发现很多微生物菌株可以合成甘露醇。已经报道的微生物类群有霉菌、酵母菌和细菌[2-6],但没有工业化生产报道。
YUN等研究了不同碳源对2株乳酸菌产甘露醇的影响,发现以果糖或蔗糖为碳源时甘露醇的积累量显著[7]。W EYM ARN等对乳酸菌发酵甘露醇的条件进行优化,甘露醇最大容积产率达到16 g/(L·h),肠膜明串珠菌(L.mesenteroides)A TCC-9135产甘露醇的容积产率达到20 g/(L·h),转化率达97%[8]。本研究采用布氏乳杆菌为实验菌株,初步探索其甘露醇的发酵条件。
1 材料和方法
1.1 材 料
菌种:布氏乳杆菌(Lactobacillus buchneri)CICC 6007。
种子培养基(1 L):10 g蛋白胨;10 g牛肉膏;10 g酵母膏;2 g柠檬酸二铵;2 g乙酸钠;2 g磷酸氢二钾;20 g葡萄糖;50 mg M gSO4;50 mg M nSO4;50 mg ZnSO4;1 mL吐温80;p H值为6.3。
发酵培养基(1 L):5 g蛋白胨;5 g牛肉膏;5 g酵母膏;2 g柠檬酸二铵;2 g乙酸钠;2 g磷酸氢二钾;20 g葡萄糖;40 g果糖;50 mg M gSO4;50 mg M nSO4;50 mg ZnSO4;1 mL吐温80;1 m L复合B族维生素;p H值为6.3。
固体培养基:含2%(质量分数)琼脂的种子培养基。
质量分数为1.5%的半胱氨酸盐酸盐溶液:半胱氨酸盐酸盐0.75 g,用蒸馏水定容至50 m L。
质量分数为0.12%的咔唑酒精溶液:咔唑60.0 mg,用酒精定容至50 mL,放置在棕色瓶中,24 h后使用。
硫酸溶液:量取分析纯浓硫酸450 m L,在不断搅拌下徐徐倒入190 m L蒸馏水中。
果糖标准溶液:称取预先在55℃真空干燥至恒重的分析纯果糖250 mg,用蒸馏水定容至50 m L(5 m g/m L),存放于冰箱中备用,使用时稀释100倍(50 m g/L)。
Nash试剂:精确称取醋酸铵15.00 g,用蒸馏水溶解,加入0.2 m L冰醋酸及0.2 m L乙酞丙酮,定容至100 m L。
质量分数为1%的L-鼠李糖:准确称取0.10 gL-鼠李糖溶于蒸馏水中,定容至100 m L。
0.15 mol/L的高碘酸钠:准确称取0.321 g高碘酸钠,溶于0.12 mol/L的盐酸溶液中,定容至100 mL。
甘露醇标准溶液:称取干燥至恒重的标准品甘露醇500 mg,溶于蒸馏水中,定容至50 mL(10 mg/m L),使用时稀释100倍(100 mg/L)。
葡萄糖标准溶液:称取干燥至恒重的标准品葡萄糖500 mg,溶于蒸馏水中,定容至50 mL(10 mg/m L),使用时稀释100倍(100 mg/L)。
1.2 方 法
1.2.1 发酵液中果糖检测方法——咔唑法
标准曲线的绘制:取25 m L比色管,分别加50 m g/L的果糖标准溶液0,0.2,0.4,0.6,0.8,1.0 m L,再用蒸馏水分别补充至1 m L,然后每管中加入0.2 m L半胱氨酸盐酸盐溶液及6 m L硫酸溶液,摇匀后,立即加入0.2 mL咔唑酒精溶液,摇匀,于60℃水浴中保温10 min,取出用水冷却呈红紫色,在560 nm波长下比色,以吸光度对果糖含量(质量浓度,下同)作图,即得标准曲线。
样品测定:将发酵液适当稀释,准确吸取1.0 mL,使其中果糖质量浓度在10~50 mg/L的范围内,然后按作果糖标准曲线的操作进行。根据获得的吸光度在标准曲线图上查得相应的果糖量。
1.2.2 发酵液中甘露醇检测方法——Nash试剂法
发酵液中甘露醇含量的测定可利用高碘酸钠氧化甘露醇的产物,与新鲜的Nash试剂作用产生黄色的3,5-二乙酰-1,4脱氢二甲基吡啶的显色反应,按照文献[9]所提供的方法测定发酵液中甘露醇。
甘露醇标准曲线的绘制:取25 mL比色管,分别准确加入100 mg/L的甘露醇标准溶液0,0.02,0.05,0.1,0.2,0.5,1.0 mL,再用蒸馏水分别补充至1 m L,然后在每支比色管中加入1 m L浓度为0.15 mol/L的高碘酸钠溶液,混匀,放10 min后加入2 mL质量分数为0.1%的L-鼠李糖溶液,充分混匀后加入Nash试剂4 mL,于50℃水浴保温15 min,取出用水冷却。用10 mm光径的比色皿,在412 nm波长下测定吸光度,以吸光度对甘露醇浓度作图,即得甘露醇标准曲线。
样品测定:取样液2 m L于试管中,加入浓盐酸3 m L,沸水浴加热10 min,冷却,稀释至适当质量浓度,使甘露醇质量浓度低于0.05 m g/m L,然后按作甘露醇标准曲线的操作进行。根据获得的吸光度在标准曲线图上查得相应的甘露醇的质量浓度。
葡萄糖的干扰:取25 m L比色管,分别准确加入100 m g/L的葡萄糖标准溶液0.1,0.5,1.0 m L,再用蒸馏水分别补充至1 mL,按照甘露醇标准曲线的操作进行,测定吸光度。
果糖的干扰:配制一系列果糖溶液,质量浓度分别为0,10,20,30,40,50 g/L,取1 m L按照样品测定的方法测定吸光度。
1.2.3 发酵液中葡萄糖检测方法——葡萄糖试剂盒
葡萄糖试剂盒中配有葡萄糖标准液,质量浓度为ρ标=1 mg/m L。用20μL的移液枪取20μL于7 m L的离心管中,快速加入1.5 m L酶试剂(葡萄糖试剂盒中试剂Ⅰ)和1.5 mL酚试剂(葡萄糖试剂盒中试剂Ⅱ),混合均匀,于37℃保温20 m in,使用光径10 mm的比色皿,测定505 nm波长下的吸光度,记录A标。
将样品稀释到合适质量浓度(葡萄糖质量浓度为1 m g/m L左右),操作方法同上,记录吸光度ρ样。样品的质量浓度计算如下:

式中:ρ标为标准葡萄糖质量浓度(mg/L);A标为标准葡萄糖吸光度;A样为样品葡萄糖吸光度;D为稀释倍数。
1.2.4 发酵过程的p H值控制
在布氏乳杆菌厌氧生长过程当中会产生大量的乳酸、乙酸和二氧化碳,这些产物使发酵液的p H值下降从而影响菌体的正常生长,需采用滴加氨水来中和发酵液中p H值。
1.2.5 菌体湿重的检测方法
将发酵液混匀,取5 mL发酵液于7 mL的离心管中,于9 000 r/min离心10 min,弃去上清液,称量菌体的质量。
1.2.6 培养过程
将活化的布氏乳杆菌接入种子培养基中,30℃厌氧培养3 d,按20%(质量分数,下同)的接种量接入发酵培养基中,静止培养,发酵过程中检测菌体湿重、产酸量和甘露醇的产生量。
2 结果与讨论
2.1 果糖测定标准曲线的建立及其干扰因素(见表1及图1)

表1 甘露醇、葡萄糖对果糖检测方法的干扰Tab.1 Interference of mannitol and glucose on the detection of fructose
由图1可知,测定果糖的标准曲线,线性相关性良好,同时表1的结果显示出甘露醇和葡萄糖对该方法的影响很小,因此可以作为发酵液中果糖的检测方法。

图1 果糖标准曲线Fig.1 Standard curve of fructose
2.2 甘露醇测定标准曲线的建立及干扰(见图2及表2、表3)
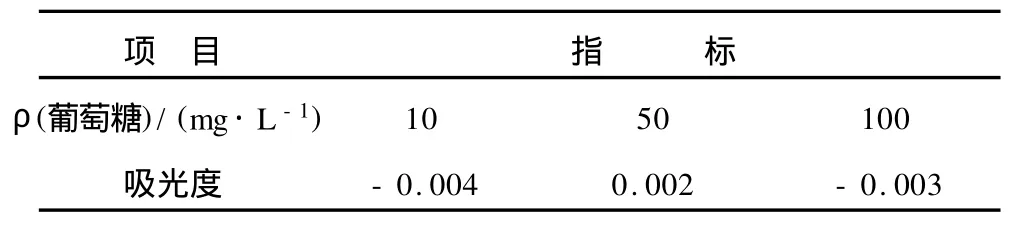
表2 葡萄糖对甘露醇检测方法的干扰Tab.2 Interference of glucose on the detection of mannitol
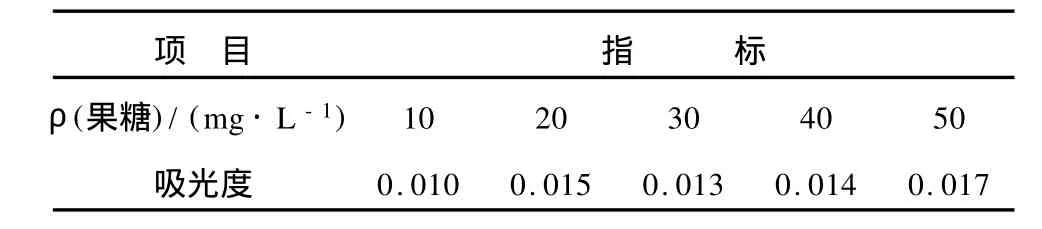
表3 果糖对甘露醇检测方法的干扰Tab.3 Interference of fructose on the detection of mannitol
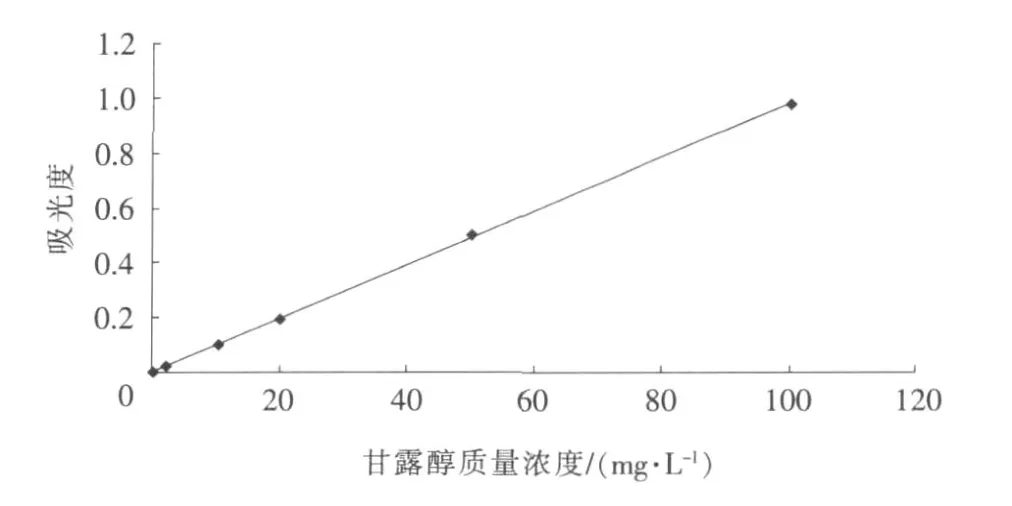
图2 甘露醇的检测标准曲线Fig.2 Standard curve of the detection of mannitol
由表2和表3可以看出,葡萄糖和果糖对测定甘露醇的方法干扰都很小,可以实现发酵液中甘露醇的检测。
2.3 布氏乳杆菌CICC 6007的生长曲线
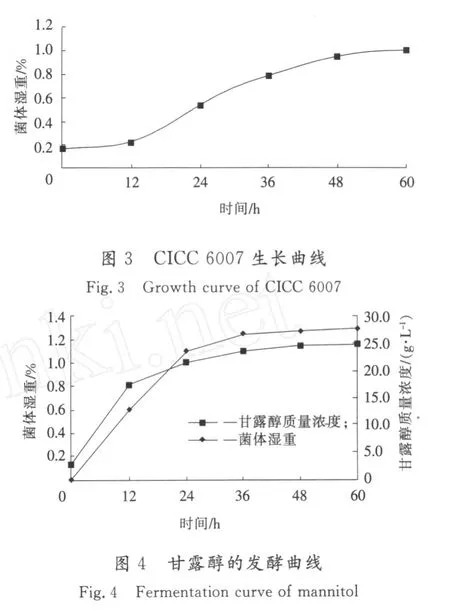
将平板上活化的菌接入种子培养基中,于30℃厌氧静止培养,每12 h取样测定菌体湿重,用氨水调节维持p H值为6.5,测定CICC 6007的生长曲线,见图3。由图3可见,12~48 h为对数生长期,在36~48 h时菌体活力非常高,生长到48 h时进入稳定期,因此种子培养时间确定为36 h。
2.4 甘露醇的发酵与菌体生长
将培养了36 h的一级种子,以20%的接种量转接到发酵培养基中,每12 h调节p H值为6.5,并取样测定菌体湿重和甘露醇的产量,参见图4。
由图4可以看出,菌体生长与甘露醇积累基本同步,属于生长偶联,因此甘露醇属于初级代谢产物,发酵时间48 h之后,菌体量、甘露醇都趋于稳定,因此确定发酵周期为48 h。
2.5 接种量对甘露醇发酵的影响
培养36 h的种子,以接种量5%,10%,15%,20%和25%分别接到发酵培养基中,厌氧培养48 h后检测菌体量及甘露醇质量浓度,参见图5。
由图5可见,随着接种量的增加,菌体湿重随之增加,而甘露醇的质量浓度在20%的接种量时最多,所以最佳的接种量为20%。
2.6 p H值对甘露醇发酵的影响
改变发酵初始p H值,p H值设定为3.0,4.0,5.0,5.5,6.0,6.5,7.0,8.0,9.0,10.0,发酵时保持p H值不变,参见图6,由图6可以看出发酵时p H值在6.5附近时菌体量最高,低于5.0、高于8.0菌体长势不好。最终发酵的p H值定为6.5。
2.7 温度对甘露醇发酵的影响
将种子转接于发酵培养基中,保持p H值为6.5,于不同温度(20,28,35,40,50℃)下厌氧培养,以菌体湿重为指标考察温度对发酵的影响,参见图7。
由图7可以看出,布氏乳杆菌在35℃生长最好,40℃以上菌体几乎不长。故将发酵温度定于35℃。
2.8 氧气对甘露醇发酵的影响
布氏乳杆菌可以兼性生长,比较了好氧与厌氧2种培养方式对甘露醇产生的影响。好氧发酵条件:装液量50 m L/250 mL,摇瓶旋转培养,转速为180 r/min;厌氧发酵条件:装液量200 mL/250 m L,静止培养。其他条件不变,测定菌体湿重和发酵结束时甘露醇质量浓度,结果见表4。
好氧发酵时葡萄糖的消耗多,菌体生长快,果糖的消耗少,甘露醇生成量低;厌氧发酵时,结果正好相反,葡萄糖的消耗少,菌体生长慢,果糖的消耗多,甘露醇生成量高,验证了厌氧条件下,果糖加氢转化甘露醇的机理。
2.9 碳源质量浓度对甘露醇发酵的影响
图7 温度对CICC 6007菌体生长的影响Fig.7 Effect of temperature on grow th of CICC 6007
表4 氧气对甘露醇发酵的影响Tab.4 Effect of oxygen on mannitol fermentation
由于果糖价格较高,根据异型乳酸发酵的厌氧代谢途径,可以由葡萄糖替代部分果糖的作用,同时可以提高果糖的转化率,以果糖与葡萄糖质量比为2∶1进行发酵,设定总糖质量浓度分别为60,90,120,150,210 g·L-1,其余发酵培养基配方不变,于30 ℃静止培养,发酵48 h,结果见表5。
表5 不同糖质量分数下葡萄糖、果糖、甘露醇的变化量Tab.5 Variation of glucose,fructose and mannitol at different concentration of sugar
表5的结果表明,随着总糖质量浓度的增加,甘露醇的产生量也相应增大,果糖与葡萄糖的消耗比值为2.54~3.06,在总糖质量浓度为150 g/L时,甘露醇的产量趋于稳定,达到68.5 g/L,此时甘露醇对果糖转化率达到78.7%。
3 结 论
1)以布氏乳杆菌(L actobacillus buchneri)CICC 6007为研究菌株,优化了发酵培养基,确立了发酵工艺条件。
2)通过对布氏乳杆菌生长规律的研究,确立了主要工艺条件为厌氧发酵,发酵初始p H值为6.5,发酵温度为35℃,接种龄为36 h,接种量为20%,发酵周期为48 h。
3)当1 L培养基组成为5 g蛋白胨,5 g牛肉膏,5 g酵母膏,2 g柠檬酸二铵,2 g乙酸钠,2 g磷酸氢二钾,50 g葡萄糖,100 g果糖,50 mg M gSO4,50 mg M nSO4,50 mg ZnSO4,1 m L吐温80及1 m L复合维生素时,甘露醇产量为68.5 g/L,甘露醇对果糖转化率达到78.7%。
[1]FURIA T E.Handbook of Food Additives[M].Cleveland:CRC Press,1972.
[2]SONG K H,LEEJ K,SONG H Y,et al.Production of mannitol by a novel strain of candidamagnoliae HH-01[J].Biotech Lett,2002,24:9-12.
[3]LEE J K,OHD K,SONG H Y,et al.Ca2+and Cu2+supp lementation increasesmannitol[J].Biotech Lett,2007,29:291-294.
[4]W ISSEL IN K H W,WEUSTHU IS R A,EGGIN K G,et al.Annitol p roduction by lactic acid bacteria:A review[J].International Dairy Journal,1990,12:151-161.
[5]SOETAERT W,BUCHHOLZ K,VANDAMM E EJ.Production of dmannitol andD-lactic acid by fermentation w ith leuconostoc mesenteroides[J].Agro Food Industry Hi-tech,1995,6:41-44.
[6]SALOU P,LOUB IERE P,PAREILLEUX A.Grow th and energetics of leuconostocoenos during cometabolism of glucose w ith citrate o r fructose[J].App l Environ M icrobiol,1994,60:1 459-1 466.
[7]YUN JW,KIM D H.Comparative study of mannitol p roduction by two lactic acid bacteria[J].Ferment Bioeng,1998,85:203-208.
[8]WEYMARN N,HUJANEN M,LEISOLA M.Production ofD-mannitol by heterofermentative lactic acid bacteria[J].Process Biochem,2002,37:1 207-1 213.
[9]张海英.比色法测定蒙山九州虫草中甘露醇的含量[J].安徽农业科学(Journal of Anhui Agri Sci),2007,35(27):8 523-8 537.
Research in fermentation conditions ofLactobacillus buchneriCICC 6007 for p roduction of mannitol
HOU Jian-ge1,2,WANG Fang2,WANG Li-li2,ZHAO Chang-xin1
(1.School of Biological and Food Engineering,Dalian Polytechnic University,Dalian Liaoning 116034,China;2.Collegeof Biological Science and Engineering,Hebei University of Science and Technology,Shijiazhuang Hebei 050018,China)
The fermentation conditions ofLactobacillus buchneriCICC 6007 fo r p roduction of mannitol were studied in the paper.The results show s that the yield of mannitol is p roportional to the cell wet weight.The culturemedium containing 150 g/L total sugar,in w hich the ratio of fructose to glucose is 3,is inoculated w ith 20%seed culture grow n at 35℃and p H 6.5 for 36 h,then goes to anaerobic fermentation for 48 h.The yield of mannitol is 68.5 g/L and the rate of convertion from fructose to mannitol is 78.7%.
mannitol;fermentation;Lactobacillus buchneri
TQ920.1
A
1008-1542(2010)02-0132-05
2009-11-02;责任编辑:张 军
侯建革(1971-),男,河北灵寿人,高级实验师,硕士研究生,主要从事发酵产品方面的研究。
赵长新教授,E-mail:zhaochangxin@126.com

