脑梗死后运动性失语患者语言中枢的fMRI评价
何雅娜,张 权,张云亭*,宋 明,朱晓冬,陈 静,伊慧明,蒋田仔
1.天津医科大学总医院放射科,300052
2.中国科学院自动化研究所模式识别国家重点实验室,100190
3.天津医科大学总医院神经内科,300052
脑梗死是失语症的最常见病因[1],急性脑梗死患者中约1/3伴发失语。失语症的神经功能学研究一直是脑科学研究中的热门领域,本研究通过基于血氧水平依赖(blood oxygenation level dependent,BOLD)技术的功能性磁共振成像(functional magnetic resonance imaging, fMRI)评价脑梗死后运动性失语患者的脑激活特点。
1 材料与方法
1.1 临床资料
脑梗死患者组:选择脑梗死并发运动性失语的患者15例,入组标准:①首次发病,弥散加权像(diffusion weighted imaging, DWI)检查结果以左额叶梗死为主;②明确的运动性失语,发病前语言功能正常;③神志清楚,无认知障碍,能配合实验;④初中以上文化程度;⑤汉族,右利手;⑥获知情同意,自愿参加实验。其中男14例,女1例,年龄43~77岁。
正常对照组:选择15例正常中老年人作为对照组。年龄、性别及教育程度等与患者组匹配,均获知情同意,自愿参加实验。其中男14例,女1例,年龄46~74岁。
语言行为学测评:采用北京大学第一医院汉语失语症检查法,于fMRI检查前1天对患者及正常志愿者进行语言行为学测评,结果分四级:0~30分为重度,31~60分为中度,61~90分为轻度,91~100分为极轻度。
1.2 实验方法
1.2.1 实验设计:采用组块设计的语言联想任务,要求受试者根据给出的词语以心里默读形式联想属于同类别的词语,如提示语为“水果”,则要求受试者联想“苹果”“菠萝” 等。对照组块共10个时相(一次全脑扫描称为一个时相),为黑色屏幕中心呈现白字“休息”24 s,最后1 s黑屏。任务组块共17个时相,第一个时相为提示语“开始联想”,呈现1.5 s,接1 s黑屏;第二个时相开始依次为4个词语,每个词语呈现9 s,接1 s黑屏,每个任务组块42.5 s。实验包括6个对照组块和5个任务组块,扫描时间共372.5 s,前10 s为适应阶段,不采集数据。
实验完成后,要求受试者报告在MRI环境中的情绪状态,并回忆实验中任务的执行情况,通过即时反馈判断受试者在实验中的任务完成情况。
1.2.2 成像设备和成像参数:采用GE 1.5 T Twin speed infinity with Excite Ⅱ磁共振全身扫描仪及头部正交线圈。对所有受试者进行DWI、3D高分辨T1WI解剖像和fMRI扫描。DWI扫描参数:TR/TE=10000/108 ms,翻转角90°,矩阵128×128,视野24 cm×24 cm,层厚5 mm,层间隔1 mm,层数15。解剖像采用3D梯度回波(gradient echo, GRE)T1加权序列: TR/TE=20/6.0 ms,翻转角15°,矩阵256×256,视野24 cm×24 cm,层厚1.2 mm,层间距0,层数110。fMRI扫描采用GRE-EPI序列:TR/TE=2500/60 ms,视野24 cm, 矩阵64×64,层厚5 mm,层间距1 mm,层数22。
1.2.3 数据分析:采用Statistical Parametric Mapping(SPM2)软件进行分析,预处理包括时间校正、头动校正、空间标准化、空间平滑,然后采用一般线性模型对fMRI数据进行随机效应分析。组内分析采用单样本t检验,组间比较采用两样本t检验,统计阈值设定为P<0.005(未校正),激活体积阈值设定为10个体素。最后将两组激活图及差异图叠加在MNI模板上显示。
2 结果
2.1 数据筛选
在严格控制受试者头动及机械噪声等因素影响后,最终符合实验要求的数据为:患者组10例(均为男性,年龄43~77岁,平均56.7±8.6岁);选取与患者组年龄、性别相匹配的10例男性正常人作为对照组(年龄46~74岁,平均56.2±9.0岁)。将这些数据按照前述统计方法进行分析。
2.2 对照组词语联想任务脑激活结果
对照组脑激活区主要包括Broca区及其镜像区、辅助运动区(supplementary motor area, SMA)、左侧岛叶前部、左侧颞上回及左侧中央前回。对照组词语联想任务脑激活区的解剖位置、激活强度和MNI坐标见表1及图1。
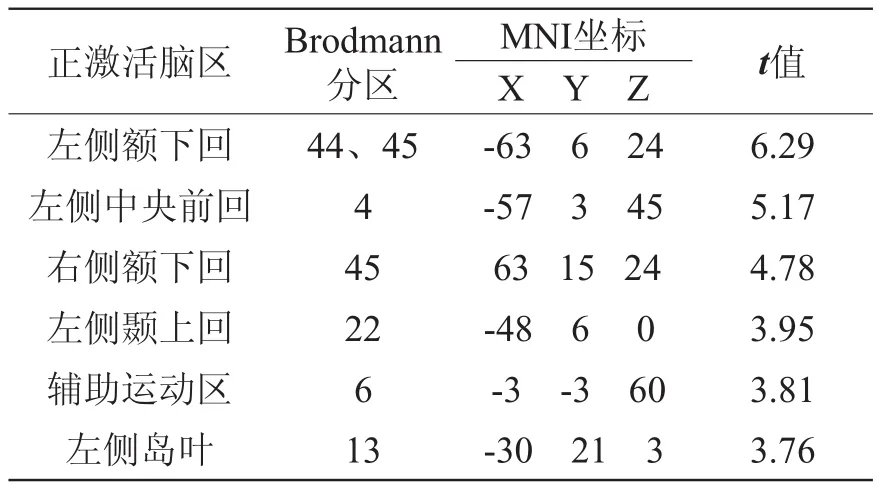
表1 对照组词语联想任务脑激活区解剖位置、激活强度(t值)和MNI坐标
2.3 患者组词语联想任务脑激活结果
患者组脑激活区主要包括左侧额中回、左侧中央后回、左侧顶下小叶、左侧楔前叶;右侧额下回;双侧中央前回、双侧岛叶、双侧丘脑、双侧纹状体、SMA及双侧小脑半球。患者组词语联想任务脑激活区的解剖位置、激活强度和MNI坐标见表2及图2。

表2 患者组词语联想任务正激活脑区解剖位置、激活强度(t值)和MNI坐标

表3 对照组高于患者组的脑激活区解剖位置、激活强度(t值)和MNI坐标
2.4 患者组与对照组词语联想任务脑激活区差异
对照组大于患者组的脑激活区为左侧额下回后部,未见患者组大于对照组的脑激活区。差异脑区的具体解剖位置、激活强度和MNI坐标见表3及图3。
3 讨论
3.1 正常中老年人词语联想任务脑激活区
经典理论认为,语言功能区位于优势半球皮层区,从解剖上分为Broca区、Wernicke区、上语言功能区(SMA)。近年来,fMRI研究表明,除了经典语言功能区外其他脑区的语言功能也被逐渐揭示。Dietmar[2]等行词语联想任务研究,发现除Broca区明显激活外,邻近的额中回、前运动皮层以及SMA、左侧岛叶、纹状体、双侧颞上回也有明显激活。Binder[3]等行语义理解任务的功能磁共振检查时发现了Wernicke区以外的部分颞顶叶皮层区的激活。上述研究结果提示语言是个脑区协同作用的高级功能。
本实验研究显示正常中老年志愿者左侧Broca区、右侧Broca镜像区、SMA、左侧岛叶前部、左侧颞上回、双侧纹状体及右侧小脑半球有明显激活。Broca区为运动性语言中枢,参与计划和执行说话,是传统的语言“表达”或“输出”区域。国外学者[3,4]对正常志愿者行动词生成、词语加工、复杂语义判断等任务时,发现Broca区域激活明显。本研究采用的词语联想任务要求受试者以心里默读的形式完成实验,因此涉及语音及语义处理,支持Broca区参与语音及语义处理过程的观点。右侧半球在语言处理方面的作用也逐渐被认识。一项对37例正常右利手者的fMRI研究发现,有26%的人语义处理网络不局限于左侧半球[5]。Khateb[6]等采用音韵测试和语义分类任务对正常右利手者的fMRI研究显示,在激活左半球相关区域的同时右半球的镜像区域也被激活。本研究右侧Broca镜像区也可见激活,但范围及程度小于左侧半球,说明右侧Broca镜像区也可能存在语言功能。
1996年,Dronkers[7]首次报道了左侧优势半球岛叶具有重要的语言功能。神经解剖学研究发现岛叶和额叶、顶叶、颞叶、扣带回,基底核以及边缘系统都有联系,这些结构连接可能是岛叶发挥语言功能的神经结构基础。本研究显示左侧岛叶前部在词语联想任务下有明显激活,从功能影像学的角度进一步证实岛叶前部参与语言功能的处理。本研究显示左侧颞上回后部激活,此区属于Wernicke区。本研究语言任务未涉及听觉,但听觉语言中枢出现了激活,因此并不能排除颞上回参与词语联想任务的处理。
本研究SMA明显激活。SMA与初级运动区、运动前区外侧面、扣带回前部、前额皮层背外侧面、小脑、基底节及顶叶存在广泛联系。这一复杂解剖关系是SMA进行发动和控制运动功能及语言表达的神经解剖基础。Alario[8]等将SMA分为两部分:①前SMA前部——与选择词语有关;前SMA后部——可能涉及词形信息编码,包括控制音节排序等;②SMA主体部位——与出声发音有关。许多学者[9,10]发现,在不涉及运动的语言任务中,左侧中央前回可有明显的激活,认为中央前回可能参与词语连接与语音处理。本研究推测运动性语言功能的发动与运动功能区具有内在的功能联系,而SMA是发起运动的主要功能区[11],因此其与语言行为之间必然存在密切关系。
基底节具有语言的皮层下整合中枢的作用,可能参与和语言有关的启动效应、逻辑推理、语义处理、言语记忆及语法记忆等复杂的认知和记忆功能,有对语言过程进行加工、整理和协调的作用[12,13]。

图1 对照组词语联想任务脑激活图,P<0.005(未校正),voxel≥10。激活区包括:Broca区及其镜像区、辅助运动区(SMA)、左侧岛叶前部、左侧颞上回及左侧中央前回

图2 患者组词语联想任务脑激活图,P<0.005(未校正),voxel≥10。激活区包括:左侧额中回、左侧中央后回、左侧顶下小叶、左侧楔前叶;右侧额下回;双侧中央前回、双侧岛叶、双侧丘脑、双侧纹状体、SMA及双侧小脑半球
近年来许多学者发现小脑在语言生成及语义理解方面发挥了重要的作用,而且强调小脑具有的语言功能与大脑一样存在偏侧性,而且与大脑语言优势之间存在交叉性。揭冰[14]等fMRI研究发现右侧小脑半球可能参与语义判断。Riecker[15]等进行功能连接研究也发现右侧小脑上部与SMA、左侧额下回及左侧岛叶前部有相关性。本研究对受试者进行词语联想任务发现右侧小脑上部明显激活,与文献一致,进一步证明了右侧小脑上部在语言生成中的作用。

图3 词语联想任务对照组高于患者组的脑激活区,P<0.005(未校正),voxel≥10。激活区为左侧额下回后部
3.2 脑梗死患者词语联想任务脑激活区
本研究对脑梗死患者进行fMRI检查时间约为发病后1~2周,失语评分平均值22.8±8.4分,均为中重度失语,尽可能排除发病时间和失语程度差异过大对结果的影响。此外,本研究用中老年志愿者作为正常对照,保证了两组间年龄匹配。
本研究患者组词语联想任务的正激活脑区主要包括右侧Broca镜像区、岛叶及SMA,此外,左侧额中回、中央后回、顶下小叶、楔前叶,双侧中央前回、丘脑、纹状体及小脑半球也可见不同程度的激活。与对照组比较,发现脑梗死后左侧Broca区无明显激活,而左侧Broca区邻近区域(包括运动前区、中央前回)、SMA及右侧Broca镜像区激活范围及程度明显增加,与文献报道一致[16]。
脑梗死发生后,除相应语言功能区发生损伤、激活程度减低以外,将会发生语言功能网络中未受累部分的功能重建和新功能区的出现,其病理基础在于这些脑组织神经元的树突及突触的新生[17]。Wise[18]等对左额下回梗死导致的运动性失语的右利手患者康复治疗后的fMRI研究发现,语言任务除激活右额下回外,左侧梗死灶周边未受累的区域也被激活。可见左侧Broca区梗死后,其周围区域以及右侧的Broca镜像区发生代偿。本实验研究的结果与上述文献报道一致。
在Crosson[19]的经典模型中,强调了丘脑(特别是左侧丘脑枕)在语言处理及监控功能中的重要作用。Kraut[20]等发现丘脑在特征语义约束及同义词任务中有明显激活。Wallesch[21]综述了皮层下梗死的病例,并提出了皮层-纹状体-丘脑-皮层环路,此环路除涉及运动功能外,对语言功能也起重要作用。在此环路中,丘脑主要负责词汇信息的逻辑整合,本研究患者组丘脑明显激活可能是一种更高级功能活动的代偿。
本研究患者组左侧小脑明显激活,说明小脑与大脑语言优势半球之间存在交叉性,左侧小脑的激活与脑梗死后右侧Broca镜像区的激活增加有关。
3.3 患者组与对照组词语联想任务激活脑区的组间比较
对照组与患者组的组内分析分别得出了两组各自的脑功能激活区,但只从两组的组内结果进行分析并不全面,所以本研究采用双样本t检验进一步分析组间差异。结果显示对照组较患者组激活明显加强的脑区主要分布于左侧额下回后部,其中大部分为Broca区,说明脑梗死患者Broca区的激活较对照组明显减弱,Broca区作为运动性语言中枢,其损伤导致患者运动性失语。
组间比较统计结果并没有发现患者组激活高于对照组的脑区,这可能与统计阈值的选择有关。患者组组内结果显示激活区较对照组增多,本组数据采集时间均为发病两周以内,可能语言功能重组或其他脑区的代偿作用尚未达到一定程度,激活结果尚未达到所设统计阈值,因此并不能排除这些区域的价值,如能进一步对患者进行长期追踪研究,可能会发现某些激活明显高于对照组的脑区。
总之,与正常中老年人相比,脑梗死后运动性失语患者左侧额下回后部(Broca区)激活程度减低或消失,说明运动性语言中枢的损伤导致了失语症的发生。
[1]Wade D, Hewer R, David R, et al.Aphasia after stroke: Natural history and associated deficits.J Neurol Neurosurg Psychiatry, 1986, 49(1):11-16.
[2]Dietmar C, Haughton K.Mapping functionally related regions of brain with functional connectivity MR imaging.AJNR Am J Neuroradial, 2000, 21(9): 1636-1644.
[3]Binder J, Frost J, Hammeke T, et a1.Human brain language areas identified by functional magnetic resonance imaging.J Neuroimaging, 1997, 17(1): 353-362.
[4]Petersen S, Fox P, Posner M, et al.Positron emission tomographic studies of the cortical anatomy of singleword processing.Nature, 1988, 331(6157): 585-589.
[5]Cao Y, Vikingstad EM, George KP, et al.Cortical language activation in stroke patients recovering from aphasia with functional MRI.Stroke, 1999, 30(11): 2331-2340.
[6]Khateb A, Martory M, Annoni J, et a1.Transient crossed aphasia evidenced by functional brain imagery.Neuroreport, 2004, 15(5): 785-790.
[7]Dronkers N.A new brain region for coordinating speech articulation.Nature, 1996, 384(6605): 159-161.
[8]Alario F, Chainay H, Lehericy S, et al.The role of the supplementary motor area (SMA) in word production.Brain Res, 2006, 1076(1): 129-143.
[9]Karbe H, Thiel A, Weber-Luxenburger G, et al.Brain plasticity in poststroke aphasia: what is the contribution of the right hemisphere.Brain Lang, 1998, 64(2): 215-230.
[10]Paulesu E, Frith C, Frackowiak R.The neural correlates of the verbal component of working memory.Nature,1993, 362(6418): 342-345.
[11]Allison J, Meador K, Loring D, et al.Functional MRI cerebral activation and deactivation during finger movement.Neurology, 2000, 54(1): 135-137.
[12]季倩,郑凯尔,陈峰居,等.fMRI在正常人听觉性语言中枢及脑肿瘤定位中的研究.中华神经外科杂志, 2007,23(5):335.Ji Q, Zheng KE, Chen FJ, et al.Functional MRI evaluation on linguistic center of auditory function in normal volunteers and the location of brain neoplasms.Chin J Neurosurg, 2007, 23(5):335.
[13]Gil Robles S, Gatignol P, Capelle L, et a1.The role of dominant striatum in language: a study using intraopemtive electrical stimulations.J Neurol Neurosurg Psychiatry, 2005, 76(7): 940-946.
[14]揭冰,赵小虎,杨振燕,等.小脑语言功能的fMRI初步评价.同济大学学报:医学版, 2005, 26(6): 22-25.Jie B, Zhao XH, Yang ZY, et al.The language function of cerebellum: A fMRI study.J Tongji Univ (Med Sci),2005, 26(6): 22-25.
[15]Riecker A, Mathiak K, Wildgruber D, et al.fMRI reveals two distinct cerebral networks subserving speech motor control.Neurology, 2005, 64(4): 700-706.
[16]Ino T, Tokumoto K, Usami K.Longitudinal fMRI study of reading in a patient with letter-by-letter reading.Cortex, 2008, 44(7): 773-781.
[17]Carmichael S, Chesselet M.Synchronous neuronal activity is a signal for axonal sprouting after cortical lesions in the adult.J Neurosci, 2002, 22(14), 6062-6070.
[18]Wise R.Language systems in normal and aphasic human subjects: functional imaging studies and inferences from an imal studies.Br Med Bull, 2003, 65(1): 95-119.
[19]Crosson B.Models of subcortical functions in language:current status.J Neurolinguist, 1997, 10(4): 277-300.
[20]Kraut M, Kremen S, Segal J, et al.Object activation from features in the semantic system.J Cogn Neurosci, 2002,14(1): 24-36.
[21]Wallesch C.Symptomatology of subcortical aphasia.J Neurolinguist, 1997, 10(4): 267-275.

