扩散加权成像在低级别胶质瘤的鉴别诊断价值
钱银锋,殷敏敏,余永强
胶质瘤是脑内最常见的原发性肿瘤,而低级别胶质瘤约占胶质瘤的15%~25%[1]。世界卫生组织将Ⅱ级星形细胞瘤(astrocytoma, AC)、单纯型少突胶质细胞瘤(oligodendroglioma, OD)和混合型少突星形细胞瘤(oligodendroastrocytoma, OA)称为低级别胶质瘤。低级别胶质瘤中各亚型的肿瘤常规MRI影像相近且互有交叉,难以将其明确区分;但低级别的星形细胞瘤与少突胶质细胞肿瘤的治疗方法却有着明显不同,少突胶质细胞肿瘤对化疗比较敏感[2]。因此术前明确区分低级别胶质瘤中各亚型有着重要的临床意义。目前,磁共振扩散加权成像(diffusion-weighted imaging, DWI)在脑肿瘤的诊断和鉴别诊断方面具有一定的价值,但在低级别胶质瘤鉴别中文献少有报道,笔者通过对21例脑内低级别胶质瘤的DWI及表观扩散系数(apparent diffusion coefficient, ADC)图进行定性和定量分析,探讨DWI在低级别胶质瘤鉴别诊断中的临床应用价值。
1 资料与方法
收集自2005年5月-2008年12月本院21例颅脑肿瘤患者,男13例,女8例,年龄25~65岁,平均41岁。手术病例证实其中AC 9例,OD 5例,OA 7例。
使用GE Signa 1.5 T超导型MR成像仪,标准头颅线圈,所有病例均行常规T1WI、T2WI、FLAIR和DWI扫描,DWI使用SE-EPI序列,其扫描参数为:TR 10000 ms,TE 111~119 ms,层厚9 mm,层间隔1 mm,视野(FOV) 26 cm×26 cm,矩阵256×192,在X、Y、Z轴共3个方向上施加扩散梯度,扩散敏感因子(b)值分别为0和1000 s/mm2。常规平扫和DWI结束后行增强扫描,对比剂使用钆喷替酸葡甲胺(Gd-DTPA),剂量0.1 mmol/kg,静脉注射,注完药后即行轴位、矢状位和冠状位扫描。
将DWI图像传送至工作站用Fuctool软件进行处理。分别测量瘤体实质部分和瘤周水肿及对侧脑白质的ADC值和EDC值(exponent diffusion coefficient,指数扩散系数值),按公式rADC=ADC肿瘤/ADC对侧计算瘤体和瘤周水肿的rADC值(relative apparent diffusion coefficient,相对表观扩散系数值),以同样的方法计算rEDC值(relative exponent diffusion coefficient,相对指数扩散系数值)。选取肿瘤实质部分的兴趣区(ROI)时,以手工绘制,以期有较好的代表性,注意避开肿瘤坏死部位,尽可能消除由于容积效应而引起的测量误差,在实质区取2~4个ROI,每个ROI约40~60 mm2,取其平均值,对侧正常白质区ROI约40~60 mm2。由于胶质瘤瘤周存在浸润渐变现象,为了保证测量的一致性,本组在瘤周1 cm以内的水肿区选取ROI,依据T2WI放置瘤周水肿兴趣区,大小约80~100 mm2。
统计三种胶质瘤各参数值,多组间比较采用方差分析(ANOVA),组间两两比较用LSD检验。所有统计均用SPSS 11.0统计软件包进行,统计结果以均数±标准差表示,以P<0.05判定差异有无统计学意义。
2 结果
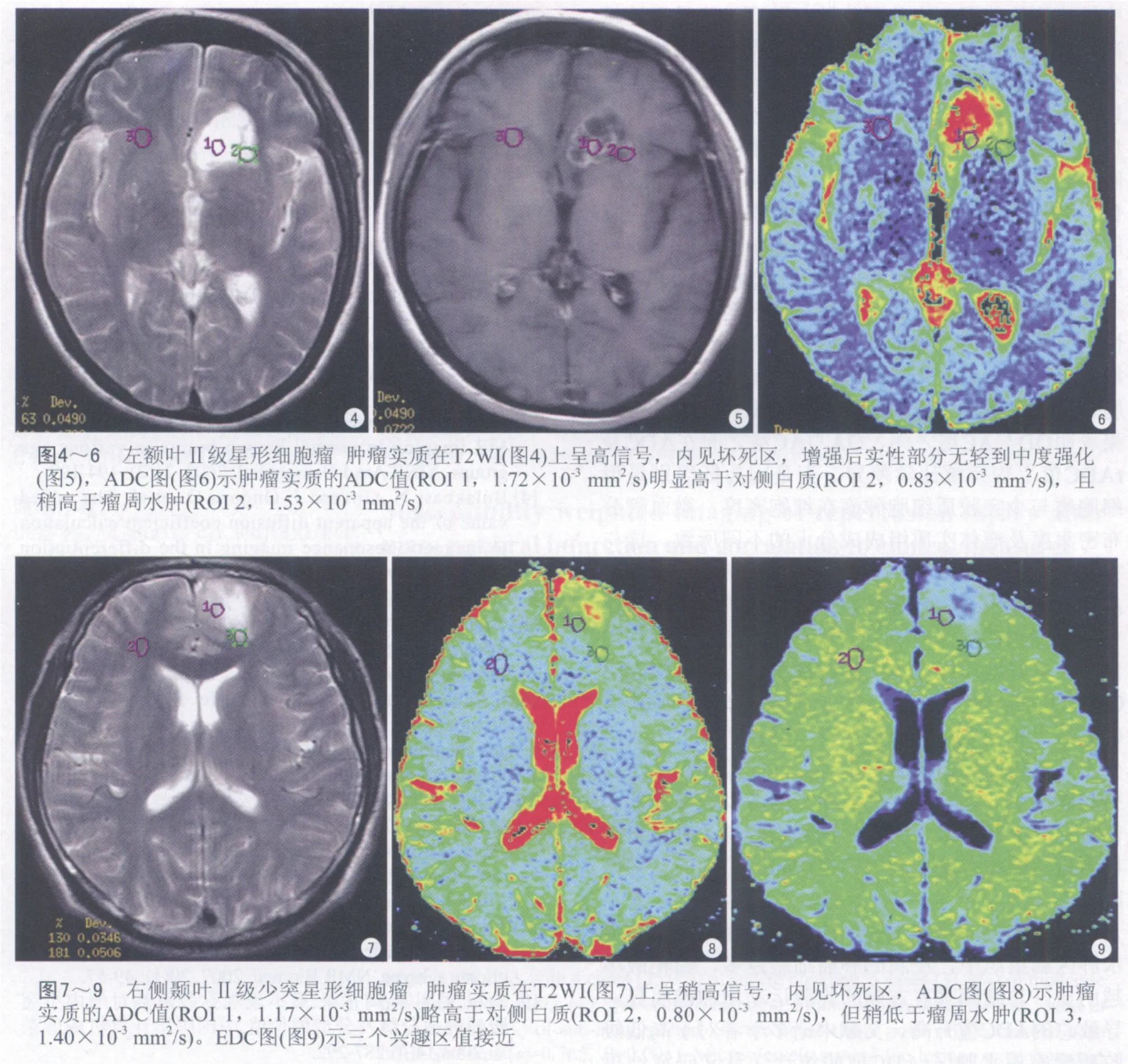
三组肿瘤实质的ADC、EDC值及rADC、rEDC计算结果见表1,由表可知OD组(图1~3)与AC组(图4~6)四种参数之间、OA组(图7~9)与AC组四种参数之间均有明显统计学差异(P<0.01),但OD组与OA组之间无明显统计学差异(P>0.05)。

表1 各组肿瘤实质ADC、rADC、EDC、rEDC值
三组肿瘤瘤周水肿的ADC、EDC值及rADC、rEDC计算结果见表2,由表可知三组低级别胶质瘤间的四种参数均无统计学差异(P>0.05)。
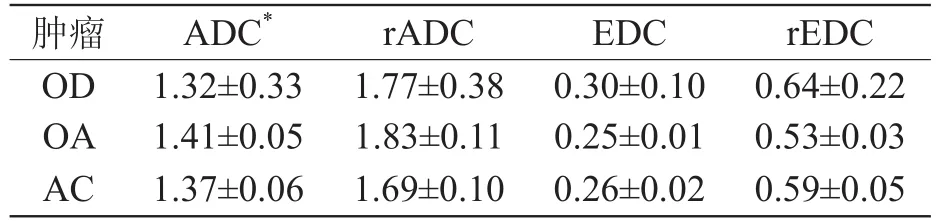
表2 各组肿瘤瘤周水肿的ADC、rADC、EDC、rEDC值

3 讨论
低级别胶质瘤在常规MRI上具有相似的表现,均表现为T1WI低信号,T2WI及FLAIR呈不同程度高信号,无囊变病灶增强扫描或不强化,或轻微强化,囊变病灶则囊变边缘可见强化。AC、OD和OA三者影像上不易准确区分。用DWI对脑肿瘤进行定性、定量分析是近年来的研究热点,使脑肿瘤的诊断从以往的仅注重大体的、形态学的研究上升到微观的、形态与功能并重的研究,对常规MRI检查是个有益的补充。
DWI是利用水分子的扩散运动来反映正常与病变组织的空间结构变化,从而对疾病进行诊断与鉴别。由于影响DWI信号的因素较多,因此,临床上常用ADC值来反映病变的扩散程度。ADC值与DWI信号呈负指数关系,ADC值增大,代表水分子扩散加快,相应DWI信号降低。由于正常人脑白质的ADC正常值范围较大[3],rADC值为病灶与对侧正常脑白质区的ADC值比值,能消除个体生理因素、不同图像之间、机型、扫描参数以及序列对ADC值的影响,并使ADC值标准化[4]。本研究采用随机分析软件包Functool进行分析,该软件不但提供了ADC图,还提供了EDC图,EDC图消除了DWI中T2透射效应的影响,能真实反映组织的扩散情况,其作用与ADC图相似。
影响脑肿瘤病变DWI信号以及ADC值的因素较多,肿瘤细胞数目密集、体积较大或具有特殊的空间排列均能限制水分子弥散;肿瘤细胞异型性越高,细胞器则越丰富,体积越大,将降低细胞内水分子的弥散;大的细胞间隙对细胞外水分子的运动影响不大,小的细胞间隙则限制其运动[5,6]。少突胶质细胞瘤经典病理表现为中等细胞密度,核均匀,圆形,大小一致,胞浆肿胀、透明,还常见微钙化、黏液囊性变以及由密集的分支状毛细血管组成的“鸡爪状”(chicken-wire pattern)血管网[7]。低级别星形细胞瘤病理表现为肿瘤细胞密度低,肿瘤中可能保留正常脑组织,钙化少见,轻至中度核多型性,核分裂少见,异常增生血管轻微,没有或少见坏死等。混合型少突星形细胞瘤则是在少突胶质细胞瘤基础上多了实质的星形细胞成分。本组资料结果表明OD与AC组之间、OA与AC组之间在ADC及rADC值上均有统计学差异,正是因为低级别星形细胞瘤与少突胶质细胞肿瘤在细胞密度、微血管分布密集度及瘤体实质组成成分上的不同所致。这与Tozer[8]等的研究结果一致。笔者在测量肿瘤实质的ADC值是多点选取兴趣区,并取其平均值,这样避免肿瘤细胞在瘤体中因为分布不均匀造成的测量的偏差,更好地反应瘤体实际的情况。本组资料表明OA与OD的4种参数无明显统计学差异,与刘权[9]等研究结果相一致。考虑为尽管二者在病理上组成成分不完全相同,但细胞密度等方面的差异尚不足以引起DWI上的差异;此外,由于两者发病率均低,已有的研究及本组中二者病例数均较少,进一步大样本量总结将有助于准确确定DWI对二者的鉴别诊断价值。
因为胶质瘤浸润生长、瘤细胞散在分布于瘤周水肿区脑组织中,浸润的肿瘤细胞越多,髓鞘破坏越明显,与髓鞘垂直方向的弥散运动增加越明显,导致总的ADC值升高。文献中诸多学者对于高低级胶质瘤瘤周水肿区rADC值的统计学意义研究结果多不相同,差别较大[10]。本组资料显示三种低级别胶质瘤瘤周水肿的ADC、rADC、EDC、rEDC值均无明显统计学差异。考虑为三组肿瘤皆是同级别胶质瘤,本研究在瘤周1 cm范围内选择瘤周水肿兴趣区,此范围内三种肿瘤浸润的细胞量、髓鞘破坏程度等无明显差异所致。但亦有文献报道高、低级别胶质瘤瘤周水肿区的rADC值无统计学差异[11]。瘤周水肿ADC值受浸润的肿瘤细胞数量,髓鞘破坏程度、血管源性水肿程度、兴趣区的选择等多重因素的影响,内容较为复杂,需进行综合分析。
总之,本研究结果表明DWI有助于低级别少突胶质细胞瘤和少突星形细胞瘤与低级别星形细胞瘤间的鉴别,但在区分低级别少突胶质细胞瘤和少突星形细胞瘤间价值有限。
[1]Louis DN, Ohgaki H, Wiestler OD, et a1.The 2007 WHO Classification of Tumours of the Central Nervous System.Acta Neuropathol, 2007, 114(2): 97-109.
[2]Ino Y, Betensky RA, Zlatescu MC, et a1.Molecular subtypes of anaplastic oligodendroglioma: implications for patient management at diagnosis.Clin Cancer Res, 2001,7(4): 839-845.
[3]Helenius J, Soinne L, Perkio J, et al.Diffusion-weighted MR imaging in normal human brains in various age groups.AJNR Am J Neuroradiol, 2002, 23(2): 194-199.
[4]Bulakbasi N, Guvenc I, Onguru O, et al.The added value of the apparent diffusion coefficient calculation to magnetic resonance imaging in the differentiation and grading of malignant brain tumors.J Comput Assist Tomogr, 2004, 28(6): 735-746.
[5]Calli C, Kitis O, Yunten N, et a1.Perfusion and diffusion MR imaging in enhancing malignant cerebral tumors.Eur J Radiol, 2006, 58(3): 394-403.
[6]Stadlbaner A, Gansdandt O, Buslei R, et a1.Gliomas:histopathologic evaluation of changes in directionality and magnitude of water diffusion at diffusion-tensor MR imaging.Radiology, 2006, 240(3): 803-810.
[7]乔广宇,桂秋萍,王福林.少突胶质细胞瘤的病理和分子生物学进展.军医进修学院学报,2006,27(2):158-159.Qiao GY, Gui QP, Wang FL.Histopathologic and molecular biological progress of oligodendroglioma.Acad J PLA Postgraduate Med School, 2006,27(2):158-159.
[8]Tozer DJ, Jager HR, Danchaivijitr N, et al.Apparent diffusion coefficient histograms may predict low-grade glioma subtype.NMR Biomed, 2007, 20(1): 49-57.
[9]刘权,彭卫军,周正荣.最小表观弥散系数对颅内少突胶质肿瘤分级及分型的价值.中国医学计算机成像杂志,2008,14(4):287-292.Liu Q, Peng WJ, Zhou ZR.Oligodendroglial tumors: can relative apparent diffusion coefficient be used in prediction of tumor grade and subtype.Chin Computed Med Imaging, 2008,14(4):287-292.
[10]Bulakbasi N, Kocaoglu M, Ors F, et al.Combination of single-voxel proton MR spectroscopy and apparent diffusion coefficient calculation in the evaluation of common brain tumors.AJNR Am J Neuroradiol, 2003,24(2): 225-233.
[11]Kono K, Inoue Y, Nakayama K, et a1.The role of diffusion-weighted imaging in patients with brain tumors.AJNR Am J Neuroradiol, 2001, 22(6): 1081-1088.

