磁共振弥散加权及张量技术在新生儿缺血缺氧性脑病中的应用
穆 靓,杨 健,鱼博浪
缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是新生儿危害最大的常见病之一。新生儿HIE的病死率高、神经后遗症多见,给家庭和社会造成了极大的危害。所以,对新生儿HIE的影像诊断和预后评定方法研究始终是一项直接关系国民素质和生活质量的重要医学课题。
近年来的研究发现,磁共振弥散加权成像(diffusion-weighed imaging, DWI)和弥散张量成像(diffusion-tensor imaging, DTI)技术在该疾病的早期诊断、量化评估和预后分析、超微结构与功能变化研究等方面具有明显的优势和前景,本文将对其展开系统回顾。
1 HIE的病理生理学机制及损伤特点
由于新生儿神经系统发育的特殊性,其对缺血缺氧更为敏感,损伤的病理生理机制复杂,主要呈级联反应式表现(见图1)。
足月新生儿HIE的损伤部位主要集中在髓鞘形成旺盛区、NMDA受体密集区和脑血管分布的分水岭地带(矢状旁区为主,见图2右侧)。轻中度HIE时,脑血流自动调节使得血管分水岭区处于血流低灌注,该区域皮层以及皮层下白质受损明显。
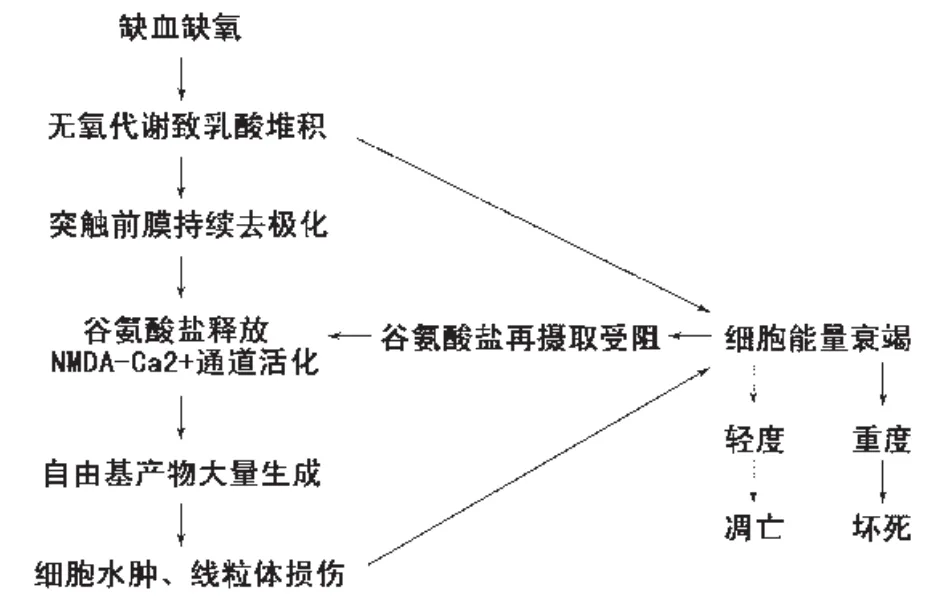
图1 缺血缺氧性脑损伤时病理生理级联式反应示意图Fig.1 Diagram illustrates the cascade of events contributing to brain injury in hypoxic-ischemic.

图2 早产儿与足月儿脑血管及轻中度HIE易损区分布图。左侧为早产儿,易损区位于侧脑室周围;右侧为足月儿,易损区位于矢状旁区。细箭头:趋脑室动脉;粗箭头:离脑室动脉Fig.2 Patterns of vascular supply and the vulnerable regions of preterm and term brain in mild to moderate hypoperfusion.Schematic of the preterm infant(left)and that of the term infant(right) illustrates how the vascular supply changes with maturation and affects the pattern of brain injury in HIE.Small arrow(left)means ventriculopetal artery, and big arrow(right)means ventriculofugal artery.
由于早产儿(<36孕周)与足月新生儿脑血管分布及其模式的不同,对于轻中度HIE,易损区域存在着明显差异(见图2左侧)。早产儿侧脑室周围白质血流量仅为灰质的1/4,发生损伤时,室周脑白质最易受损,这是早产儿易出现脑室周围白质软化症(periventricular leukomalacia, PVL)的根源。另外,当缺氧缺血后再灌注时,室周生发基质极易出血,这与早产儿生发基质毛细血管单层内皮发育不成熟、富含线粒体且对缺氧敏感有关[1]。所以,早产儿易出现侧脑室内出血(intraventricular hemorrhage,IVH)。
足月儿重度HIE以深部灰质(壳核、丘脑腹外侧核、海马、脑干背侧、外侧膝状体等)和中央前回皮层(the perirolandic cortex)为主,若损伤持续时间较长,皮层亦可广泛损伤。早产儿重度HIE主要表现为丘脑、基底节区、海马、小脑及皮质脊髓束损伤,由于丘脑、苍白球髓鞘化早于纹状体与中央前回,所以早产儿丘脑、前蚓部以及脑干背侧更常受累。
2 DWI及DTI的原理及其参数
弥散(diffusion)是水分子的随机运动,即布朗运动。通过施加弥散敏感梯度,DWI可以反映水分子的弥散运动幅度。由于该成像过程并不能区别分子运动的原因:如热梯度、压力梯度以及离子间的相互作用,因而DWI所测量的分子运动只能以表观弥散系数(apparent diffusion coefficient, ADC)来表示,该参数有效地去除了DWI中的“T2效应”。
DTI则可在DWI基础上,施加大于6个非线性方向的梯度场,获取能描述水分子运动方向的张量图像。根据水分子弥散的受限程度,弥散分为各向同性(isotropy)弥散(运动轨迹近似一个圆球体)和各向异性(anisotropy)弥散(运动轨迹近似一个椭球体)。圆球体、椭球体的半径称之为本征向量(eigenvector,v),其数值大小为本征值(eigenvalue, λ),而椭球体中最大半径为主本征向量,其数值大小称为主本征值。目前主要采用3个本征值(λ1、λ2和λ3)来反映单个体素的走行方向,由其演化出的常用DTI参数如下:
⑴平均弥散系数(average diffusion coefficient,Dav):主要反映弥散运动的快慢而忽略弥散方向,采用弥散张量的痕量(trace),即三个本征值之和来表示,取其平均值即得到每一像素的Dav,更加全面反映弥散快慢。

⑵部分各向异性(fractional anisotropy, FA)或称各向异性分数:
FA是弥散各向异性与整个弥散的比值,FA 值从0 (最大各向同性) 到1 (最大各向异性) 。
⑶相对各向异性(relative anisotropy, RA):
⑷轴位弥散张量λ∥(axial diffusivity, AD):代表最大弥散张量方向的弥散范围,是弥散张量的第1个

本征值。可以用来表征平行神经纤维轴索方向的弥散,反应神经轴索的数量、粗细和病理变化情况。

⑸垂直弥散张量λ⊥(radial diffusivity, RD):代表垂直于最大弥散方向的张量,是第2及第3本征值的平均值。可以用来表征垂直于神经纤维轴索方向的弥散,间接反映髓鞘的发育和完整性,及病理变化情况。随着模拟轴索数量的增加,阻力改变,弥散张量亦改变(见图3)。


图3 随模拟的轴索数量增加弥散张量变化示意图AD左>AD右,RD左>>RD右,FA左<FA右Fig.3 Schematic diagram of anisotropy changes with the increasing axonal simulation.ADleft>ADright, RDleft>>RDright,FAleft<FAright.
3 DWI及ADC图在HIE中的应用研究
DWI技术可以及时反映脑缺血早期细胞内水肿所致的弥散受限。大鼠HIE实验表明,阻断单侧颈内动脉1~2小时甚至20分钟之内[2,3],细胞性水肿所致的弥散受限在DWI上有高信号、ADC图有低信号表现,DWI异常范围与病理梗死大小相一致,而普通MRI的T2WI在24小时以后才能显示信号改变。目前,HIE的有效支持疗法之一是亚低温治疗,尤其对轻型HIE治疗更加有效,其最佳治疗窗是损伤后2~6小时[4],DWI及ADC图可以早期、及时地发现细胞内水肿,为亚低温治疗提供依据。
ADC值的下降变化过程可以评估HIE的损伤程度,并提示预后。ADC值明显下降表明脑损伤严重,尤其当基底节、丘脑T1WI、T2WI以及DWI均没有异常信号表现而ADC值明显降低时,表明神经系统预后不良[5]。根据大鼠顶叶皮层缺血缺氧性的严重度,可以将ADC的改变分为三种类型[6]:ADC持续下降型(重度缺血缺氧)、ADC双期下降型(中度缺血缺氧)及ADC短暂下降型(轻度缺血缺氧)。中重度缺血缺氧最终平均ADC值范围分别为中度4.08±0.37×10-4mm2/s、重度3.93±0.28×10-4mm2/s,病理改变为脑组织梗死;轻度缺血缺氧最终平均ADC值范围为4.97±0.40×10-4mm2/s,病理改变为选择性神经元死亡。轻度缺血缺氧出现短暂性的ADC值下降,随后会迅速恢复正常,此时并不能代表神经元的完全恢复,而是仍然会有部分神经元凋亡的产生[3],损伤后及时予以神经保护性治疗可以尽量挽救神经组织,具有治疗价值。
DWI以及ADC的信号改变可以反映细胞分子水平的信息变化。少突胶质细胞前体细胞是有氧剥夺的易损细胞,线粒体功能的异常协同谷氨酰胺的聚集对其存在毒性损伤[7,8],最终导致细胞凋亡基因的启动,活化的caspase-3被认为是caspase基因家族中细胞凋亡内、外通道的最终执行者。HIE损伤后24小时,ADC信号减低趋势与caspase-3的活化存在明显的时空相关性[9],反映了细胞因子、炎性介质导致的凋亡机制发生。
随着年龄增加,脑组织髓鞘不断发育,神经元逐渐修饰成熟,脑组织含水量减少,ADC值可随之降低[10]。对于HIE的诊断,需根据孕周,重点观察患儿的易损区域,并将ADC图与常规MRI信号对比观察。HIE时,DWI、ADC图及常规MRI信号改变复杂多样[11-14](见图4)。
由图中信号变化也可以发现,虽然DWI以及ADC图可以及时显示HIE的发生,但是随着时间推移,细胞性水肿减轻,血管性水肿加重,当两者处于平衡期时,大约是新生儿HIE之后1周,DWI呈现假阴性表现,此时需要结合其他影像检查以防止漏诊。
总之,HIE的实验动物模型和临床MRI表现纷繁复杂,影像学诊断时需要密切结合脑发育的特点,同时根据发病类型、损伤的严重程度和发病时间,合理选择MRI检查方法综合分析。ADC图可在HIE的早期诊断、损伤判定、预后分析等方面提供有利的支持。

图4 新生儿重度HIE的DWI、ADC及常规MRI信号改变图。注:↑↑表示信号明显升高,↑代表信号轻度升高,-代表阴性发现,↓↓代表信号明显下降,↓代表信号轻度下降,*代表新生儿缺血缺氧;粗线箭头为合并出血时信号改变Fig.4 Different signal intensity of newborn severity HIE with DWI, ADC and conventional MRI.↑↑shows significant increase of signal intensity, ↑ shows slight increase of signal intensity, - shows no change,↓↓shows significant decrease of signal intensity,↓ shows slight decrease of signal intensity.Asterisk illustrates neonatal hypoxic ischemic.Big arrow illustrates hemorrhage at the same time.
4 DTI在HIE中的应用研究
HIE时DTI持续性的信号改变,反应细微结构的异常,弥补了DWI出现假正常化期的不足。弥散张量纤维束成像(diffusion tensor fiber tractography, DTIFT)通过显示HIE所致主要纤维通路的损伤,可以直观显示HIE解剖构造的变化与脑功能区域的关联。
目前研究表明,HIE时FA值常是下降的,这与病理改变相一致。缺血缺氧时,细胞水肿,轴索断裂,细胞外间隙缩小,细胞外水分子的弥散运动明显受限,各向异性程度减低。所以,FA值可以量化评估HIE的病情轻重[15,16],FA值下降越明显,损伤程度越严重。
由于疏水的细胞膜和髓鞘的作用,水分子的弥散运动在与神经纤维走行一致的方向受到的限制最小,表现为水分子在有髓白质纤维中沿着平行于纤维方向的弥散速度快于沿垂直于纤维方向的弥散速度。AD和RD可以用来反映轴索和髓鞘的精细解剖结构变化,但是目前该方面尚鲜有DTI临床应用的报道。
大量的动物实验表明:AD以及RD的改变不仅可以提示HIE的损伤程度,更能够为预后提供参考。当髓鞘形成不良或脱失时,垂直于轴索的水分子的运动障碍明显减轻,RD明显升高,随着少突胶质细胞的增生、髓鞘的修复,RD升高幅度将减低[17,18]。若轴索损伤,平行于轴索方向水分子的运动明显受限,AD值一般是降低的,随着轴索的恢复,AD可以有所回升[19]。轻度损伤时,髓鞘变薄脱失(RD增高)。重度损伤时,会出现严重的轴索受损、神经元死亡等脑组织结构破坏(AD下降),其恢复能力将微乎其微,尤其是AD、RD都明显降低,提示不可逆性神经损伤(见表1)。以上DTI量化参数的变化与组织病理学改变具有良好的一致性[15,20,21],可以反映轴索和髓鞘的结构改变。
由于HIE易发生于白质纤维走行区域,尤其见于PVL。DTI-FT会显示相应纤维束的长度缩短、走行偏移及纤维数量、容积缩小等异常,特别是皮质脊髓束、皮质延髓束等主要神经纤维通路,DTI-FT可清晰显示其变化,结合3D彩色张量图,可以确定周围毗邻的主要的白质纤维束方向的受累程度[22,23]。对于小的纤维环路如小脑-丘脑-皮层环路,因分辨率等原因常显示欠佳,这有待于磁共振弥散波谱成像(diffusion spectrum imaging, DSI)等更先进技术的临床应用[24]。另外,DTI-FT与脑功能MRI(fMRI)综合应用,可以将脑组织的解剖与功能相结合,从神经通路水平解释HIE的临床表现。
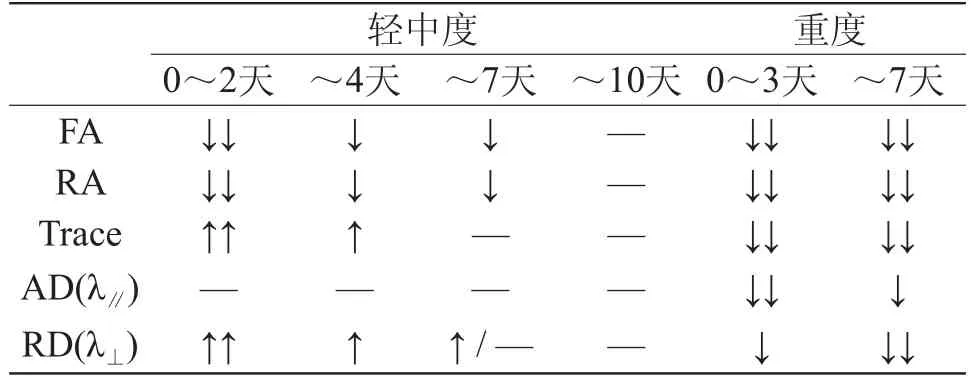
表1 外囊区实验大鼠HIE各项DTI参数变化趋势表
5 展望
目前,随着围产期医疗技术的不断提高,重度HIE的发病率已明显下降,而轻型HIE的发病率正不断升高。研究表明:轻型HIE与儿童认知功能障碍、小儿多动症等疾患密切相关[25,26]。轻型HIE的解剖形态学异常表现细微,在常规MRI上常难以用肉眼来识别。以往多靠常规MRI序列三维采集,脑灰、白质分割和计算容积后[27,28],采用量化分析得出结果,该技术尚不能对细微损伤进行明确定位。DTI多参数测量和神经纤维束跟踪技术为轻型HIE的诊断开启了新的途径,随着DTI衍生序列与技术的开发和应用,以及专用分析平台(如tract-based spatial statistics, TBSS)的完善[29],尤其是DTI和fMRI的结合,将为HIE的MRI早期诊断、预后评估、疗效评价提供新的有益支持和保证,具有明显的临床应用优势。
[1]Huang BY, Castillo M.Hypoxic-ischemic brain injury:imaging findings from birth to adulthood.Radiographics,2008,28(2):417-439; quiz 617.
[2]Wang Y, Cheung PT, Shen GX, et al.Hypoxic-ischemic brain injury in the neonatal rat model: relationship between lesion size at early MR imaging and irreversible infarction.Am J Neuroradiol, 2006,27(1):51-54.
[3]Tomoko H, Naoyuki M, Toshihiko K, et al.Transient ADC change precedes persistent neuronal death in hypoxic-ischemic model in immature rats.Brain Res,2006,1100(1):136-141.
[4]Gluckman PD, Wyatt JS, Azzopardi D, et al.Selective head cooling with mild systemic hypothermia after neonatal encephalopathy: multicentre randomised trial.Lancet, 2005,365(9460):663-670.
[5]Liauw L, van Wezel-Meijler G, Veen S, et al.Do apparent diffusion coefficient measurements predict outcome in children with neonatal hypoxic-ischemic encephalopathy?Am J Neuroradiol, 2009,30(2):264-270.
[6]Miyasaka N, Nagaoka T, Kuroiwa T, et al.Histopathologic correlates of temporal diffusion changes in a rat model of cerebral hypoxia/ischemia.Am J Neuroradiol,2000,21(1):60-66.
[7]Deng W, Yue Q, Rosenberg PA, et al.Oligodendrocyte excitotoxicity determined by local glutamate accumulation and mitochondrial function.J Neurochem, 2006,98(1):213-222.
[8]Back SA, Han BH, Luo NL, et al.Selective vulnerability of late oligodendrocyte progenitors to hypoxia-ischemia.J Neurosci, 2002, 22 (2) : 455-463
[9]Wendland MF, Faustino J, West T, et al.Early diffusionweighted MRI as a predictor of caspase-3 activation after hypoxic-ischemic insult in neonatal rodents.Stroke,2008,39(6):1862-1868.
[10]Schneider MM, Berman JI, Baumer FM, et al.Normative apparent diffusion coefficient values in the developing fetal brain.AJNR Am J Neuroradiol, 2009,30(9):1799-1803.
[11]Boichot C, Walker PM, Durand C, et al.Term neonate prognoses after perinatal asphyxia: contributions of MR imaging, MR spectroscopy, relaxation times, and apparent diffusion coefficients.Radiology, 2006,239(3):839-848.
[12]Obenaus A, Ashwal S.Magnetic resonance imaging in cerebral ischemia: Focus on neonates. Neuropharmacology,2008,55(3):271-280.
[13]Takeoka M, Soman TB, Yoshii A, et al.Diffusionweighted images in neonatal cerebral hypoxic-ischemic injury.Pediatr Neurol, 2002,26(4):274-281.
[14]Wolf RL, Zimmerman RA, Clancy R, et al.Quantitative apparent diffusion coefficient measurements in term neonates for early detection of hypoxic-ischemic brain injury: Initial experience.Radiology, 2001,218(3):825-833.
[15]Thomas B, Eyssen M, Peeters R, et al.Quantitative diffusion tensor imaging in cerebral palsy due to periventricular white matter injury.Brain,2005,128(11):2562-2577.
[16]Ward P, Counsell S, Allsop J, et al.Reduced fractional anisotropy on diffusion tensor magnetic resonance imaging after hypoxic-ischemic encephalopathy.Pediatrics,2006,117(4):e619-630.
[17]Song SK, Sun SW, Ramsbottom MJ, et al.Dysmyelination revealed through MRI as increased radial (but unchanged axial) diffusion of water.Neuroimage, 2002,17(3):1429-1436.
[18]Song SK, Yoshino J, Le TQ, et al.Demyelination increases radial diffusivity in corpus callosum of mouse brain.Neuroimage, 2005,26(1):132-140.
[19]Song SK, Sun SW, Ju WK, et al.Diffusion tensor imaging detects and differentiates axon and myelin degeneration in mouse optic nerve after retinal ischemia.Neuroimage,2003,20(3):1714-1722.
[20]Budde MD, Kim JH, Liang HF, et al.Toward accurate diagnosis of white matter pathology using diffusion tensor imaging.Magnetic Resonance in Medicine,2007,57(4):688-695.
[21]Wang S, Wu EX, Cai K, et al.Mild hypoxic-ischemic injury in the neonatal rat brain longitudinal evaluation of white matter using diffusion tensor MR imaging.AJNR Am J Neuroradiol, 2009,30(10):1907-1913.
[22]Lee SK, Kim DI, Kim J, et al.Diffusion-tensor MR imaging and fiber tractography: A new method of describing aberrant fiber connections in developmental CNS anomalies.Radiographics, 2005,25(1):53-65.
[23]van Pul C, Buijs J, Vilanova A, et al.Infants with perinatal hypoxic ischemia: Feasibility of fiber tracking at birth and 3 months.Radiology, 2006,240(1):203-214.
[24]Wedeen VJ, Wang RP, Schmahmann JD, et al.Diffusion spectrum magnetic resonance imaging (DSI) tractography of crossing fibers.Neuroimage, 2008,41(4):1267-1277.
[25]Ferriero DM.Neonatal brain injury.N Engl J Med,2004,351(19):1985-1995.
[26]Scafidi J, Gallo V.New concepts in perinatal hypoxia ischemia encephalopathy.Curr Neurol Neurosci Rep,2008,8(2):130-138.
[27]Inder TE, Warfield SK, Wang H, et al.Abnormal cerebral structure is present at term in premature infants.Pediatrics,2005,115(2):286-294.
[28]Woodward LJ, Anderson PJ, Austin NC, et al.Neonatal MRI to predict neurodevelopmental outcomes in preterm infants.N Engl J Med, 2006,355(7):685-694.
[29]Maddah M, Grimson WEL, Warfield SK, et al.A unified framework for clustering and quantitative analysis of white matter fiber tracts.Medical Image Analysis,2008,12(2):191-202.

