焦绿石型氧化钨的研究现状和应用前景
李建圃,彭志宏
(中南大学冶金科学与工程学院,湖南长沙 410083)
焦绿石型氧化钨的研究现状和应用前景
李建圃,彭志宏
(中南大学冶金科学与工程学院,湖南长沙 410083)
综述了焦绿石型氧化钨的结构特点、制备方法及应用前景,重点介绍了水热合成法的研究进展及其反应机理,提出了该领域中的几个重要问题,并展望了未来的发展趋势。
焦绿石型;氧化钨;制备;应用
焦绿石型氧化钨(常记作 H2W2O7或 WO3· 0.5H2O)是一种A缺位层状钙钛矿基氧化物[1],由于具有分子筛的网状结构和介稳性[2],而在催化、传感、电致变色、燃料电池等领域表现出广泛的应用前景[3,4]。另外,焦绿石型氧化钨粉体经浓盐酸处理后可有效地除去 Na元素[5,6],且焙烧后可直接得到WO3,有望成为钨工业中的新型中间体。焦绿石型氧化钨的研究历史可追溯到20世纪80年代[7],却因制备手段和除杂技术的限制而至今无法量产,这也直接制约了其应用技术的扩展。我国在该领域的研究尚处于起步阶段,见报道的研究成果较少,且多在沿用国外的一些方法[2,6,8~12]。本文综述了近年来该领域的研究进展,并对其发展趋势作出了展望。
1 焦绿石型氧化钨的结构
焦绿石型氧化钨是以扭曲的WO6八面体为结构基元,通过钨氧刚性骨架的角顶构筑形成具有六元环孔道的层状结构[13](如图1所示),在沿(111)方向上拥有三维孔道[7,14,15],这种孔道有利于阳离子的快速迁移和交换[13]。其中一个水分子直接与钨相接形成二维层状结构,层与层之间通过氢键相互作用[10]。标准化学计量比的 H2W2O7为立方晶系,晶胞参数a=10.305(3)Å,Z=16[16]。就热稳定性而言,在温度高于320℃时,焦绿石型氧化钨的结构遭到破坏[6],即以WO6八面体为结构基元、通过钨氧刚性骨架的角顶构筑而成的具有六元环孔道网状结构倒塌,形成正交型氧化钨。Stéphane Laruelle[17]等人证实了在高能球磨作用下也会造成钨氧结构的变化。

图1 焦绿石型氧化钨的结构[13]
2 焦绿石型氧化钨的制备方法
2.1 软化学合成法
软化学合成即温和条件下无机功能材料的合成,它力求在中低温或溶液中使起始反应物在分子尺寸上均匀混合,进行可控的化学反应,经过生成前驱体或中间体,最后生成具有指定组成、结构和形貌的材料[2]。1988年法国的Coucou[7]等人采用软化学方法首次合成了焦绿石型氧化钨,他们以(NH4)10-W12O41·5H2O为前驱体,在酸性乙二醇溶液中加热回流得到[(NH4)2O]xW2O6,将其在酸溶液中反复清洗,所得粉体在100℃下加热除水,即制得焦绿石型氧化钨粉体。1996年Li[18]等人采用同样方法制备了一系列(M2O)xWO3·zH2O(M=H+、Li+、Na+、Ag+和),并测试了该系列粉体的湿敏性能。
上述方法往往只能得到有晶格缺失的焦绿石型氧化钨,而且其中水分子含量一般比完整的H2W2O7要少。近年来发展的软化学方法一般是以Aurivillius型化合物B为前驱体,通过酸处理得到焦绿石型氧化钨。R.E.Schaak[1]和Manabu Kudo[20]等人对该法设计出详细的制备流程:将Bi2O3和WO3按照1∶2的摩尔配比混合均匀后在800℃煅烧48 h,得到的Bi2W2O9置入浓盐酸中,然后在室温下强烈搅拌72 h即得到无畸变的H2W2O7晶体。之后对 H2W2O7的绝大多数研究都是基于这种方法,而我国见报道的对H2W2O7的功能研究几乎全部使用该法[8,10~12]。
2.2 水热合成法
2.2.1 水热合成法的研究进展
当前水热法已被广泛用于无机材料合成和材料处理[21,22],相比于其他方法拥有许多优点[23~25]:所需反应设备相对简单,而且水热控制具有明显的可操作性和可调变性;水热法特别适于合成特殊结构、特种凝聚态的新化合物以及制备具有平衡缺陷浓度、规则取向和晶形完美的晶体材料;水热条件下,溶液粘度下降,扩散和传质过程较顺利,反应物的活性有较大的提高,因而水热合成可代替某些高温固相反应,有利于促进中、低温合成化学的发展。
1989年,瑞典的Amberg[26]等人首次利用水热法制备出立方晶系的焦绿石型氧化钨,该相是采用水热法在pH=3.0合成钨酸镁的研究中偶然得到的晶体,经解析得知是W2O6·H2O(即H2W2O7)。1992年Kenneth[14]等人较详细报道了水热合成氧化钨的制备条件与其晶型的关系,研究发现在pH值为3.5~4.5范围内得到的是焦绿石型结构,在pH值为1.3~2.0之间得到的是六方晶型结构。而在pH值为2.0~3.5之间得到的是焦绿石型和六方晶型混合相,若pH大于5则得不到沉淀产物。1995年Guo[13]等人采用水热合成并利用 HCl调节体系pH值为6.0时也制备出焦绿石型氧化钨,而且该物质具有较好的电化学特性,这说明水热合成焦绿石型氧化钨的影响因素很多,其中pH环境很可能是最重要的因素。
国内对水热法制备焦绿石型氧化钨的研究极少,见报道的只有徐英明[2,6,9]等人用该法制备出的介稳态超微粉体,其方法基本上完全效仿 Kenneth[14],研究结果则略有不同:在pH值为2.5~4.5范围内得到的是纯相的焦绿石型氧化钨超微粉体,在pH值为0.5~2.0之间得到的是六方晶型氧化钨。同时研究表明在130~200℃的温度范围内制备出的粉体晶粒尺寸相差不超过5 nm,提高温度可使晶粒尺寸略微减小,而所用盐酸的浓度对晶粒尺寸的影响较小。粉体主要以团聚体形式存在,EPMA形貌如图2所示,粒度分析显示,粉体粒径在2~100μm之间呈双峰分布平均粒径较大,而且粉体放置一个月以后团聚现象更加明显。

图2 焦绿石型氧化钨粉体的EPMA形貌[6]
遗憾的是,现有的水热合成法均无法达到较高的分解率,而且水热环境的波动极易对粉体形貌、粒度造成影响,因此至今为止该法还停留在理论研究阶段,所得产品尚未应用于功能材料的研究。
2.2.2 水热合成的机理
Thierry Barré[27]等人总结了钨氧阴离子的拉曼光谱数据,通过研究钨酸钠溶液酸化过程的pH变化(pH变化情况如图3所示)和拉曼光谱变化,较简略地概括了H2W2O7的水热合成机理。他们认为钨酸钠溶液酸化过程中,W元素主要存在于、和离子中,在酸化度较高的情况下,主要发生如下反应:

其中H2WO4在4<pH<7的环境中不稳定存在,其亚稳性主要表现为:当向钨酸钠溶液中滴加浓度较高的硫酸时,会造成局部酸度过高而使的质子化过程十分短暂,直接生产钨酸沉淀。而扩散过程又使H+的浓度迅速降低,易促进式(3)逆反应的进行,造成H2WO4的大量减少。

图3 钨酸钠溶液酸化过程中的pH变化情况[27]
对照图3可发现,钨酸钠溶液的pH从7降至4是一个很快的过程,在操作过程中如果不注意控制滴酸速度,会使溶液pH迅速跨越该区间而快速生成钨酸沉淀。只有当控制溶液pH不太低、且钨酸盐浓度很低时,才会抑制式(3)的进行而使较稳定存在。在这种条件下提供少量的H+,会按照另外一种方式进行质子化过程,如式(4)和式(5)所示,最终生成焦绿石型氧化钨。

该机理指出控制溶液pH在制备焦绿石型氧化钨的过程中起关键作用,但仍然存在缺陷:一是主要反应式中所使用的离子并不能通过拉曼光谱技术得以确认,部分离子只是可能存在而不是确定存在(比如和)。二是机理建立过程所规定的离子存在状态过于简单,钨酸钠溶液酸化过程中生成的(仲钨酸盐A)、H2(仲钨酸盐B)等已被确认存在的离子[28,29]并未被纳入机理之中。三是滴定过程中所使用的硫酸浓度过高,无法精确测定各离子的pH生存区间,对实际制备H2W2O7的过程指导意义不大。因此,水热法制备焦绿石型氧化钨的机理还有待进一步完善。
3 焦绿石型氧化钨的应用前景
3.1 层状复合材料领域
不同链长的烷基胺嵌入到层状无机主体中能得到微孔柱撑材料,具有高比表面积、多孔结构且孔径可调,这对催化领域的研究有重要意义,而且在吸附、传导、分离和催化等诸多领域具有广阔的应用前景。王炳山[10]等人研究了几种一元烷基胺(CnH2n+1NH2,n=4,8,12,16)嵌入层状H2W2O7的行为,他们将H2W2O7置于烷基胺与正庚烷的混合液中,在室温条件下反应7 d后经洗涤、烘干处理,制得多种层状复合材料。烷基胺在复合物中层与层之间通过静电引力相互作用,以全反式构象双层排布,层间距随烷基胺碳原子属的增加而线性增长。UV -Vis分析表明,复合物的禁带宽度相对半导体氧化钨变大了很多。后来他们以HTT作为中间体[11],利用阳离子交换机制又间接将苯胺阳离子嵌入到H2W2O7层间。聚苯胺分子没有破坏原有的层板结构,在层间成单层垂直分布。对比H2W2O7及烷基胺/H2W2O7复合物的分解温度,聚苯胺的嵌入大大改善了材料的热稳定性。
Deliang Chen[12]等人利用 H2W2O7和正辛胺在非极性庚烷介质中合成了新型插层化合物,经过去除有机胺、煅烧的工序最终获得一种功能材料,该材料对酒精表现出极高的敏感性。另外他们[30]还利用H2W2O7·xH2O与庚烷/辛烷混合溶液反应,如式(6)所示,释放的层间水与辛胺发生水解反应形成高碱性微区水溶液,[W2O7]双层在高碱性溶液中被溶解为[WO4]单层,如式(7)所示。生成的 H2-b(RNH3)WO4在准反胶束介质中自组装为高度有序的无机-有机混杂纳米带(C8NH2-HWO),将纳米带分散于硝酸水溶液后,经磁力搅拌、固液分离、洗涤、热处理后得到WO3纳米片,并对产品的形貌、结构和形成机理进行了探讨。后来又经过一系列的研究[31,32],他们将插层反应的具体条件进行了适当的调整,最终确立出利用H2W2O7·xH2O制备插层复合材料和纳米WO3的较完善过程[33],并指出该法适宜于大规模纳米WO3的生产,且符合工业化的低成本要求。
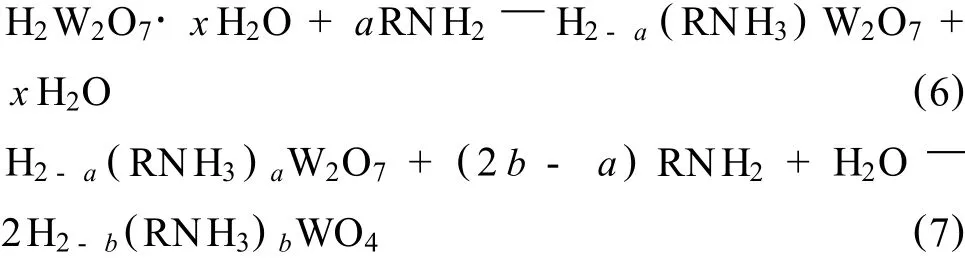
3.2 传感领域
Li[18]等人利用离子交换法处理含钠的焦绿石型氧化钨,分别制备出含 H+、Ag+、NH+4、Li+的焦绿石型混合物,对比发现,[H-H2W2O7]具有最低的电阻率,而[Li-H2W2O7]的相对湿度和电阻率对数之间拥有最佳的线性规律,且该传感器具有良好的耐用性和重复性。
Driouiche[34]等人对焦绿石型氧化钨进行了研究,发现Li元素的插入会造成晶格参数的变化,并易造成原晶体向非晶态发生转变,生成空腔结构并具备一定的传感功能。
Guo[13]等人以焦绿石型氧化钨薄膜为阴极,以锂箔为阳极,1 mol/L的LiClO4做电解液,用电解法将Li均匀嵌入到焦绿石型氧化钨中。所得产品表现出良好的电致变色性能,并确定了锂离子的化学扩散系数为1.1×10-7cm2/s,该系数是相关研究中所能达到的最高值。
3.3 工业化制备氧化钨
近年来,我国钨湿法冶金中的碱分解工艺不断发展,已经成为可处理各种钨矿物原料的通用工艺。可是由于除Na过程的复杂,该工艺始终无法避免钨酸铵、APT这两种中间产物的生产过程,浸出矿石所用的碱液也无法得到有效的回收或循环。中南大学氧化铝及陶瓷研究所发明的“一种从钨酸钠溶液制备氧化钨水合物的工艺”[35]使这些问题有望得以解决。
该专利以碱法短流程制备氧化钨为基本思路,以H2W2O7为主要中间产物制备WO3。其中利用水热法制备H2W2O7可使溶液反应率达到98%以上,且所用钨酸钠溶液不必局限在较低的浓度范围内,其工业化前提条件远远优于其他方法。另外由于选用CO2等有机物作为添加剂,水热反应后的产物CO2-3易通过苛化反应等手段实现NaOH的回收利用,因此在节能、减排等方面均显示出广阔的应用前景。
4 结束语
目前,人们对焦绿石型氧化钨的研究主要还集中在制备上,尽管已经报道了不少的制备方法,但均无法同时保证稳定批量生产和清洁生产,这也是限制其应用的最大障碍。水热法制备焦绿石型氧化钨无疑是最具开发潜能的方法,因此确定水热法的最佳反应条件、强化除杂过程等将是下一步研究的重点。此外,对焦绿石型氧化钨的应用研究还不是很深入,很多潜在的应用价值还有待发掘。总之,焦绿石型氧化钨作为一种优良的特种材料,其制备和性能的研究无论是从理论上还是从实际应用上都具有十分重要的意义。
[1] R.E.Schaak,T.E.Mallouk.Exfoliation of layered rutile and perovskite tungstates[J].Chem.Commun.2002,21:706-707.
[2] 徐英明.氧化钨基纳米材料的制备与物理化学性质研究[D].黑龙江:黑龙江大学,2005.
[3] W.H.Tao,C.H.Tsai.H2S sensing properties of noble metal doped WO3thin film sensor fabrieated by micromachining[J]. Sensors and Actuators B,2002,81:237-247.
[4] E.Ozkan,S.H.Lee,P.Liu,etal.Eleetrochromic and optical properties of mesoporous tungsten oxide films[J].Solid.State.Ionics, 2002,149:139-146.
[5] Shim J,Lee C R,Lee H K.Electrochemical characteristics of Pt-WO3/C and Pt-TiO2/C electrocatalysts in a polymer electrolyte fuel cell[J].Power Sources,2001,102:172-177.
[6] 徐英明,霍丽华,赵辉,等.介稳态氧化钨超微粉体的水热合成与光致变色性质研究[J].无机化学学报,2005,21(4):538-542.
[7] Coucou A,Figlarz M.A new tungsten oxide with 3D tunnels:WO3with the pyrochlore-type structure[J].Solid.State.Ionics,1988,28 -30:1 762-1 765.
[8] WANGBingshan,DONGXiaowen,et al.Intercalation behavior of n-alkylamines into an A-site defective layered perovskite H2W2O7[J].Solid.State.Chemistry.2007,1 125-1 129.
[9] 徐英明,程晓丽,高山,等.焦绿石型WO3超细粉体的水热合成与表征[J].哈尔滨理工大学学报,2002,7(6):70-74.
[10]王炳山,董晓雯,潘庆谊,等.层状钨基氧化物复合材料的合成与电子特性[J].无机化学学报,2007,23(2):200-204.
[11]王炳山,厉燕萍,董晓雯,等.聚苯胺/H2W2O7层状复合材料的指标研究[J].化学学报,2009,67(19):2 199-2 204.
[12]CHEN Deliang,HOU Xianxiang.The enhanced alcohol-sensing response of ultrathin WO3nanoplates[J].Nanotechnology,2009, 7:1-12.
[13]J.D.Guo,Y.J.Li,M.S.Whittingham.Hydrothermal synthesis of electrode material pyrochlore tungsten trioxide film[J].Power Sources,1995,54:461-464.
[14]P.Kenneth,R.A.Ramanan,M.S.Whittinhgam.Synthesis of novel compounds with the pyroehlore and hexagonal tungsten bornze structures[J].Solid.State.Chem,1992,96:31-47.
[15]Nedjar R,Borel M.M,Hervieu M,et al.Une nouvelle forme de trioxide de tungstene:les oxydes WO3et WO3·0.5H2O a structure pyrochlore[J].Mater.Res.Bull,1988,23:91-97.
[16]John R.Günter,Marcel Amberg,Helmut Schmalle.Direct synthesis and single crystal structure determination of cubic pyrochloretype tungsten trioxide hemihydrate,WO3·0.5H2O[J].Materials Research Bulletin.1989,24(3):289-292.
[17]Stéphane Laruelle,Michel Figlarz.High-Energy milling of WO3oxides:amorphization and reaction with Cs2CO3[J].Journal of Solid State Chemistry,1994,111(1):172-177.
[18]Yingjeng James Li,Ping Ping Tsai.Lacunar pyrehloer-type tungsten oxide as humidity-sensing materials[J].Solid.State.Ionics, 1996,86-88:1 001-1 004.
[19]Chong S V,Ingham B,TallonJ L.Two synthetic routes to the formation of tungsten oxide hybrid compounds[J].Materials Research Society,2005,847:545-550.
[20]Manabu Kudo,Hajime Hhkawa.A layered tungstic acid H2W2O7·nH2O with a double-octahedral cheet structure:conversion process from an aurivillius phase Bi2W2O9and structural characterization [J].Inorg.Chem.2003,42:4 479-4 484.
[21]K.Byrappa,M.Y oshimura.Handbook of hydrothermal technology:a technologyfor crystal growth and materials processing[M].William Andrew Publishing,LLC Norwich,New Y ork,2001:1-43.
[22]Yoshimura M.Importance of soft solution processing for advanced inorganic materials[J].Mater.Res,1998,13(5):1 091-1 098.
[23]王秀峰,王永兰,金志浩.水热法制备纳米陶瓷粉体[J].稀有金属材料与工程,1995,24(4):1-6.
[24]Yoshimura M.Soft processing for advanced inorganic[J].Materials.MRS.Bulletin,2000,25(9):12-13.
[25]Yoshimura M.Soft solution processing:a strategyfor one-step processing of advanced inorganic[J].Materials.MRS.Bulletin,2000, 25(9):17-25.
[26]M.Amberg H,H.Schmalle.Direct synthesis and single crystal structure determination of cubic pyrochlore-type tungsten trioxide hemihydrate, WO3·0.5H2O[J].Mater.Res.Bull.1989,24:289-292.
[27]Thierry Barré,Laurent Arurault,François X Sauvage.Chemical behavior of tungstate solutions[J].Spectrochimica Acta-Part A:Molecular and Biomolecular Spectroscopy,2005,61(4):551-557.
[28]Maksimovskaya R I,Burtseva K G.17O and 183 W NMR studies of the paratungstate anions in aqueous solution[J].Polyhedron, 1985,4,1 559-1 562.
[29]LIU Shijun,CHEN Qiyuan.Raman spectral study on isopolytungstates in aqueous solution[J].Trans.Nonferrous Met.Soc. China,1998,8,688-692.
[30]陈德良,王海龙,张瑞,等.基于插层化学的单晶氧化钨纳米片的制备、表征与形成机制[J].高等学校化学学报,2008,29 (7):1 325-1 330.
[31]CHEN Deliang,Yoshiyuki Sugahara.Tungstate-based organic/inorganic hybrid nanobelts/nanotubes with lamellar mesostructures: synthesis,characterization,and formation mechanism[J]. Chem.mater,2007,19(7):1 808-1 815.
[32]CHEN Deliang,Yoshiyuki Sugahara.Investigation of factors influencing the formation of tungstate-based inorganic-organic hybrid nanobelts/nanotubes[J].Key Eng.Mater,2007,352:85-88.
[33]CHEN Deliang,WEN Hejing.Novel synthesisof WO3nanocrystals through pyrolytic decomposition of tungstate-based inorganic-organic hybrid nanobelts[J].Materials Chemistry and Physics, 2009,116:507-513.
[34]A.Driouiche,M.Figlarz,C.Delmas.Lichium insertion in lacunar pyrochlore-type WO3[J].Solid.State.Ionics,1993,62(1-2): 113-117.
[35]中南大学.一种从钨酸钠溶液制备氧化钨水合物的工艺[P].中国专利:201010022046,2010-01-12.
Present Research Situation and Application Prospect of Pyrochlore-Type Tungsten Oxide
LI Jian-pu,PENGZhi-hong
(Central South University,Changsha410083,China)
Recent progress in the structure,preparation and potential of pyrochlore-type tungsten oxide is reviewed.The emphasis is on the research of hydrothermal method and its reaction mechanism.Several major challenges are analyzed and the future directions is forecast.
pyrochlore-type;tungsten oxide;preparation;application
TF841.1
A
1003-5540(2010)02-0027-04
李建圃(1984-),男,硕士研究生,主要从事有色金属冶金研究工作。
2009-12-27

