飞机草活性物质的提取及对有毒蓝藻的增殖抑制
张 旭, 李洪武, 吴光明, 伴修平, 朴虎東
(1.海南大学 海洋学院,海南 海口 570228;
2.海南断山渔业有限公司,海南 三亚 572013;
3.滋賀县立大学 環境科学部,日本 彦根 5228533;
4.信州大学 理学部,日本 松本 3908621)
飞机草活性物质的提取及对有毒蓝藻的增殖抑制
张 旭1, 李洪武1, 吴光明2, 伴修平3, 朴虎東4
(1.海南大学 海洋学院,海南 海口 570228;
2.海南断山渔业有限公司,海南 三亚 572013;
3.滋賀县立大学 環境科学部,日本 彦根 5228533;
4.信州大学 理学部,日本 松本 3908621)
飞机草(Eupatorium odoratumLinn.)活性物质对有毒蓝藻铜绿微囊藻(Microcystis ae⁃ruginosaKutzing.var.minor.H.W.Liang.,记作:NIES298)和鱼害微囊藻(Microcystis ichthyob⁃labe Kutz.,记作:TAC95)具有增殖抑制作用.飞机草不同溶剂的浸提液对NIES298和TAC95的抑制效果:蒸馏水浸提比乙醇、丙酮抑制效果好.层析分离活性成分后,发现D3(Rf=0.524)的分离物对两种蓝藻的抑制作用非常明显,74μg/g时即己表现出抑制作用,并且随着飞机草浸提液使用剂量的加大,两种蓝藻的叶绿素a浓度明显低于起始值.
飞机草;有毒蓝藻;增殖抑制
飞机草(E.odoratum)又名香泽兰,为菊科泽兰属,多年生草本或亚灌木植物[1],是一种有毒、繁殖力强、增殖快、生态适应性广的恶性杂草[2-7],不但可对生态系统造成不可逆转的破坏,对农、林、牧业生产也都造成了巨大的经济损失.目前飞机草在我国的发生面积近3 000万hm2,海南省是我国危害最重的省份之一[8].对于飞机草的防治与利用的研究一直在继续,目前已经形成了物理防治、化学防治、生物防治、综合防治、检疫制度等防治方法,由于飞机草的入侵特性,目前防治效果并不明显[9-12].
本文将从开发利用的角度出发,探索飞机草的实用价值.
20世纪90年代以来,国内水体富营养状态日益严重,主要河流以及集合水湖均有严重的蓝藻水华发生[13].有资料表明,我国已有66%以上的湖泊和水库处于富营养化水平[14],爆发蓝藻水华的趋势日渐明显.蓝藻水华一旦爆发,不但败坏水质,尤其影响水生生物的生长与生存[15-18].部分蓝藻可产毒素[19],能够影响鱼类的胚胎发育、增殖和行为,也可以引起肝脏和肾脏等内部器官以及免疫系统的病变[20-26].哺乳动物对此类毒素更加敏感[27],可造成急性和慢性毒效应[22,28-31],对人体健康也构成了严重的危害[24,32-33].
由于蓝藻繁殖习性喜高温、连续阴雨、闷热、弱风的气候条件,较高的水温是蓝藻水华发生的重要条件之一[34],海南省的气候与环境条件非常利于蓝藻水华的大面积爆发.本文将依据飞机草具有的驱避、毒杀、影响生长发育以及作为传统医药等多重功效[6,35-37],探索飞机草是否具有抑制有毒水华蓝藻增殖的作用.
1 实验
1.1 试材与设备
实验用试剂乙醇、丙酮、正丁醇、冰乙酸、MA培养基均为分析纯.Bicine购于Sigma(St.Louis,MO,USA).蓝藻(NIES298和TAC95)来自日本滋贺县立大学.天然飞机草粉末(茎和叶)采摘后自然干燥,粉碎机粉碎.
仪器设备:冰箱(BCD-257SL,青岛海尔股份有限公司);pH仪(Delta 320,Mettler Toledo(上海)仪器有限公司);可见分光光度计(722s,上海棱光技术有限公司);磁力搅拌器(79-1磁力加热搅拌器,江苏金坛科达仪器厂);旋转蒸发仪(RE52CS,上海亚荣生化仪器厂);恒温水浴锅(B-220,上海亚荣生化仪器厂);灭菌锅(YX280A,上海三申医疗器械有限公司);滤纸(中速定性滤纸101,杭州新华纸业有限公司);玻璃纤维滤膜GF/F(1825-025,Whatman International Maidstone England);电子天平(BL-220H,Shimadzu Corporation Japan);紫外灯(SLUV-6,日本ASONE株式会社);无菌操作台(SJ-DP,上海浦东物理光学仪器有限公司);恒温培养箱(LSC-92,上海三申医疗器械有限公司);纯水仪(Molro 10a,上海摩勒生物技术有限公司);薄层Chromatography展开槽(100-7L,日本矢泽科学);层析纸(3030-909,England).
1.2 实验方法
1.2.1 蓝藻的培养
培养基为MA培养基,pH 8.60±0.02,配方见表1.恒温培养箱中培养,温度25±1℃,光照5 000 lx.

表1 MA培养基(Ichimura,1979)Tab.1MA Medium(Ichimura,1979)
1.2.2 飞机草浸提液的粗提
浸提溶液采用蒸馏水,在浸提过程中,由于飞机草粉末本身未经过任何除菌处理,加之海南的天气因素,导致用蒸馏水直接浸提经常发臭发腐.经研究确定加CaO抑制此现象,先行确定抑制作用的有无.
准确称取飞机草粉末20.0 g,CaO 3.0 g于500 mL烧杯中混匀,加蒸馏水200 mL浸没搅匀,用锡纸封口于室温下浸提24 h后,经0.45 μm中速定性滤纸过滤,滤液备用.
1.2.3 活性抑制实验
于24支10 mL培养管中加入5 mLMA培养基,121℃灭菌,冷却后接入对数期藻1 mL,按梯度100、200、400 μL接入飞机草浸提液,对照组无添加.各条件组均做3联处理,于恒温培养箱中培养,每天摇匀一次.对起始藻叶绿素a浓度进行测定、记录.培养3 d后,使用GF/F滤膜、抽滤器过滤藻,取滤膜加入5 mL 90%丙酮溶液,密封放于4℃冰箱抽取叶绿素a.24 h后取出,室温下静置30 min后,进行吸光度测定,根据叶绿素a浓度的计算公式Armon[39]记录645、663 nm波段下的吸光值.
1.2.4 不同溶剂浸提飞机草
据文献报道[38],多种有机溶液中乙醇和丙酮的飞机草浸提液效果最好,应用潜力最大,为此我们将取之与蒸馏水的浸提液做比较.准确称取飞机草粉末20.0 g 4份,CaO 3.0 g 1份.4个500 mL烧杯洗净吹干,称重.1份飞机草、CaO、200 mL蒸馏水于500 mL烧杯中混匀,其他3份分别加于500 mL烧杯,各加蒸馏水、乙醇和丙酮200 mL浸没搅匀,锡纸封口于室温下浸提24 h后,经0.45 μm中速定性滤纸过滤,滤液于旋转蒸发仪中50℃挥干,称重.根据挥干物的质量以1 g/100 mL的比例加入相应蒸馏水于室温下溶解24 h后,4℃保存备用.
于30支10 mL培养管中加入5 mL MA培养基,121℃灭菌,冷却后接入对数期藻1 mL,分别加入400 μL各浸提液,对照组无添加.各条件组均做3联.后续步骤同活性抑制部分相同.
1.2.5 活性物质的分离(纸层析)
配制正丁醇∶冰乙酸∶蒸馏水=4∶1∶2(v/v/v)作为层析流动相.于预层析缸中加入30 mL,层析纸剪成20 cm×5 cm大小,垂直放入层析纸,流动相上移至据上边缘1~2 cm处时预洗完毕,以铅笔划一浅线,用吹风机吹干整张层析纸.据底边1.5 cm处以铅笔划一浅线,据左边缘1 cm处开始点样,每点飞机草浸提液100 μL,共点4点,点与点之间间距1 cm.以毛细吸管吸取点样,每次均以吹风机吹干后再继续,直至点完.于层析缸中加入30 mL流动相,垂直加入层析纸进行层析,流动相上移至距预洗线1~2 cm处时取出,以铅笔做标记,吹干.黑暗下波长365 nm紫外灯拍照,将层析条带圈出,由下至上依次标注为D1、D2、D3、D4和D5.
1.2.6 活性物质分离(纸层析)后的各活性成分的效果确定
于42支10 mL培养管中加入5 mL MA培养基,121℃灭菌,冷却后接入对数期藻1 mL,将4个样点的D1、D2、D3、D4和D5分别剪下,以4个为一组分别加入到培养管中,空白组无添加,对照组加入相应量的空白层析条带。对起始藻叶绿素a浓度进行测定、记录.3 d后使用GF/F滤膜、通过抽滤器过滤藻,取滤膜加入5 mL 90%丙酮溶液,密封放于4℃冰箱抽取叶绿素a.24 h后取出,室温下静置30 min后,进行吸光度测定,记录645、663 nm波段下的吸光值.
1.2.7 活性成分的剂量
大量层析飞机草粗提液.100 mL烧杯洗净吹干,称重,记录.取20个D3放于该烧杯,加蒸馏水浸没,室温下溶解24 h后,过滤,滤液于50℃挥干,称重,记录.
2 结果与讨论
2.1 活性抑制结果
培养3 d时可见飞机草浸提液对两种蓝藻具有明显的增殖抑制作用,并且100 μL时已见抑制效果,随浸提液用量的加大,两种蓝藻的叶绿素a浓度明显低于起始值,如图1.以小球藻(Chlorella py⁃renoidosaChick.)为例,在实验用剂量范围内的飞机草浸提液对小球藻的增殖无抑制作用,见图2.

图1 蒸馏水+CaO条件下的飞机草浸提液对两种蓝藻的抑制效果Fig.1 The inhibitory effect of E.odoratum extrated by distilled water and CaO on two cyanobacteria
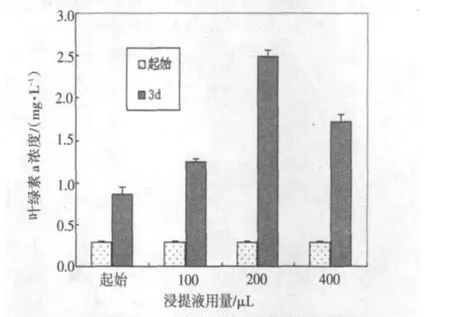
图2 蒸馏水+CaO条件下的飞机草浸提液对小球藻的增殖影响Fig.2 The inhibitory effect of E.odoratum extrated by distilled water and CaO on C.pyrenoidosa
起始组为实验时藻叶绿素a的浓度.100(3d)、200(3d)、400(3d)分别代表加入飞机草浸提液100 、200、400 μL的各组培养3 d时的叶绿素a的浓度.
2.2 不同溶剂浸提液的抑制效果对比
图1已证实飞机草浸提液对2种蓝藻具有增殖抑制作用,不同溶剂下浸提液的效果对比用量均是选用400 μL.
实验结果表明,蒸馏水和蒸馏水+CaO的浸提液对两种蓝藻均具有明显的抑制作用,说明在蒸馏水中加CaO并不影响抑制效果;乙醇和丙酮的浸提液对NIES298没有抑制作用,如图3;对TAC95的抑制作用明显没有蒸馏水+CaO的效果好,如图4.后续实验均选择用蒸馏水+CaO浸提的原因是为了避免飞机草自身所带细菌对实验造成的干扰.选择用蒸馏水浸提也是我们设计实验时出于环保、安全、健康的理念.
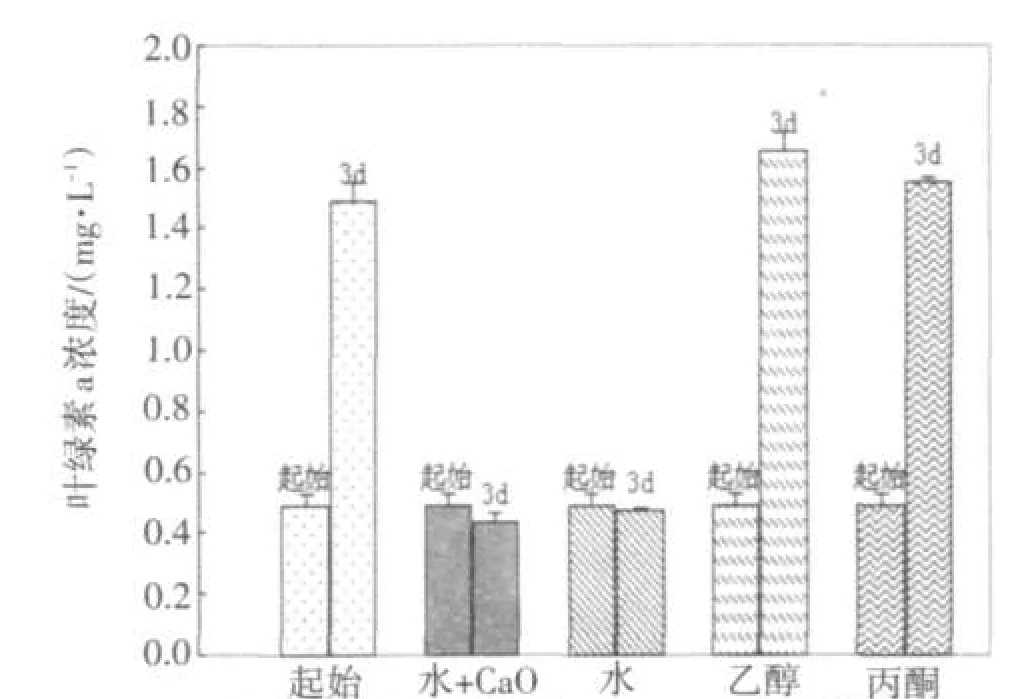
图3 不同溶剂的浸提液对溶剂NIES298的抑制效果对比Fig.3 The inhibitory effect of extracts ofdifferent solvents on NIES298
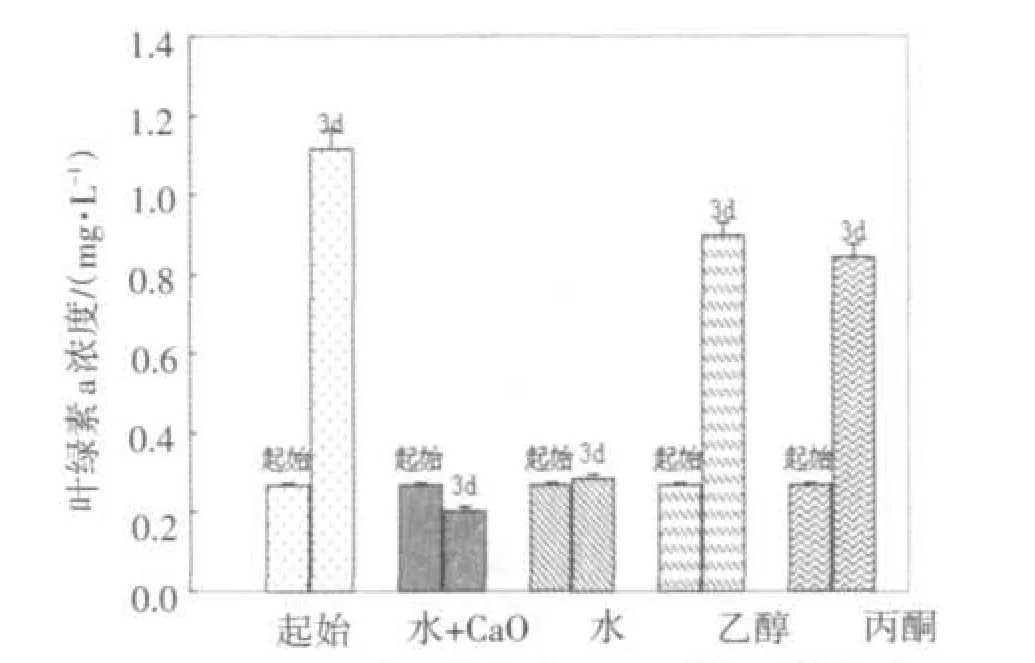
图4 不同溶剂的浸提液对TAC95的抑制效果对比Fig.4 The inhibitory effect of extracts of different solvents on TAC95
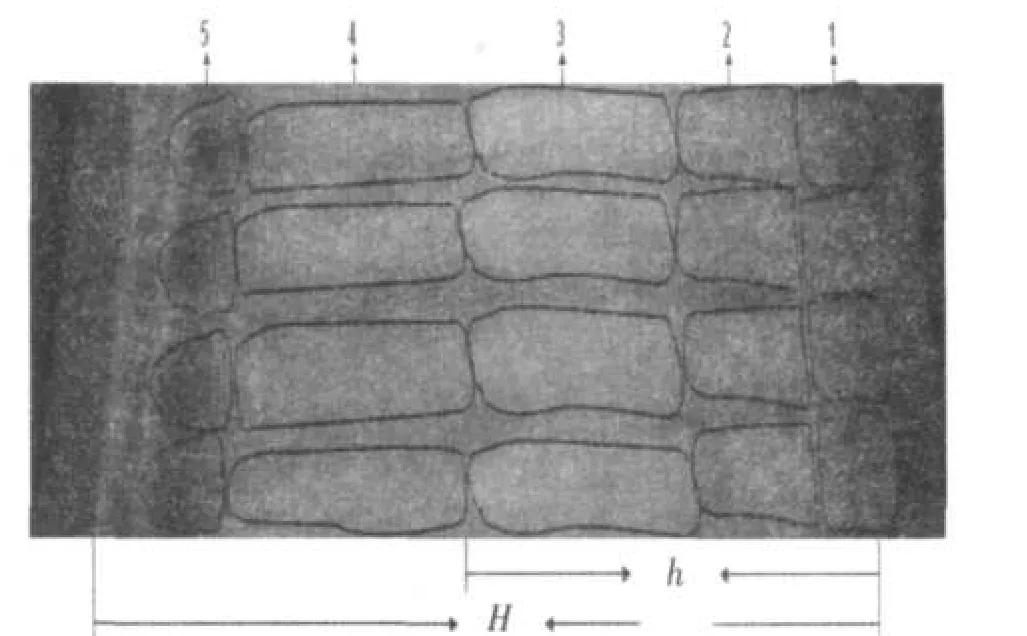
图5 波长365 nm下的光谱照片Fig.5The photo under 365 nm wavelength
1、2、3、4、5分别为D1、D2、D3、D4、D5.h为D3移动的距离;H为移动相移动的距离.
2.4 活性物质分离后各成分的抑制效果
以NIES298的抑制效果可见,D3、D4及D5均具抑制作用,但D3的增殖抑制效果最为明显.另外,D3组的叶绿素a浓度明显低于起始值,见图6.
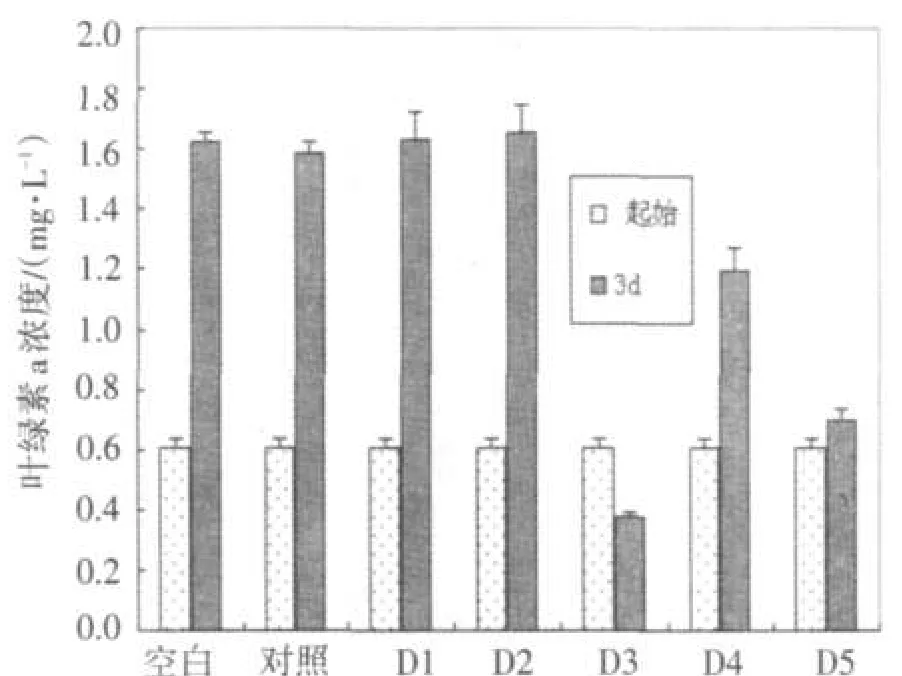
图6 加入各层析条带后NIES298的叶绿素a浓度变化Fig.6 The concentration change of NIES298's Chlo⁃rophyll-a after adding the chromatographic bands
2.3 活性物质的分离(纸层析)结果
UV(紫外光365 nm)下可见飞机草浸提液的成分分离结果,按照图谱反映,分为5个部分:D1、D2、D3、D4和 D5,各Rf值(h/H)分别为 0.088,0.224,0.524,0.771,0.929(见图5).
根据D3对NIES298的明显抑制作用,继而也验证了其对TAC95的抑制作用,同样可见D3组的叶绿素a浓度低于起始值,见图7.
2.5 活性成分剂量的计算结果
称重测定实验用D3所含的分离物平均质量为0.45 mg,即每100 μL飞机草浸提液中D3分离物的质量.根据使用配量:于含5 mL培养基、1 mL藻液的培养管中分别加入100、200、400 μL的飞机草浸提液,计算得出D3分离物的浓度分别为74、145、281 μg/g.图1可见,74 μg/g时即对两种蓝藻具有增殖抑制作用,并且随着飞机草浸提液使用剂量的加大,两种蓝藻的叶绿素a浓度均明显低于起始值.
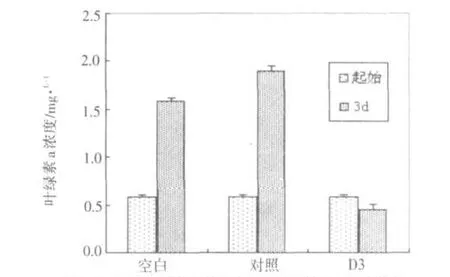
图7 加入层析条带D3后TAC95的叶绿素a浓度变化Fig.7The concentration change of TAC95's Chlorophyll-a after adding D3
3 结语
目前为止,已经证明飞机草对有毒蓝藻铜绿微囊藻和鱼害微囊藻具有增殖抑制作用,并且发现用蒸馏水做溶剂浸提的效果好于乙醇和丙酮,可实现环保、安全、健康的理念.不但如此,飞机草浸提液的使用还使得蓝藻的叶绿素a浓度明显低于起始值.另外,对于使用飞机草浸提液抑制蓝藻增殖的过程中,是否会对自然环境中的有益藻产生不良影响,我们以小球藻(Chlorella pyrenoidosaChick.)为例,证明了对其增殖无抑制影响.层析结果已经初步确定活性成分,计划在后续研究中探究飞机草活性成分的高效提纯法.另外,我们还计划深度探究活性成分的物质组成、结构以及功效.
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1984:56-58.
[2]何衍彪,张茂新,何庭玉,等.飞机草化感作用的初步研究[J].华南农业大学学报:自然科学版,2002,3(23):60-62.
[3]强胜.世界性恶性杂草—紫茎泽兰研究的历史及现状[J].武汉植物学研究,1998,16(4):366-372.
[4]阉丽艳,谢贵水,安锋.海南外来人侵植物的危害、人侵机制与防治对策[J].热带农业科学,2007,1(27):61-63.
[5]McFadyen REC.Siam weed:a new threat to Australia's north[J].Plant Protection Quarterly,1989,4:3-7.
[6]江世宏,杨长龙.飞机草在植物源农药中的应用研究进展[J].广东农业科学,2007,3:43-45.
[7]国家环境保护总局.中国第一批外来入侵物种名单.中华人民共和国,国务院公报[EB/OL].(2006-06-15)[2010-09-10].http://gov.ce.cn/Home/gwygb/2003/23/200606/15/t20060615_7361053.shtml
[8]陈华峰.林业有害植物飞机草入侵的生态机理研究[DB/OL].(2006-06-01)[2010-09-10].http://cdmd.cnki.com.cn/Article/CDMD10225-2006110495.htm
[9]张建华,范志伟,沈奕德,等.外来杂草飞机草的特性及防治措施[J].广西热带农业,2008(3):26-28.
[10]McFadyen R E C.Biological control of weeds[J].An⁃nual Review of Entomology.,1998,43:369-393.
[11]Goodall J M,Erasmus D J.Review of the status and inte⁃grated control of the invasive alien weed,Chromolaena odorata,in South Africa[J].Agriculture,Ecosystems&Environment.,1996,56:151-164.
[12]余香琴,冯玉龙,李巧明.外来入侵植物飞机草的研究进展与展望[J].植物生态学报,2010,34(5):591-600.
[13]沈建国,章建.微囊藻毒素的污染现状、毒性机理和检测方法[J].预防医学情报,2001,17(1):10-16.
[14]黄漪平.太湖水环境及其污染控制[M].北京:科学出版社,2001:207-231.
[15]王玉群,李志文.蓝藻水华对鱼类的危害和蓝藻水华的控制[J].科学养鱼,2006,8(63):77.
[16]杨传萍.蓝藻水华对水产养殖的危害和防治措施[J].安徽农学通报,2006,12(9):132.
[17]高政权,孟春晓.淡水水体中蓝藻水华研究进展[J].安徽农业科学,2009,37(16):7597-7598.
[18]辛玉文,李育东.浅析蓝藻水华对水产养殖业的影响及其对策[J].科学养鱼,2007(4):81.
[19]Carmichael W W,Azevedo SMFO,An J S,et al.Hu⁃man fat alities from Cyanobacteria:Chemical and biologi⁃cal evidence for cyanotoxins[J].Environ Health Persp,2001,109:663-668.
[20]施玮,朱惠刚,晏晓蓉,等.微囊藻毒素MC-LR对原代肝细胞的影响[J].环境与职业医学,2002,19(3):129-131.
[21]Fischer W J,Dietrich D R.Pathological and biochemical characterization of microcystin induced hepatopancreas and kidney damage in carp(Cyprinus carpio)[J].Toxicol Appl Pharmacol,2000,164(4):73-81.
[22]傅文宇,李敏伟,徐立红,等.用流式细胞仪P1/Annexin V双染色法检测微囊藻毒素LR诱导的大鼠肾细胞凋亡[J].水生生物学报,2004,28(1):82-83.
[23]刘秀霞,梁旭方,丁雪芬,等.微囊藻毒素对尼罗罗非鱼原代肝细胞致毒机理的探讨[J].动物学杂志,2008,43(5):25-30.
[24]许川,舒为群,曹佳,等.绿茶对微囊藻毒素诱导肝肾氧化损伤的拮抗效应[J].中华预防医学杂志.2007,41(1):8-12.
[25]隗黎丽.微囊藻毒素MC-LR对草鱼和斑马鱼免疫基因表达及草鱼免疫器官超微结构的影响[DB/OL].(2008-06-01)[2010-09-10].http://cdmd.cnki.com.cn/Article/CDMD-10459-2007122352.htm
[26]张建英,张杭君,陈英旭.微囊藻毒素导致鲫鱼淋巴细胞凋亡的研究[J].环境科学学报,2005,25(8):1101-1104.
[27]张学振.微囊藻毒素对鱼类和哺乳动物致毒效应的比较研究[DB/OL].(2008-06-01)[2010-09-10].http://cdmd.cnki.com.cn/Article/CDMD-10504-2008202931.htm
[28]Ding W X,Shen H M,Ong C N.Microcystic cyanobact eria extract induces cytoskel eton disruption and intracel⁃lular glutathione alterat ion in hepatocyt es[J].Environ Health Persp,2000,108:605-609.
[29]Hooser S B,Beasley V R,Lovell R A,et al.Toxi city of microcystin2LR,a cyclic heptapeptide hepatotoxin from Microcystis aeruginosa,to rats and mice[J].Vet Pathol,1989,26:246-252.
[30]Daniela R F,Ul isses M A,Sonia M E,et al.Microcystin producing blooms a serious global public health issue[J].Ecotoxicol Environ Saf,2004,59:151-163.
[31]Teneva I,Mladenov R,Popov N,et al.Cytotoxicity and apoptotic effects of microcystin LR and anatoxin in mouse lymphocytes[J].FoliaBiol(Praha),2005,51(3):62-67.
[32]Lankoff A,Krzowski L,Glab J,et al.DNA damage and repair in human peripheral blood lymphocytes following treatment with microcystin LR[J].Mutat Res,2004,559(1/2):131-142.
[33]Chen T,Cui J,Liang Y,et al.Identification of human live mitochondrial aldehyde dehydrogenase as a potential target for microcystin LR[J].Toxicology,2006,220:71-80.
[34]李好琴.蓝藻水华对水产养殖的危害及控制技术[J].渔业致富指南,2007,15:33-34.
[35]凌冰,张茂新,孔垂华,等.飞机草挥发油的化学组成及其对植物、真菌和昆虫增殖的影响[J].应用生态学报,2003,14(5):744-746.
[36]袁经权,杨峻山,缪剑华.飞机草化学成分研究[J].中草药,2005,36(12):1771-1773.
[37]Barnba D,Bessiere J M,Marion C.Essential oil of Eupa⁃torium odoratum[J].Planta Medica,1993,59:184-185.
[38]刘晓妹,蒲金基,蒙美英.飞机草不同溶剂粗提液抑菌活性的测定[J].广西热带农业,2004,6:1-3.
[39]李海涛,廖迎春,董铭,等.田间可调式UV-B辐射增强对籼型杂交稻“协优432”增殖及产量的影响[J].中国农学通报,2006,22(6):351-352.
Extraction of Eupatorium Odoratum and Its Inhibition on Toxic Cyanobacteria
ZHANG Xu1,LI Hongwu1,WU Guangming2,BAN Syuhei3,PARK Hodong4
(1.Ocean College,Hainan University,Haikou570228,China;
2.Duanshan Fishery LTD.,Sanya572013,China;
3.School of Environmental Sciences,University of Shiga Prefecture,Hikone5228533,Japan;
4.Faculty of Science,Shinshu University,Matsumoto3908621,Japan)
Eupatorium odoratumLinn.can inhibit the growth ofMicrocystis aeruginosaKutzing.var.minor.H.W.Li⁃ang.(NIES298)and Microcystis ichthyoblabe Kutz.(TAC95).The inhibitory effect of the extractions of E.odoratum from different solvents were compared and the result showed that E.odoratum extracted by water has better effect than that by ethanol and acetone.After chromatography we found D3(Rf=0.524)can restrain the two cyanobacteria clearly and the concentration of 74 μg/g had showed the effect.And as the dosage increased,the Chlorophyll-a’s concentrations of two cyanobacteria were significantly lower than the initial values.
E.odoratum;toxic cyanobacteria;inhibition
S 949
A
1674-4942(2010)04-0427-06
2010-09-11
与日本滋賀县立大学横向合作项目;海南大学“211工程”三期建设研究生科技创新平台(创新实验室)支持项目
黄 澜

