微透析-液相色谱-化学发光法测定大鼠脑组织中丹参酚类化合物浓度及其药代动力学研究
张群林,张云静,吴 亮,李 俊,袁 野
丹参为唇形科植物丹参(Salvia miltiorrhiza Bge)的干燥根及根茎,是我国传统医药学中应用最早且最广泛的药物之一,其化学成分主要包括水溶性酚类化合物和脂溶性二萜醌类化合物。丹参滴注液是我国自主研发的中药注射液,由丹参水提液制备而成,已应用于临床治疗心脑血管疾病30余年。丹参素(DSS)、原儿茶醛(PAL)和丹酚酸B(SalB)是丹参滴注液中主要的水溶性有效成分(化学结构式见Fig 1),具有改善血液循环、扩张冠脉、减少脑梗死面积、抑制肾素血管紧张素系统、清除自由基和抗骨质疏松等药理作用[1-3]。近期研究[4]发现丹参注射液对大鼠脑组织损伤具有良好的保护作用,但丹参酚类化合物在脑组织药代动力学研究的报道较少。目前国内外测定脑组织中药物含量多采取组织匀浆法[5]或抽取脑脊液[6]进行测定,存在离体、干扰生命过程、样品处理繁琐和易被污染等缺点。微透析取样技术可在基本不干扰生物体内正常生命过程的情况下进行在体取样,样品因不含蛋白质等大分子化合物,可不经预处理直接用于测定游离药物的浓度。微透析样品具有样本量少、药物含量低等特点,因此需要高灵敏的分析方法。液相色谱-化学发光(HPLC-CL)联用技术具有高选择性、高灵敏度、宽线性范围等优点,适用于微透析样品的分析。本研究基于丹参酚类化合物对HAuCl4-luminol-H2O2化学发光的增强作用,建立了HPLC-CL分析法测定大鼠脑微透析液中DSS、PAL和SalB 3种酚类化合物浓度的新方法,并将其成功地应用于丹参酚类化合物在脑组织的药代动力学研究,为进一步阐明丹参水溶性成分对脑组织保护的作用机理提供科学依据。
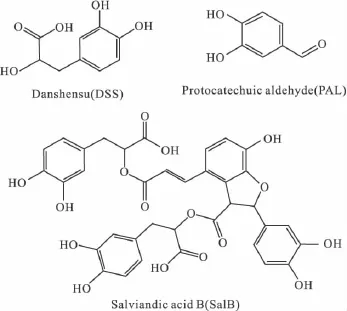
Fig 1 Chemical structures of danshensu(DSS),protocaechuic aldehyde(PAL),and Salviandic acid B(SalB)
1 仪器与试剂
1.1 仪器 HPLC-CL分析系统包括岛津LC-20高效液相色谱仪(20 μl定量环,四元泵,DAD检测器),IFFM-E蠕动泵、IFFS-A化学发光检测器(西安瑞迈电子科技有限公司)。脑立体定位仪(ZH-蓝星,淮北正华生物仪器设备有限公司)。微透析系统包括CMA/400微量注射泵和CMA/150动物恒温控制器(CMA,Stockholm,瑞典)。超纯水系统(Millipore,USA)。脑探针(CMA/12,膜长4 mm,截留分子质量2×104)。
1.2 药品与试剂 DSS和PAL对照品购自中国药品生物制品检定所,SalB对照品购自上海融禾医药科技发展有限公司。鲁米诺贮备液:取鲁米诺(Merck,Darmstadt,Germany)适量,溶于 0.10 mol·L-1的NaOH中,制得0.1 mmol·L-1的贮备液,常温避光保存。H2O2工作液由0.3 g·ml-1H2O2(宿州化学试剂有限公司)新鲜稀释而成。HAuCl4·4H2O(上海试剂一厂)溶于水制得 0.01 g·ml-1的HAuCl4。丹参滴注液(安徽天洋药业有限公司,批号:100306,规格:250 ml∶16 g)。流动相甲醇为色谱醇,其它试剂为分析纯,所用水为超纯水(18.3 MΩ cm,Millipore,USA)。灌流液为林格液(NaCl 122,KCl 3,KH2PO40.4,MgSO41.2,NaHCO325 和CaCl21.2 mmol·L-1)。
2 方法与结果
2.1 对照品溶液的配制 分别取DSS、PAL和SalB对照品,精密称定,置25 ml棕色量瓶中用甲醇稀释至刻度。得到浓度分别为2.0×10-4、2.2×10-4和2.0 ×10-4g·ml-1的 DSS、PAL、和 SalB 对照品贮备液,置4℃冰箱保存。分别取3种贮备液适量,加超纯水制成每 1 ml含 DSS 0.32 μg、PAL 0.35 μg 和SalB 0.32 μg的混合对照品溶液。
2.2 丹参滴注液供试品溶液的配制 取丹参滴注液1 ml,置100 ml量瓶中,加水稀释至刻度,摇匀,取该溶液1 ml,置50 ml量瓶中加水稀释至刻度,0.22 μm微孔滤膜过滤,即得。
2.3 色谱条件 色谱柱:Shim pack ODS(250 mm×4.6 mm,5 μm);流动相 A:水(含 0.1%磷酸,V/V),B:甲醇(含0.1%磷酸,V/V);采用梯度洗脱(0~15 min,25% ~ 50%B,15 ~ 30 min,50%B),流速为1.0 ml·min-1;柱温 30℃;进样量:20 μl。检测器:二极管阵列检测器(DAD)和化学发光(CL)检测器同时串联检测。
2.4 化学发光条件 鲁米诺:20 μmol·L-1;H2O2溶液:50 μmol·L-1;HAuCl4溶液:40 mg·L-1。化学发光试剂流速:2.0 ml·min-1,光电倍增管电压:-600 V。
2.5 化学发光条件的选择 从发光效率、稳定性和兼容性等方面对化学发光流路进行优化选择。优化实验中所用的酚类化合物浓度分别为DSS 86.08、PAL 87.52 μg·L-1、SalB 82.56 μg· L-1,电压-900 V。
3种酚类化合物经液相色谱分离后先与HAuCl4溶液混合,再与H2O2溶液混合,最后于鲁米诺溶液混合,所得的发光信号最稳定且最强。若鲁米诺与H2O2的混合顺序调换,则基线噪声明显增大。
考察了 pH 9.16~13.00范围内的 NaHCO3、Na2CO3、Na2CO3和NaOH溶液对发光光强的影响,见Fig 2A。当pH低于9.50时,DSS、PA和CA的增强峰非常微弱,且PAL呈现倒峰,SalB和SalA无信号。Cui等[7]发现 luminol-H2O2-Co2+发光体系中,当pH在一定范围内时,一些具有邻羟基的酚类化合物可同时出现增强和抑制峰。采用pH 10.83的NaHCO3-Na2CO3缓冲液时,待测酚类化合物的发光信号最强。可能是由于碳酸盐对luminol-H2O2体系的发光有增强作用[8]。而当鲁米诺溶于pH 11.00或pH 12.00的NaOH溶液中时,基线和发光信号均消失。当NaOH溶液的pH达到13.0时,可观察到基线,但待测酚类化合物无信号。
实验考察了pH 10.83 NaHCO3-Na2CO3缓冲介质中0.8 ~50.0 μmol·L-1浓度范围内鲁米诺对发光强度的影响。当鲁米诺浓度达到20.0 μmol·L-1时3种待测酚类化合物的发光强度最大,见Fig 2B。
实验考察了 20.0 ~80.0 μg·L-1浓度范围内的HAuCl4对发光强度的影响,见图2C。当HAuCl4浓度达到40.0 mg·L-1时,3种待测酚类化合物的发光强度最大。
实验考察了 0.01~0.5 mmol·L-1的 H2O2对发光强度的影响。待测物的发光强度随H2O2浓度的增加而增加,见Fig 2D,当H2O2浓度高于0.05 mmol·L-1时,基线噪声明显增加,发光信号的重现性降低。
考察了0.6~2.3 ml·min-1流速对发光强度的影响,见Fig 2E。当流速低于2.0 ml·min-1时,3 种酚类化合物的发光强度随流速的增加而增加,当高于此流速时,发光强度开始下降且基线开始波动。

Fig 2 Effects of(A)pH of Na2CO3-NaHCO3buffer;(B)concentra-tion of luminol;(C)concentration of HAuCl4;(D)concentration of H2O2;(E)flow rate on the relative CL intensities
2.6 微透析样品的采集 ♂Spraque-Dawley(SD)大鼠,清洁级,体质量(300±20)g,由安徽医科大学实验动物中心提供。
6只♂ SD大鼠腹腔注射水合氯醛(300 mg·kg-1)麻醉后用脑立体定位仪固定大鼠,将脑探针植入左侧皮质(前囟后0.8 mm,旁左开1.5 mm,深4.0 mm),用林格液以 2.0 μl·min-1的流速灌流,平衡时间为2 h,连续收集3个空白透析液样品后大鼠尾静脉注射丹参滴注液(DSS 2.5 mg·kg-1、PAL 0.4 mg·kg-1、SalB 0.4 mg·kg-1)并收集样品,脑透析液收集时间间隔为15.0 min。实验过程中用动物恒温控制器使动物体温保持37℃,收集样品置4℃冰箱中保存,0.25和0.5 h的样品用林格液稀释两倍后进样,在12 h内完成测定。
2.7 探针回收率的测定 将探针置入已知浓度(Cs)的对照品溶液中,以脑微透析相同的灌流液、流速和时间间隔收集体外透析液,进行按前述色谱条件进行测定透析液中待测物的浓度(Cdial),计算探针的体外回收率:Rinvitro=Cdia/Cs[9]。
将探针植入大鼠大脑皮质,用含有已知浓度(Cperf)对照品的林格液灌流,流速和时间间隔收集透析液,进行按前述色谱条件进行测定透析液中待测物的浓度(Cdial),计算探针的体内回收率:Rinvivo=(Cperf~ Cdial)/Cperf[10]。
2.7.1 流速对探针回收率的影响 将脑探针浸入含有DSS、PAL和SalB的混合对照品溶液中(DSS、PAL和 SalB的浓度分别为 327.68、352.00和480.00 μg·L-1),用空白林格液在不同流速(2.5、2.0、1.5、1.0 μl·min-1)下灌注脑探针,每种流速下每支探针收集3个微透析样品,每次15 min,测定各流速下探针的回收率,回收率随流速的增加而降低,结果见Tab 1。
Tab 1 Effects of perfusing rate on the recovery of probe¯ ± s,n=3)
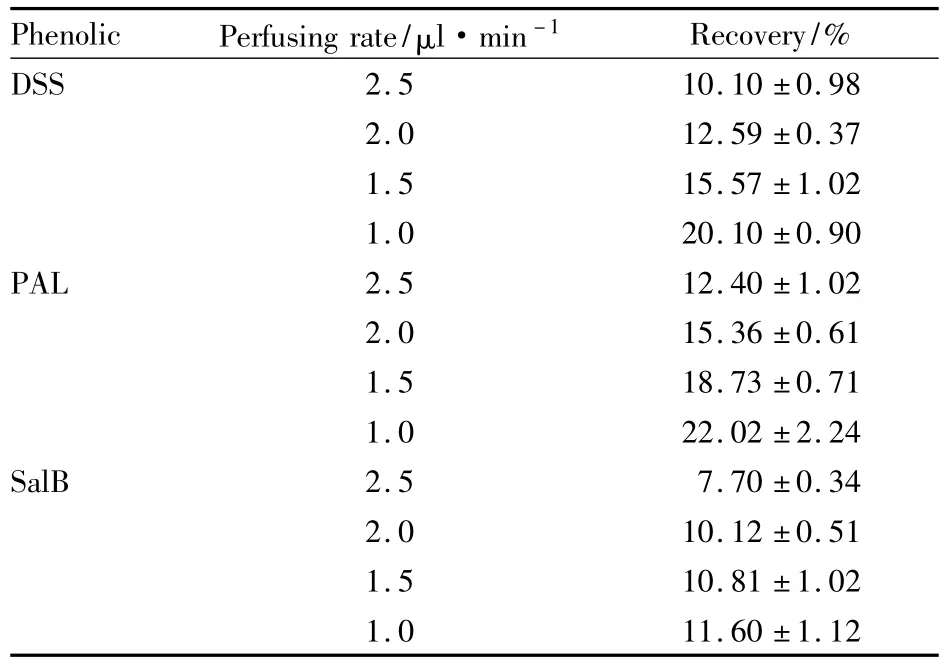
Tab 1 Effects of perfusing rate on the recovery of probe¯ ± s,n=3)
Phenolic Perfusing rate/μl·min -1Recovery/%DSS 2.5 10.10 ±0.98 2.0 12.59 ±0.37 1.5 15.57 ±1.02 1.0 20.10 ±0.90 PAL 2.5 12.40 ±1.02 2.0 15.36 ±0.61 1.5 18.73 ±0.71 1.0 22.02 ±2.24 SalB 2.5 7.70 ±0.34 2.0 10.12 ±0.51 1.5 10.81 ±1.02 1.0 11.60 ±1.12
2.7.2 待测物浓度对探针回收率的影响 分别测定了脑探针对不同浓度的DSS、PAL和SalB的体外及体内回收率,结果表明(Tab 2),体外和体内回收率大小与药物浓度无关。体内回收率均高于体外回收率,可能是由于体内温度为37℃,高于体外的温度(室温20℃),而较高的温度下,物质在组织中的扩散增加,分子热运动也增加,增大了物质扩散进微透析膜中的概率,引起物质转移系数值的变化,相对回收率随之增加。Menachery等[11]对这一现象做了深入的研究。
Tab 2 Effects of analytes’concentration on the recover of probe±s,n=3)
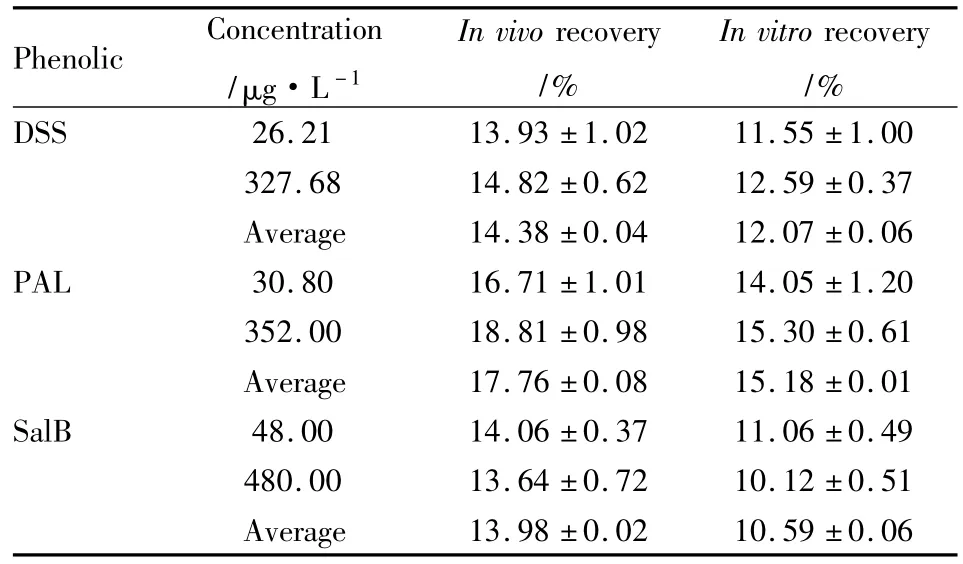
Tab 2 Effects of analytes’concentration on the recover of probe±s,n=3)
Phenolic Concentration/μg·L -1 In vivo recovery/%In vitro recovery/%DSS 26.21 13.93 ±1.02 11.55 ±1.00 327.68 14.82 ±0.62 12.59 ±0.37 Average 14.38 ±0.04 12.07 ±0.06 PAL 30.80 16.71 ±1.01 14.05 ±1.20 352.00 18.81 ±0.98 15.30 ±0.61 Average 17.76 ±0.08 15.18 ±0.01 SalB 48.00 14.06 ±0.37 11.06 ±0.49 480.00 13.64 ±0.72 10.12 ±0.51 Average 13.98 ±0.02 10.59 ±0.06
2.7.3 增量法与减量法测定回收率的比较 用增量法和减量法分别测定了脑探针在3 h内对DSS、PAL和SalB的体外回收率,结果分别见Fig 3A~3C。增量法测定探针对DSS、PAL和SalB的回收率的RSD分别为4.96%、4.08%和4.97%;脑探针对DSS、PAL和SalB的回收率的RSD分别为3.13%、4.03%和3.71%。表明探针的回收率在3 h内保持稳定。两种方法测定DSS、PAL和SalB的回收率的RSD分别为6.5%、4.8%和6.5%,表明探针DSS、PAL和SalB的回收率和传递率相等。
2.8 数据处理 用体内回收率(Rinvivo),将测得脑透析液中待测物浓度(Cm)折算为大鼠脑组织中的浓度(Cf):Cf=Cm/Rinvivo。所得的脑组织中待测药物浓度-时间数据,用Drug And Statistics 2.0(DAS 2.0)软件进行分析,用统计矩求算药代动力学参数。
3 结果
3.1 色谱行为 在上述色谱条件下,DSS、PAL和SalB得到较好的分离,保留时间分别为5.7、8.8和21.4 min。丹参滴注液供试品溶液的HPLC-CL图谱见Fig 4A,空白脑微透析液的图谱见Fig 4B,空白脑微透析液加入DSS、PAL和SalB对照品的HPLC-CL图谱见Fig 4C,丹参滴注液给药后0.5 h收集的脑微透析液图谱见Fig 4D。
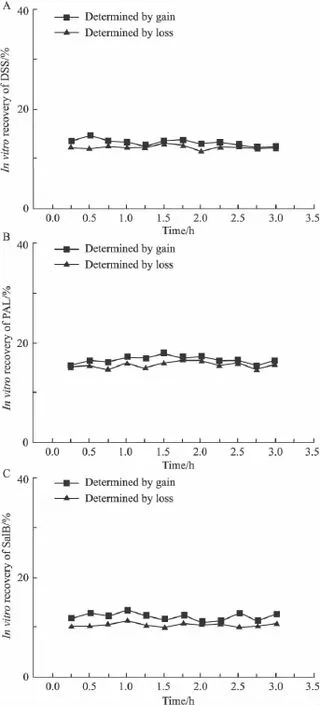
Fig 3 In vitro recoveries of brain probes for DSS,PAL and SalB in 3 h determined by gain(■)and loss(▲)
3.2 线性关系及检测限 由于透析液微透析采样所的样品中不含有蛋白等基质,因此一般方法学考察都是在空白灌流液中进行。取林格液(灌流液)加入DSS、PAL和SalB 3种酚类化合物配成系列工作溶液。以每种酚类化合物的相对发光强度的对数(lgΔI)对其质量浓度(单位:μg·L-1)的对数 lgC进行线性回归,得到回归方程和相关系数,见Tab 3。各酚类化合物的线性关系良好(r>0.990),检测限较低。
3.3 精密度和准确度 取空白林格液,分别加入DSS、PAL和SalB制备低、中、高3个浓度的质量控制样品(DSS 4.07、26.21、327.68 μg·L-1,PAL 8.80、30.08、352.00 μg·L-1,SalB 16.00、48.00 和640.00 μg·L-1),日内每个浓度测定 5 次,计算RSD;连续5 d每日测定5次,计算RSD,以标准曲线法计算浓度与真实浓度的百分比计算准确度。日内和日间RSD均小于5.5%,3种酚类化合物的准确度在95.09到103.55%范围内,结果见Tab 4。
3.4 丹参滴注液含量测定 分别精密吸取供试品溶液与对照品溶液各20 μl,按“1.2”的分析条件进行测定,结果丹参滴注液中DSS、PAL和SalB的含量分别为 0.49、0.079 和0.078 g·L-1(n=6)。

Fig 4 Representative HPLC-CL chromatograms

Tab 3 Calibration curves,linear ranges,and LODs for DSS,PAL,and SalB in Ringer's solution of the HPLC-CL method
Tab 4 Precisions and accuracies for DSS,PAL,and SalB in Ringer’s solution of the HPLC-CL method( ± s,n=5)

Tab 4 Precisions and accuracies for DSS,PAL,and SalB in Ringer’s solution of the HPLC-CL method( ± s,n=5)
Compound AddedIntra-dayAccuracy/% RSD/% Inter-dayAccuracy/% RSD/%/μg·L -1measured/μg·L -1 measured/μg·L -1 DSS 4.07 3.90 ±0.14 95.82 3.59 3.87 ±0.16 95.094.13 26.21 25.72 ±1.02 98.13 3.96 25.98 ±1.42 99.12 5.46 327.68 330.24 ±6.96 100.78 2.11 331.63 ±7.90 101.20 2.38 PAL 8.80 8.53 ±0.43 96.93 5.04 8.49 ±0.38 96.48 4.47 30.80 30.87 ±1.64 100.23 5.31 29.76 ±1.56 96.62 5.24 352.00 342.20 ±8.39 97.22 2.45 353.98 ±8.98 100.56 2.53 SalB 16.00 15.60 ±0.74 97.50 4.74 15.32 ±0.75 95.75 4.89 48.00 49.08 ±1.99 102.25 4.05 47.94 ±2.06 99.87 4.29 640.00 647.07 ±18.77 101.10 2.90 662.76 ±16.96 103.56 2.56
3.5 脑部药动学研究 丹参滴注液单次给药后(DSS 2.5 mg·kg-1、PAL 0.4 mg·kg-1、SalB 0.4 mg·kg-1,iv)在大鼠脑微透析液中检测到 DSS,而未检测到PAL和SalB。与蛋白结合的药物因不能透过半透膜被排斥在探针外,只有游离的药物会沿浓度梯度扩散,被灌流液带出,因此脑微透析液中的丹参素只是游离的部分。经体内回收率折算所得的DSS的脑组织液游离药物浓度–时间曲线见Fig 5,其主要药代动力学参数见Tab 5。
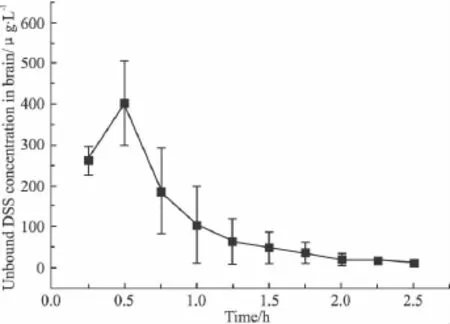
Fig 5 Unbound DSS concentration versus time curve of brain after single administration of Danshen injection(DSS 2.5 mg·kg-1,iv)to SD rats±s,n=6)
Tab 5 Pharmacokinetic parameters of danshensu in rat brain after single administration of Danshen injection(3.5 mg·kg-1,iv)(±s,n=6)

Tab 5 Pharmacokinetic parameters of danshensu in rat brain after single administration of Danshen injection(3.5 mg·kg-1,iv)(±s,n=6)
Parameter Estimate T 12/h 0.64±0.20 AUC0-∞ /μg·h·L-1 369.39 ±114.77 MRT0-∞ /h 0.64±0.18 K 1.36±0.27
4 讨论
4.1 色谱条件的选择 本实验中,液相色谱的流动相不仅要使DSS、PAL和SalB得到良好的分离,而且应与HAuCl4-luminol-H2O2化学发光检测系统相兼容。实验中采用了甲醇-乙酸-水[12],甲醇-甲酸-水,甲醇-磷酸-水,乙腈-乙酸-水等流动相。结果发现,流动相中乙酸和甲酸的加入,会导致化学发光信号的熄灭,而乙腈作为有机相并不能改善化学发光基线的漂移。因此,本实验中我们采用0.1%磷酸(V/V)-0.1%磷酸甲醇(V/V)为流动相进行梯度洗脱,流速1.0 ml·min-1。3种水溶性成分在22 min内得到了良好分离。
4.2 微透析采样条件的选择 实验结果显示,探针周围待测物浓度对探针的回收率无影响;探针回收率随着灌流速度的增加而降低。在低流速下,探针渗透膜内外溶液的扩散接近平衡,因此相对回收率较高;但在低流速下,在单位时间内收集到的渗析样品体积较小。需要较长的采样时间以收集足够体积的样品供HPLC进样,将降低时间分辨率而丢失部分浓度变化信息时,灌流速度过大时,将破坏大鼠正常生理状态。综合考虑上述因素,本实验最终确定以 2.0 μl·min-1的灌流速度和 15 min 的采样间隔,收集脑微透析样品。
4.3 脑组织药代动力学研究 部颁标准[13]仅以原儿茶醛作为丹参滴注液的质控指标。近代药理研究发现丹参注射液对大鼠脑组织损伤具有良好的保护作用,但到底是哪种成分易于透过血脑屏障而发挥作用,尚未有结论。故本研究在丹参滴注液部颁标准的基础上选用DSS、PAL和SalB 3种酚类化合物作为考察指标,建立其在大鼠给药丹参滴注液后脑微透析液中的含量测定方法,对脑组织中游离的丹参酚类化合物进行监测。
丹参滴注液单次尾静脉给药后,在脑透析液中可检测到DSS,但未检测到PAL和SalB,可能原因有:其一,PAL和SalB不易透过血脑屏障;其二,与3种丹参酚类化合物的蛋白结合率有关。与蛋白结合的药物因不能透过半透膜被排斥在探针外,只有游离的药物会沿浓度梯度扩散,被灌流液带出。Yang等[14]报道PAL的体外大鼠血浆蛋白结合率约为55%-75%,SalB高达80%以上,而DSS仅为5%左右,故脑组织中游离PAL和SalB含量可能极低,低于本法的检测限。
为进一步验证,取大鼠给药后20 min的脑组织匀浆和血液经预处理后测定,发现脑组织匀浆和血浆中均测得DSS和SalB而未测得PAL。说明SalB能够透过血脑屏障,可能由于蛋白结合率高,游离的SalB少,采用微透析法未能测得游离的SalB。而PAL则可能在体内迅速被代谢,有文献[15]报道丹参水溶性提取物中的其他成分使原儿茶醛在大鼠体内吸收减少、消除变快;另有文献[16]报道,质谱分析结果表明原儿茶醛在体内易被氧化为原儿茶酸。
丹参滴注液给药后0~15 min的透析液中可检测到DSS,15~30 min的透析液中DSS浓度最高。说明DSS易于透过血脑屏障,且在脑中分布较迅速,提示丹参素为一个潜在的脑部保护剂,该结果为丹参滴注液的脑组织损伤保护的作用机制提供了科学依据,并为中药丹参治疗脑部疾病的临床应用提供了有效信息。
[1]刘启功,孙玉梅,程燕子,等.丹参注射液限制犬心肌梗死范围及其机制研究[J].中国药理学通报,2005,21(9):1078 -81.
[1]Liu Q G,Sun Y M,Cheng Y Z,et al.Restrictive effect of salvia miltiorrhiza on myocardial infarct area in dogs and possible mechanism[J].Chin Pharmacol Bull,2005,21(9):1078 - 81.
[2]Zhou L,Zuo Z,Chow M S,et al.Danshen:an overview of its chemistry,pharmacology,pharmacokinetics,and clinical use[J].J Clin Pharmacol,2005,45(12):1345 -59.
[3]孙 宇,崔 燎,吴 铁.盐酸水提法制备丹参水溶性有效部位群及其对成骨细胞活性测定[J].中国药理学通报,2008,24(3):377-81.
[3]Sun Y,Cui L,Wu T.Preparation of Salviam iltiorrhiza utility aqueous extract by hydrochloric acid method and evaluation on osteoblast[J].J Clin Pharmacol,2008,24(3):377 - 81.
[4]张海宇,马全瑞,张莲香,等.丹参注射液对大鼠脑出血灶周围凋亡神经元超微结构的影响[J].神经解剖学杂志,2009,25(5):515-8.
[4]Zhang H Y,Ma Q R,Zhang L X,et al.Effect of salviaem iltiorrhiza injection on ultrastructure of apoptotic neurons that surround intracerebral hemorrhage in rats[J].Chin J Neuroanat,2009,25(5):515-8.
[5]罗世英,钟志国,林坚涛,等.丹参水提物在灌胃大鼠血浆和脑组织中浓度测定及药代动力学研究[J].中药药理与临床,2009,25(4):44 -8.
[5]Luo S Y,Zhong Z G,Lin J T,et al.Quantitation and pharmacokinetic study of rat brain tissue after oral administration of water extract of salvia miltiorrhixa[J].Pharmacol Clin Chin Mater Med,2009,25(4):44 -8.
[6]郑晓晖,赵 欣,房敏峰,等.复方丹参方中使药冰片对君药丹参药代动力学的影响[J].西安交通大学学报(医学版),2007,28(2):170-3.
[6]Zheng X H,Zhao X,Fang M F,et al.Pharmacokinetic effects of Shi herb-Borneol on Jun herb-Salvia Miltiorrhiza[J].J Xi’an Jiaotong Univ(Med Sci),2007,28(2):170 -3.
[7]Cui H,Shi M J,Meng R,et al.Effect of pH on inhibition and enhancement of luminol-H2O2-Co2+chemiluminescence by phenolic compounds and amino acids[J].Photochem Photobiol,2004,79(3):233-41.
[8]Yeh H C,Hsu W T,Lin W Y.Enhancement in Chemiluminescence by Carbonate for Cobalt(Ⅱ)-catalyzed Oxidation of Luminol with Hydrogen Peroxide[J].J Chin Chem Soc,2005,52(4):657 -64.
[9]Stenken J A,Lunte C E,Southard M Z,et al.Factors that influence microdialysis recovery.Comparison of experimental and theoretical microdialysis recoveries in rat liver[J].J Pharm Sci,1997,86(6):958-66.
[10]Evrard P A,Deridder G,Verbeeck R K.Intravenous microdialysis in the mouse and the rat:development and pharmacokinetic application of a new probe[J].Pharm Res,1996,13(1):12 -7.
[11]Menachery S,Hubert W,Justice J B Jr,et al.In vivo calibration of microdialysis probes for exogenous compounds[J].Anal Chem,1992,64(6):577 -83.
[12]李晓蓉,李晓莉,王丽娟,等.丹参水溶性主成分丹参素和阿魏酸合用的药动学相互作用[J].中国药理学通报,2007,23(7):968-72.
[12]Li X R,Li X L,Wang L J,et al.Pharmacokinetic interaction of ferulic acid and danshensu,the hydrophilic principal components of danshen and chuanxiong[J].Chin Pharmacol Bull,2007,23(7):968-72.
[13]WS3-B-3766-98.部颁标准中药成方制剂第二十册[S]:20-34.
[13]WS3-B-3766-98.Chinese traditional patent formulation of the standard Issued by the Ministry of Public Health[S]:Vol 20,20 -34.
[14]Yang X N,Wang Y J,Liu Y S,et al.Effects of Panax quinquefolium protopanaxadiol saponins on the animal and human plasma protein binding of salvianolic acids in vitro[J].Asian J Pharm Sci,2007,2(4):170 -9.
[15]宋 敏,杭太俊,张正行.丹参提取物有效成分在大鼠体内的药代动力学和相互影响研究[J].药学学报,2007,42(3):301-7.
[15]Song M,Hang T J,Zhang Z X.Pharmacokinetic interactions between themain components in the extracts of Salvia miltiorrhiza Bge.in rat[J].Acta Pharm Sin,2007,42(3):301 - 7.
[16]郑晓晖,王世祥,赵新锋,等.复方丹参滴丸人含药血清中丹参相关代谢产物的分析[J].第四军医大学学报,2007,28(5):435-7.
[16]Zheng X H,Wang S X,Zhao X F,et al.Analysis on Danshen-related metabolites induced by compound danshen dripping pills in human serum[J].J Fourth Mil Med Univ,2007,28(5):435 - 7.

