PTEN抑制剂对大鼠内毒素性急性肺损伤的保护作用
葛东建,刘功俭
急性肺损伤(acute lung injury,ALI)和急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是由多种炎性介质及效应细胞共同参与,并呈级联放大的瀑布样炎症继发性损伤与继发性弥漫性肺实质损伤[1],是临床常见的呼吸系统急危重症。由于ALI/ARDS病因与发病机制的复杂性,近年来尽管进行了大量的研究,但其病死率仍居高不下。
PI3K/Akt信号转导通路是一个促进细胞生长、存活、分化的信号通路。有研究证实[3]激活该信号通路,能保护氧化应激状态下的肺上皮细胞[2]和抑制肺上皮细胞凋亡。但PI3K/Akt在内毒素(LPS)诱导的ALI中的作用还不十分清楚。PTEN蛋白(Phosphatase and tensin homologue deleted on chromosome ten)是PI3K/Akt通路主要的负性调节器,通过磷脂酶活性使PIP3脱磷酸,抑制PI3K/Akt信号通路[4]。phen是PTEN的特异性抑制剂,目前已被广泛的应用于科学研究。本文通过研究phen对ALI中Akt活化的影响来探讨其在LPS诱导ALI中的作用及可能机制。
1 材料与方法
1.1 动物 成年♂ SD大鼠,体质量230~250 g,购自中国科学院上海实验动物中心。
1.2 试剂 LPS(E coli,055:B5)购自 Sigma(St Louis,MO)。Bpv(phen)购自 Alexis。抗 Akt抗体(sc-9272)、抗p-Akt(sc-9271)抗体均购自 Cell Signaling。TNF-α和IL-6酶联免疫试剂盒购自武汉博士德。
1.3 模型制备和分组 取32只大鼠,随机分为两组:LPS组和phen+LPS组(n=16),比较了两组大鼠48 h的累计死亡率。
另取60只大鼠被随机分为4组:对照组(control组,n=6),仅注射等体积的生理盐水;LPS组(n=24),经尾静脉注射LPS 5mg·kg-1;phen+LPS组(n=24),在注射 LPS前1 h腹腔注射 phen 1.6 μmol·kg-1;phen 组(n=6),腹腔注射 phen 1.6 μmol·kg-1,1 h后经尾静脉注射生理盐水。本实验中所选择的药物剂量以及给药方式是参照文献[5]以及我们的预实验结果。
实验动物在各时间点,麻醉状态下经腹主动脉放血处死。开胸暴露两肺。取出右肺中叶,迅速冻存于液氮中以备匀浆。取右肺下叶,浸泡于10%中性甲醛溶液中固定,然后用石蜡包埋制成蜡块,5 μm厚连续石蜡切片,HE染色,在光镜下观察肺组织的病理学变化。取右肺上叶,称湿重,然后置于80℃烘箱中烘烤直至恒重再称重,计算肺湿干重比(W/D)。结扎右肺门,用5ml预冷的PBS分3次灌洗左肺。回收率达到90%。回收的支气管肺泡灌洗液(bronchoalveolarlavage fluid,BALF)储存在 -80℃以备检测蛋白和细胞因子浓度。BALF中的蛋白浓度测定采用BCA法(Bicinchoninic acid)。TNF-α和IL-6的浓度测定采用双抗体夹心酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)。
1.4 蛋白质印迹分析(Western blot)参照文献[6],提取组织的胞质蛋白。用BCA法测定蛋白浓度,然后保存于-80℃待用。
蛋白样本加入4倍的上样缓冲液,煮沸5 min。等量蛋白样品经12%SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,以半干转法电转移至硝酸纤维素膜上。转移后的硝酸纤维素膜经3%牛血清白蛋白室温封闭2 h后,分别加入下列一抗4℃过夜:抗Akt抗体(1∶1 000)、抗p-Akt抗体(1∶500)。用Tris缓冲液吐温-20(TBST)洗膜3遍,然后用相应的碱性磷酸酶标记的二抗室温孵育2 h,最后用NBT/BCIP(Promega,上海)显色。扫描结果用图像分析仪(LabWorks Software,UVP Upland,CA,USA)处理,数据进行半定量分析。
2 结果
2.1 phen对LPS导致的死亡率的影响 LPS组,大鼠48 h死亡率高达56.3%(共死亡9只)。而phen+LPS组,大鼠48 h死亡率仅有18.8%(共死亡3只),明显低于LPS组(P<0.05),见Fig 1。

Fig 1 phen,PTEN inhibitor,suppresses LPS-induced mortality For the phen+LPS group,rats were injected with phen(1.6 μmol·kg-1,ip)1 hour before LPS(5 mg·kg-1,iv)treatment.P < 0.05 for phen+LPS group(n=16)vs LPS group(n=16)
2.2 BALF中蛋白浓度的变化 LPS组,LPS注射后6 h,BALF中的蛋白浓度明显高于Control组(P<0.05);在phen+LPS组,BALF中蛋白浓度比LPS组降低(P<0.05);而单独注射phen对BALF中的蛋白渗出无影响(Tab 1)。
Tab 1 Effect of phen on protein exudation in BALF and lung wet/dry weight ratio±s,n=6)
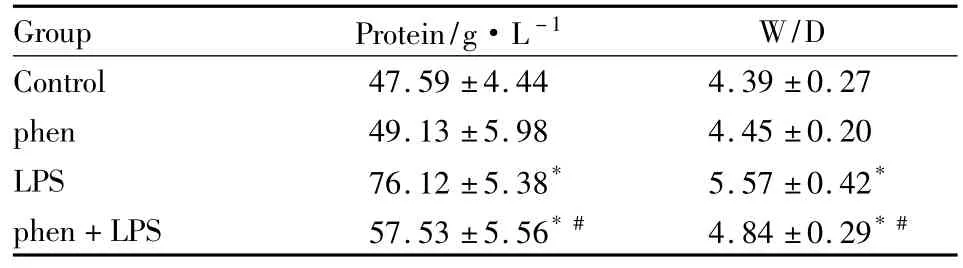
Tab 1 Effect of phen on protein exudation in BALF and lung wet/dry weight ratio±s,n=6)
*P<0.05 vs control group;#P<0.05 vs LPS group
Group Protein/g·L-1W/D Control 47.59±4.44 4.39±0.27 phen 49.13±5.98 4.45±0.20 LPS 76.12±5.38* 5.57±0.42*phen+LPS 57.53±5.56*# 4.84±0.29*#
2.3 BALF中 TNF-α和 IL-6浓度的变化 LPS组,BALF中的TNF-α浓度明显升高,注射LPS后3 h达峰值,随后开始下降;而在phen+LPS组,BALF中TNF-α浓度与 LPS组比较降低(P<0.05,Fig 2A)。同样,phen+LPS组BALF中的IL-6浓度也明显低于LPS组(P<0.05,Fig 2B)。而在phen组,单独注射phen对BALF中TNF-α和IL-6的释放无影响(Fig 2A和2B)。
2.4 肺组织病理变化 注射LPS后6 h肺组织病理切片光镜观察,LPS组肺组织结构破坏明显,肺泡内出血较多,肺泡委陷,伴有大量炎性细胞浸润,间质明显水肿(Fig 3B);而phen+LPS组上述表现均有所减轻,仅肺间隔轻度增宽,无明显出血,少量炎性细胞浸润(Fig 3C)。图3A为正常肺组织切片。单独注射phen,对肺组织结构无影响(Fig 3D)。
2.5 肺湿/干重比值的变化 LPS注射后6 h,肺组织的W/D值明显高于control组(P<0.05)。而在相同的时间点,phen抑制了LPS导致的肺W/D值的增加(P<0.05),而单独注射phen的W/D值与control组相比,其差异无统计学意义(P>0.05)。见Tab 1。
2.6 肺组织中p-Akt的活化 LPS明显减少胞质中p-Akt含量,在LPS组,注射LPS后p-Akt表达随时间延长越来越少,到12 h几乎无表达(Fig 4A);提前注射phen在各时间点均明显提高p-Akt的表达(Fig 4B)。各组间Akt表达没有变化(Fig 4A,4B)。
3 讨论
急性肺损伤/急性呼吸窘迫综合征(ALI/ARDS)的发生发展涉及多个信号转导途径。以往研究较多的是 NF-κB 和 MAPK 信号转导通路[7,8],因为已明确该通路可诱导多种炎性细胞因子的表达。但由于近年来对PI3K/Akt信号转导通路的关注,人们发现PI3K/Akt信号转导通路是保护肺上皮细胞和缓解肺部炎症的重要通路之一[5,9]。

Fig 2 LPS-induced alterations of TNF-α and IL-6 levels in bronchoalveolar lavage fluid(BALF)from rats and the suppression of phen±s)A:The concentrations of TNF-α in BALF at each time point after LPS administration and the suppression of phen pretreatment.B:The concentrations of IL-6 in BALF at each time point after LPS administration and the suppression of phen pretreatment.*P<0.05 vs control group;#P<0.05 vs LPS group

Fig 3 Microscopic findings of lung tissues stained with hematoxylin-eosin(HE,×400)Histopathologic examination of the lungs was performed at 6 h after LPS injection.A:Control group;B:LPS group:edematous changes of alveolar walls,swelling of alveolar epithelial cells,and massive polymorphonuclear infiltration were observed;C:phen+LPS group:less damage was observed compared with the LPS group;D:phen group:no differences were observed compared with control group

Fig 4 The expression of p-Akt in cytoplasm of lung tissues(¯±s,n=3 or 4)
PTEN是目前发现的第一个具有磷酸酶活性的抑癌基因。其编码的磷酸酶具有蛋白和脂质磷酸酶活性,PIP2在PI3K的磷酸化作用下生成PIP3,从而介导Akt的活化,PTEN却可以发挥它的磷脂酶活性使PI3K的脂质产物PIP3的3位脱磷酸,下调由PI3K/Akt通路控制的细胞生长和存活[9]。因此,PI3K和PTEN之间关键的平衡对细胞存活有重要的影响。而有资料表明PTEN相对较多的分布于分化初期的人肺上皮细胞[9]。
在本实验中,在注射LPS之前使用phen特异性抑制PTEN,活化PI3K/Akt信号转导通路能减轻肺实质损伤。与LPS组相比较,这种对LPS-ALI肺实质的保护导致了存活率的明显改善。该保护作用还进一步被组织病理学检查所证实。肺组织HE染色显示,预先注射phen后,LPS导致的肺组织损伤程度明显减轻。以上这些均表明,PTEN抑制剂能够缓解LPS导致的急性肺损伤。
那么,PTEN抑制剂是如何发挥其保护作用的呢?肺泡上皮细胞和毛细血管内皮细胞共同组成重要的屏障,以维持肺组织稳定和肺泡最佳的气体交换,并限制肺泡内液体渗出[10-11]。在本实验中,注射LPS后,肺泡上皮和毛细血管内皮屏障功能明显受损,从而导致肺泡内有大量的蛋白和液体渗出并释放大量炎性因子,同时肺组织中p-Akt表达明显降低;而预先使用phen后肺泡内渗出和炎性因子释放明显减少,可能与活化PI3K/Akt信号转导通路导致p-Akt表达增加,加快了损伤的肺上皮和毛细血管内皮屏障修复致使渗出减少有关,该结果与先前学者报道的加速离体肺上皮细胞机械性损伤修复相一致[5,9]。
总之,本实验证实,PTEN抑制剂在LPS导致的ALI中发挥着重要的保护作用。这一作用可能与其诱导肺组织中Akt活化,进而加快肺泡上皮和毛细血管内皮屏障的修复,减少肺泡内蛋白和液体的渗出及炎性因子的释放有关。短暂抑制PTEN在人体ALI的详细机制还需要进一步研究,并且可以考虑作为一种可能的治疗方法来预防或者治疗ALI。
[1]张秋金,沈 洪,张 维,等.纳洛酮与甲基泼尼松龙联用对急性肺损伤大鼠肺组织核转录因子-κB表达的影响[J].中国危重病急救医学,2005,17(6):370-2.
[1]Zhang Q J,Shen H,Zhang W,et al.Effects of combined naloxone and methylprednisolone on nuclear factor-κB expression in the lung in acute lung injury in rats[J].Chin Crit Care Med,2005,17(6):370-2.
[2]Ray P,Devaux Y,Stolz D B,et al.Inducible expression of keratinocyte growth factor(KGF)in mice inhibits lung epithelial cell death induced by hyperoxia[J].Proc Natl Acad Sci USA,2003,100(10):6098-103.
[3]Bao S,Wang Y,Sweeney P,et al.Keratinocyte growth factor induces Akt kinase activity and inhibits Fas-mediated apoptosis in A549 lung epithelial cells[J].Am J Physiol Lung Cell Mol Physiol,2005,288(1):L36-L42.
[4]Zhao M.PTEN:a promising pharmacological target to enhance epithelial wound healing[J].Br J Pharmacol,2007,152(8):1141-4.
[5]Lai J P,Bao S,Davis I C,et al.Inhibition of the phosphatase PTEN protects mice against oleic acid-induced acute lung injury[J].Br J Pharmacol,2009,156(1):189-200.
[6]Cao J L,He J H,Ding H L,et al.Activation of the spinal ERK signaling pathway contributes naloxone-precipitated withdrawal in morphine-dependent rats[J].Pain,2005,118:336-49.
[7]Liu S,Feng G,Wang G L,et al.p38 MAPK inhibition attenuates LPS-induced acute lung injury involvement of NF-kappaB pathway[J].Eur J Pharmacol,2008,584(1):159-65.
[8]丁 宁,肖 慧,许立新,等.羟乙基淀粉130/0.4对大鼠内毒素性急性肺损伤ICAM-1表达的影响及MAPK信号通路在其中的作用[J].中国药理学通报,2009,25(3):394-8.
[8]Ding N,Xiao H,Xu L X,et al.Effect of hydroxyethyl starch 130/0.4 on ICAM-1 expression in endotoxin-induced acute lung injury in rats and role of MAPK signal pathway in its expression[J].Chin Pharmacol Bull,2009,25(3):394-8.
[9]Lai J P,Dalton J T,Knoell D L.Phosphatase and tensin homologue deleted on chromosome ten(PTEN)as a molecular target in lung epithelial wound repair[J].Br J Pharmacol,2007,152(8):1172-84.
[10]Mutlu G M,Sznajder J I.Mechanisms of pulmonary edema clearance[J].Am J Physiol Lung Cell Mol Physiol,2005,289(5):L685-95.
[11]Jain L,Eaton D C.Physiology of fetal lung fluid clearance and the effect of labor[J].Semin Perinatol,2006,30(1):34-43.

