O-对甲氧基苯基-N,N-二苄基酪氨酸乙酯的合成*
华允宇, 韩益丰, 夏 敏
(浙江理工大学 化学系,浙江 杭州 310018)
L-左旋甲状腺素钠(L-T4)是由美国Sando公司与MOVA制药公司联合研制开发、并于2004年6月经美国FDA批准上市的治疗甲状腺各类病症的特效药。L-T4的合成一般需经历L-酪氨酸的双官能团的保护(即氨基与羧基的保护)、偶联形成二芳醚中间体——O-对甲氧苯基-N,N-二苄基酪氨酸乙酯(1); 1经碘化、去保护、成盐等步骤达到目的。尽管这些步骤的次序可以有先后变化,但其中合成1的反应是最为关键的一步。
芳卤和酚盐参与的Ullmann反应[1~8]是制备二芳醚化合物的重要方法之一。本文以此法为基础,研究N,N-二苄基酪氨酸乙酯(2)与对溴苯甲醚(3)经偶联反应合成1(Scheme 1)的反应条件。
1 实验部分
1.1 仪器与试剂
X4型数字显微熔点仪;Autopol Ⅳ型数显微旋光仪;Brucker Avance Ⅱ 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet Avatar 735型傅立叶红外光谱仪(液膜法);HP1198型质谱分析仪(70 eV); Waters 600E-2487型高效液相色谱仪[反相C18填充柱,流动相:V(甲醇) ∶V(水)=9 ∶1,流速0.5 mL·min-1; Daicel OJ-H手性毛细管柱,流动相:V(正己烷) ∶V(乙醇) ∶V(三氟乙酸)=85 ∶15 ∶0.1,流速1.0 mL·min-1,紫外检测器220 nm]。
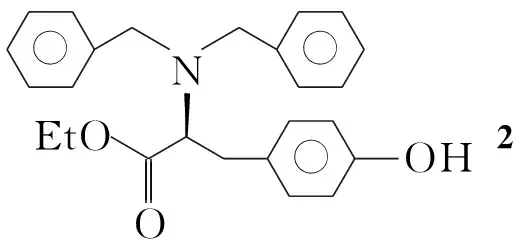
Scheme 1
2按文献[9]方法制备,其余所用试剂均为分析纯。
1.2 1的合成

2 结果与讨论
2.1 反应时间与温度对合成1的影响
2 10 mmol,315 mmol, K3PO415 mmol, CuSO4·5H2O 3 mmol,46 mmol, DMF 50 mL,反应温度100 ℃,其余反应条件同1.2,考察反时间对合成1的影响,结果见图1。由图1可知,反应约7 h后,再延长反应时间,产率无明显增加,反应已经达到一种“平台化”阶段,因此确定反应时间为8 h。

Time/h图 1 反应时间对合成1的影响*Figure 1 Effect of reaction time on synthesizing 1
*2 10 mmol,315 mmol, K3PO415 mmol, CuSO4·5H2O 3 mmol,46 mmol, DMF 50 mL,反应温度100 ℃,其余反应条件同1.2
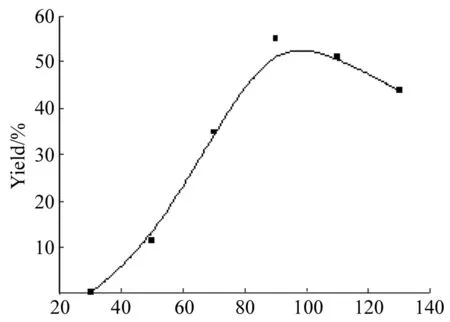
Temperature/℃图 2 反应温度对合成1的影响*Figure 2 Effect of reaction temperature on synthesizing 1
*反应时间8 h,其余反应条件同图1
反应时间8 h,其余反应条件同上,考察反应温度对合成1的影响,结果见图2。由图2可见,产率随着反应温度的升高而显著增加,但当温度超过110 ℃后,再升高温度产率明显下降。这可能是由于4在高温下不稳定,因逐步分解而导致无法有效完成偶联反应所需要的催化循环。因此,适宜的反应温度为90 ℃~110 ℃,在以下的讨论中选择反应温度为100 ℃。
2.2 缚酸剂用量对合成1的影响
于100 ℃反应8 h,其余反应条件同2.1,考察缚酸剂用量[r(K3PO4)=n(K3PO4) ∶n(2)]对合成1的影响,结果见图3。从图3可以看出,r(K3PO4)并非越大越好。偶联反应中有溴化氢产生,为了促进反应进行,理论上至少需要r(K3PO4)=1,当r接近化学计量时,产率大幅增加;当r(K3PO4)超过1.5后,产率却急速下降。由于DMF未经干燥处理,反应在敞口条件下进行,反应体系中存在水份,使得r(K3PO4)增大引起2的部分水解生成相应的羧酸盐,羧酸负离子具有与4竞争催化活性中心的能力,从而导致催化循环无法有效进行,最终使产率下降。因此,适宜的r(K3PO4)为1.0~1.5,以下讨论选择r(K3PO4)=1.3。
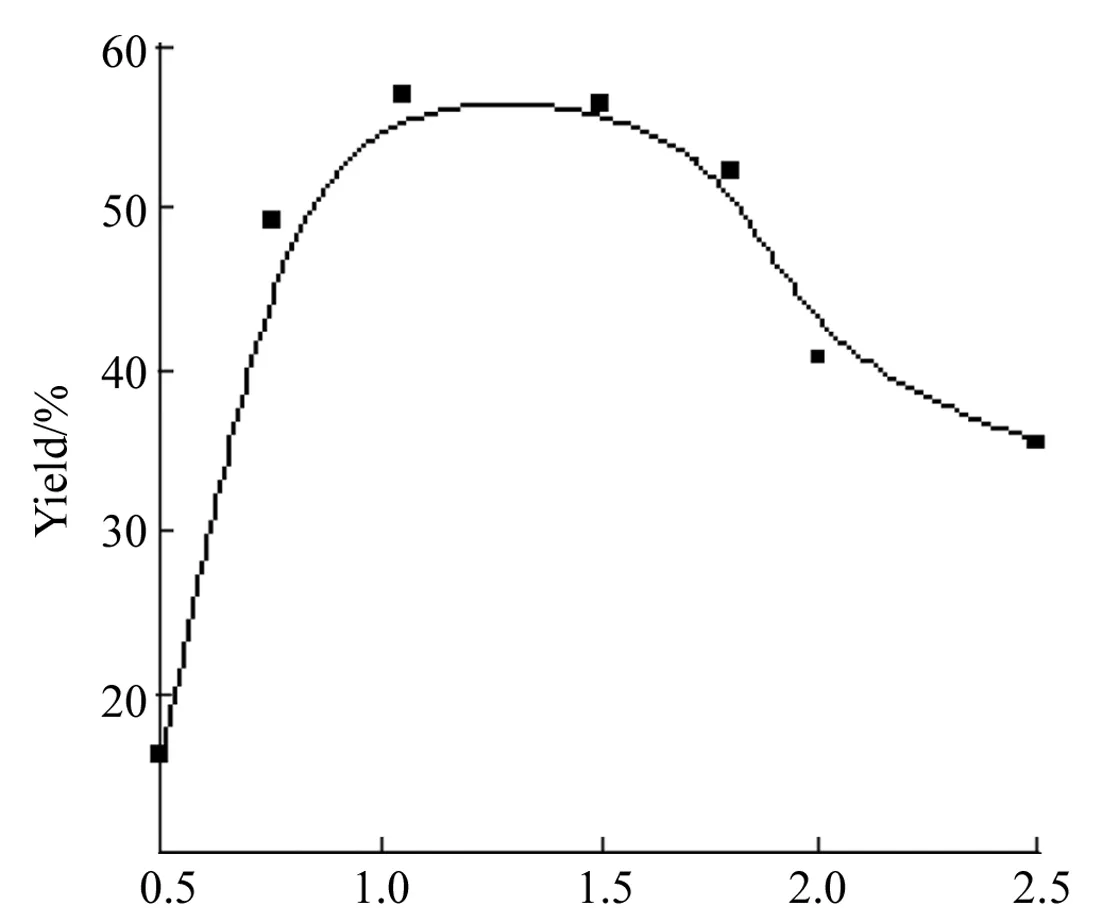
r(K3PO4)图 3 r(K3PO4)对合成1的影响*Figure 3 Effect of r(K3PO4) on synthesizing 1
*于100 ℃反应8 h,其余反应条件同图1;r(K3PO4)=n(K3PO4) ∶n(2)
2.3 催化剂用量对合成1的影响
r(K3PO4)=1.3, 于100 ℃反应8 h,其余反应条件同2.1,考察催化剂用量[q=n(CuSO4·5H2O) ∶n(2)×100%]对合成1的影响,结果见图4。由图4可知,随着q的增大,催化剂的活性中心增多,反应速率随之加快;当q=15%时,活性中心数量在催化循环中已达到动态平衡,此时再增大q,产率也不再上升。因此,q应不小于15%,以下讨论选择q=20%。

q/%图 4 q对合成1的影响*Figure 4 Effect of q on synthesizing 1
*r(K3PO4)=1.3, 于100 ℃反应8 h,其余反应条件同图1;
q=n(CuSO4·5H2O) ∶n(2)×100%
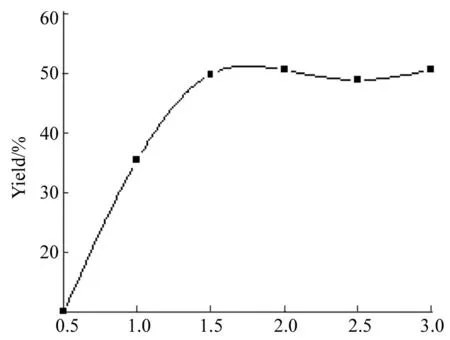
r(4) 图 5 r(4)对合成1的影响*Figure 5 Effect of r(4) on synthesizing 1
*q=20%,其余反应条件同图4;r(4)=n(4) ∶n(CuSO4·5H2O)
CuSO4·5H2O 2 mmol,其余反应条件同上,考察配体用量[r(4)=n(4) ∶n(CuSO4·5H2O)]对合成1的影响,结果见图5。由图5可见,在没有配体4存在时,CuSO4·5H2O不能发挥催化作用,无1生成,这说明4在反应中起着至关重要的作用。当r(4)=1.5时,继续增大r(4),产率未见提高,此时反应体系中已有足够量的配体存在以生成催化循环所需的活性中心。r(4)至少需要达到1.5才能保证偶联反应顺利进行,以下讨论选择r(4)=1.75。
2.4 n(3) ∶n(2)对合成1的影响
2 10 mmol,q=20%,r(K3PO4)=1.3,r(4)=1.75,于100 ℃反应8 h,其余反应条件同2.1,考察n(3) ∶n(2)对合成1的影响,结果见图6。从图6可以看出,增大3的用量可显著提高产率。但是当n(3) ∶n(2)=1.2后,产率增加的幅度减少,从成本的角度考虑,不必再增加3的用量。确定n(3) ∶n(2)=1.3。
综上所述,合成1的最佳反应条件为:210 mmol,n(2) ∶n(3) ∶n(K3PO4) ∶n(CuSO4·5H2O) ∶n(4)=1.0 ∶1.3 ∶1.3 ∶0.2 ∶0.35,在DMF(50 mL)中于100 ℃反应8 h,产率54.7%,93.8%ee。
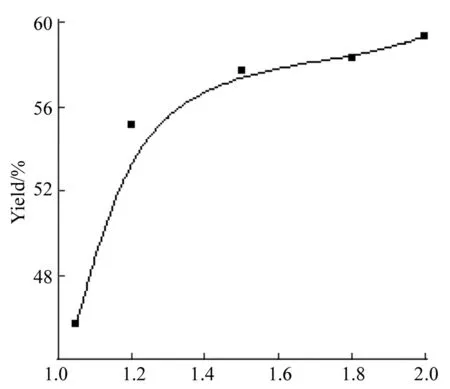
n(3) ∶n(2)图 6 n(3) ∶n(2)对合成1的影响*Figure 6 Effect of n(3) ∶n(2) on synthesizing 1
*r(K3PO4)=1.3,q=20%,r(4)=1.75, 于100 ℃反应8 h,其余反应条件同1.2
在最佳反应条件下合成1具有成本低廉、操作简便、产物光学纯度高等优点
[1] Frlan R, Kikelj D. Recent progress in diaryl ether synthesis[J].Synthesis,2006,(14):2271-2285.
[2] Ma D W, Cai Q. Copper/amino acid catalyzed cross-couplings of aryl and vinyl halides with nucleophiles[J].Acc Chem Res,2008,41:1450-1460.
[3] Beletskaya I P, Cheprakov A V. Copper in cross-coupling reactions:The post-Ullmann chemistry[J].Coordination Chem Rev,2004,248:2337-2364.
[4] Kunz K, Scholz U, Ganzer D. Renaissance of Ullmann and Goldberg reactions-progress in copper catalyzed C-N,C-O,C-S coupling[J].Synlett,2003,(15):2428-2439.
[5] Finet J P, Fedorou A Y, Combes S,etal. Recent advances in Ullman reactions: copper(Ⅱ) diacetate catalyzedN-,O-,S-arylation involving polycoordinate heteroaromatic derivatives[J].Curr Org Chem,2002,6:597-626.
[6] Theil F. Synthesis of diaryl ethers:A long-standing problem has been solved[J].Angew chem Int Ed,1999,38:2345-2347.
[7] Sagar A D, Tale R H, Adude R N. Synthesis of symmetrical diaryl ethers from arylboronic acids mediated by copper(Ⅱ) acetate[J].Tetrahedron Lett,2003,44:7061-7063.
[8] Simon J, Salzbrann S, Prakash G K S,etal. Regioselective conversion of arylboronic acids to phenols and subsequent coupling to symmetrical diaryl ethers[J].J Org Chem,2001,66:633-634.
[9] Choi H, Murray T F, DeLander G E,etal. Synthesis and opioid activity of [D-Pro10]dynorphine A-(1-11) analogues withN-terminal alkyl substitution[J].J Med Chem,1997,40:2723-2739.

