1-[N(2′-脱氧胞基)]-2-[N-(2′-脱氧鸟基)]乙烷的合成及其在DNA股间交联检测中的应用*
白宝清, 赵丽娇, 宋秀庆, 钟儒刚
(北京工业大学 生命科学与生物工程学院,北京 100124)
DNA股间交联是一种重要的DNA损伤形式,能够影响DNA的复制、转录和重组等[1]。许多抗癌烷化剂能够导致肿瘤细胞中DNA互补碱基对发生股间交联,引起肿瘤细胞死亡,从而达到抗癌的目的[2,3]。临床上应用的抗癌药物氯乙基亚硝基脲(CENUs)是一种DNA交联剂[4~7],其抗癌机制与导致DNA形成股间交联物密切相关。研究[8~11]表明CENUs首先分解产生氯乙基正离子,氯乙基正离子和一条DNA链上鸟嘌呤的O6-发生烷基化作用,生成O6-氯乙基鸟嘌呤,然后经过分子内重排再和另一条DNA链上胞嘧啶的N3-发生烷化,生成具有细胞毒性的DNA股间交联产物1-[N-(2′-脱氧胞基)]-2-[N-(2′-脱氧鸟基)]乙烷(dG-dC)。与CENUs结构类似的亚硝胺也能够导致DNA交联。Ishikawa等[12]合成了具有氯烷基侧链的亚硝胺并检测了其对鼠伤寒沙门氏菌TA1535和TA92的细胞毒性,表明氯烷基亚硝胺能够像CENUs一样导致DNA损伤,生成dG-dC交联。本实验室曾对亚硝胺的致癌作用机理进行了研究[13~15],结果表明亚硝胺侧链的α-位和β-位代谢生成双亲电活性中心,能够导致dG的O6-和dC的N3-之间发生横向交联,即形成dG-dC。由于dG-dC在DNA中的含量往往非常低[16],因此建立高灵敏度的检测方法对于评价DNA的损伤程度,阐明股间交联与抗癌(或致癌)作用之间的关系具有重要意义。
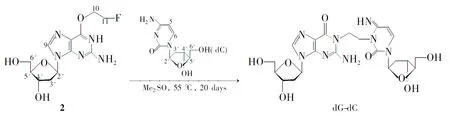
Scheme 1
本文以2′-脱氧鸟苷(dG), 2′-脱氧胞苷(dC), 2-氟乙醇等为原料合成了dG-dC,其结构经1H NMR, IR和MS表征。并以dG-dC为标准品,用HPLC-MS对1,3-双(2-氯乙基)-1-亚硝基脲(BCNU)导致DNA股间交联的损伤产物进行了定性分析。
1 实验部分
1.1 仪器与试剂
WRS-IA型数字熔点仪;BRUKER AC-P400型核磁共振仪(CDCl3为溶剂,TMS为内标); BRUKER VERTEX 70型傅立叶变换红外光谱仪(KBr压片);Thermo-Finnigan SURVEYOR型高效液相色谱和TSQ Quantum三重四极杆质谱联用仪(HPLC-MS); J-KEM 6位恒温平行合成仪;Eppendorf 5355恒温振荡混匀器;Labconco真空冷冻离心浓缩仪;HERMLE公司Z-323K高速冷冻离心机。
硅胶200目~300目,其余所用试剂均为分析纯。
1.2 合成
(1) dG的乙酰化保护
在圆底烧瓶中依次加入dG 650 mg(2.5 mmol),无水吡啶100 mL,醋酸酐2.4 mL(25 mmol), 4-二甲基氨基吡啶(DMAP) 30 mg(0.25 mmol)和三乙胺3.8 mL(28 mmol),放入搅拌子,于50 ℃反应30 h。加冷水20 mL,减压蒸去吡啶和水得棕黑色油状液体;再加去离子水40 mL,浓缩,冷却后析出黄色晶体;用40%甲醇重结晶得浅黄色晶体1(乙酰化保护的dG) 0.8 g,收率78%, m.p.126.5 ℃~128.5 ℃; UVλ: 263, 279 nm;1H NMRδ: 2.12(s, 3H, CH3), 2.13(s, 3H, CH3), 2.32(s, 3H, CH3), 2.49~3.04 (m, 2H, 3′-H), 4.36~4.76(m, 2H, 6′-H), 5.41~5.44(m, 1H, 5′-H), 6.19~6.23(m, 1H, 2′-H), 7.75(s, 1H, 9-H), 9.44(s, 1H, NH), 11.99(s, 1H, 4-NH); IRν: 3 121, 2 920, 1 788, 1 751, 1 715, 1 688, 1 598, 1 551, 1 462, 1 399, 1 223, 1 139, 1 056, 997, 874, 779, 643 cm-1; ESI-MSm/z: 394{[M+H]+}。
(2)O6-(2-氟乙基)-2′-脱氧鸟苷(2)的合成
在圆底烧瓶中加入1540 mg(1.3 mmol)的无水吡啶(100 mL)溶液,减压蒸去吡啶(以除去1晶体中的水)得淡黄色固体。依次加入无水二氧环己烷6 mL,三苯基膦1.260 g(4.8 mmol),偶氮二甲酸二乙酯750μL(4.8 mmol)和2-氟乙醇312μL(5.1 mmol),搅拌下于室温反应2 h。加入5%NaHCO3溶液30 mL,搅拌15 min后用二氯甲烷(3×50 mL)萃取,合并萃取液,蒸除溶剂得黄色油状液体。加甲醇10 mL溶解,加浓氨水60 mL,搅拌下于60 ℃反应3 h。蒸去甲醇和NH4OH得黄色油状液体。用20%甲醇溶解,冷却后过滤,滤液浓缩得黄色油状液体,经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=1∶5~1∶15]纯化得白色固体2 130 mg,产率30%, m.p.241.5 ℃~243.5 ℃; UVλ: 248, 282 nm;1H NMR(DMSO-d6)δ: 2.19~2.24(m, 2H, 3′-H), 3.49~3.59(m, 1H, 4′-H), 3.82(s, 1H, 4′-OH), 4.36~4.37(m, 1H, 5′-H), 4.60~4.70(m, 2H, 6′-H), 4.72~4.85(m, 2H, 10-H), 4.96~5.27(m, 2H, 11-H), 6.20~6.24(t,J=6.0 Hz, 1H, 2′-H), 6.46(s, 2H, NH2), 8.11(s, 1H, 9-H); IRν: 3 321, 2 920, 1 788, 1 751, 1 715, 1 687, 1 598, 1 551, 1 399, 1 379, 1 224, 1 101, 1 055, 1 016, 997, 939, 874, 779, 722, 662 cm-1; ESI-MSm/z: 314{[M+H]+}。
(3) dG-dC的合成
在离心管中依次加入2 5 mg(12.8μmol), dC 10 mg(44μmol),二甲基亚砜100μL,置旋涡混合器上振荡使其充分溶解,移至恒温振荡混匀器上于55 ℃反应20 d。移至圆底烧瓶中,加水10 mL,减压蒸去溶剂得淡黄色油状液体,经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=1 ∶8]纯化得淡黄色固体。
淡黄色固体溶于甲醇后经反相HPLC(表1)纯化,低温冻干得白色固体dG-dC 2.5 mg,产率30%, m.p.218.7 ℃~220.7 ℃; UVλ: 260, 272 nm;1H NMR(DMSO-d6)δ: 2.11~2.45(m, 2H, 3′-H), 3.51~3.58(m, 4H, 10,11-H), 3.75~3.81(m, 4H, OH), 4.05~4.07(m, 2H, 4′-H), 4.20~4.22(m, 4H, 6′-H), 4.33~4.35(m, 2H, 5′-H), 5.85~5.87(d,J=8.4 Hz, 1H, 5-H),6.11~6.16(m, 2H, 2′-H), 7.33~7.35(d,J=8.0 Hz, 1H, -H), 7.80(s, 2H, NH2), 7.92(s, 1H, 9-H), 11.89(s, 1H, NH); IRν: 3 392, 3 242, 1 750, 1 696, 1 652, 1 539, 1 410, 1 243, 1 095, 1 066, 1 018, 954, 781, 761, 654, 594 cm-1; ESI-MSm/z: 521{[M+H]+}。
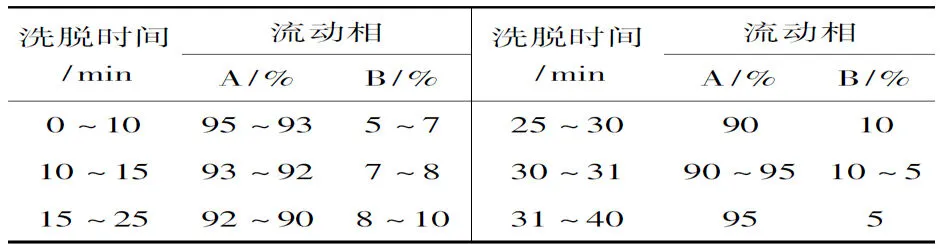
表 1 反相HPLC纯化dG-dC的条件*Table 1 The reversed-phase HPLC conditions purifing dG-dC
*Agilent Zorbax SB C18柱(4.6×250 mm, 5μm),柱温25 ℃,检测波长260 nm;用混合溶剂[A: 10 mmol·L-1NH4Ac水溶液(0.1%AcOH), B: 乙腈]作梯度洗脱,流速1 mL·min-1,进样量20μL
1.3 dG-dC在DNA股间交联检测中的应用
(1) BCNU与小牛胸腺DNA的反应
用10 mmol·L-1Tris-HCl, 50 mmol·L-1NaCl溶液, 50 mmol·L-1NaH2PO4溶液配制磷酸盐缓冲溶液(pH 7.4)。
在反应瓶中依次加入小牛胸腺DNA 10 mg,磷酸盐缓冲溶液10 mL,混匀后加热至37 ℃,加入BCNU 2 mg和无水乙醇(20μL)溶液,置平行合成仪上于37 ℃避光反应5 d(每隔12 h加入等量BCNU溶液)。取0.4 mL反应溶液于1.5 mL离心管中,加入冷无水乙醇0.8 mL,混匀,静置,得到絮状沉淀;以15 000 rpm离心5 min弃去上清液得白色片状沉淀;加入75%乙醇1 mL,振荡漂洗,以15 000 rpm离心2 min,弃去上清液,沉淀于4 ℃挥发乙醇;10 mmol·L-1Tris-HCl缓冲溶液(pH 7.0) 0.4 mL溶解制得含BCNU与小牛胸腺DNA交联产物(BCNU-DNA)的溶液。
(2) BCNU-DNA的酶解
在离心管中加入BCNU-DNA溶液 100μL,于98 ℃热变性5 min,迅速放入冰浴中冷却10 min(使DNA双链变性为单链)。加入脱氧核糖核酸酶Ⅰ(DNaseⅠ) 5 μL(300 U), S1核酸酶5μL(1000 U), S1核酸酶缓冲液(10 mmol·L-1AcONa, 150 mmol·L-1NaCl, 0.05 mmol·L-1ZnSO4, pH 4.6) 20μL,于37 ℃酸性酶解3 h。加入碱性磷酸酶(CIAP) 5μL(150 U),蛇毒磷酸二酯酶10μL(1 U), CIAP缓冲液(500 mmol·L-1Tris-HCl, 10 mmol·L-1MgCl2, pH 9.0) 50μL,于37 ℃碱性酶解3 h。以15 000 rpm离心30 min,上清液即BCNU-DNA酶解液。
(3) BCNU-DNA的HPLC-MS检测
HPLC条件:Thermo ODS C18反相柱(2.1×150 mm, 5μm),柱温25 ℃,检测波长260 nm;用混合溶剂作梯度洗脱(表2),流速0.2 mL·min-1,进样量5μL。MS条件:用正离子模式进行检测;ESI源设置为喷雾电压4 kV,鞘气压力35 psi,辅气压力5 psi,毛细管温度300 ℃,导管入口补偿电压141 V。采用一和二级全扫描(MS Full Scan)方式进行检测。
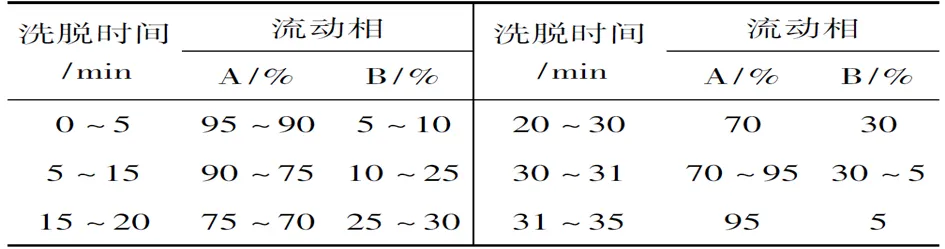
表 2 BCNU-DNA的HPLC-MS检测中的梯度洗脱条件*Table 2 The gradient elution conditions in HPLC-MS detection of BCNU-DNA
*同表1
2 结果与讨论
2.1 dG-dC的合成与纯化
合成均在无水条件下进行,所用试剂需无水或进行无水处理。为了提高底物(dG)的转化率,所用醋酸酐,4-二甲基氨基吡啶,三乙胺,三苯基膦,偶氮二甲酸二乙酯,2-氟乙醇,dC均过量。由于反应时间比较长,反应温度不宜高于50 ℃;产物进行结晶时要除去不溶于水的杂质,以40%甲醇为溶剂进行重结晶。2在加氨水去保护时要在反应装置上接气球,延缓加热反应时挥发的氨气扩散到空气中,以便尽可能的除去乙酰基。柱层析纯化2时,淋洗液的极性逐渐增大,以便加快洗脱速度。合成dG-dC的反应时间长达20 d,为了提高产率,反应温度不能大于55 ℃,否则会生成去一分子的葡萄糖的副产物,从而降低产率。用反相HPLC纯化dG-dC时各组分的保留时间分别为:tdG-dC=15.09 min, tdC=3.58 min, t2=21.29 min, t副=12.18 min。
2.2 dG-dC的表征
1H NMR谱数据表明,1中4-NH位于11.98, 9-H于位于7.75, 氨基被乙酰基保护后,受电负性较大的氧原子影响,氨基上剩余H的化学位移向低场(9.444)。2 中9-H位于8.11, NH2位于6.46。dG-dC中9-H位于7.80, NH2位于7.915。
1在3 121 cm-1处的吸收峰为N-H基团的特征峰,由于受羰基氧原子吸电子的诱导效应的影响,N-H键的伸缩振动发生了红移。在1 788 cm-1, 1 751 cm-1, 1 715 cm-1和1 688 cm-1有四个强的吸收峰, 表征四个羰基(C=O伸缩振动);在1 688 cm-1~1 598 cm-1出现C=N的较强特征吸收峰。2在3 321 cm-1有强的O-H吸收峰,在1 687 cm-1~1 551 cm-1出现C=N 的较强特征吸收峰。dG-dC在3 392 cm-1和3 242 cm-1出现强吸收峰分别对应O-H 和N-H 的伸缩振动,在1 696 cm-1~1 539 cm-1出现C=N 的较强特征吸收峰。
1,2和dG-dC的一级质谱图中均有准分子离子峰[M+H]+,由于在离子化过程中很容易脱去葡萄糖中性碎片(m/z116),因此各化合物的一级谱图中均有m/z[M+H-116]+的碎片离子峰。dG-dC一级全扫描质谱图除了有m/z521[M+H]+准分子离子峰和m/z405[M+H-116]+的碎片离子峰外,还有脱去两分子葡萄糖的碎片离子峰m/z289[M+H-2×116]+。
2.3 dG-dC用于BCNU-DNA酶解液的HPLC-MS定性分析
以dG-dC为标准品,对BCNU-DNA酶解液作HPLC-MS定性分析,均在11.94 min出峰,说明BCNU-DNA酶解液中可能含有dG-dC。但是由于BCNU-DNA酶解液中该峰的强度很小(相对强度仅为1.5%),所以我们通过一级质谱全扫描提取了m/z405和m/z289的离子流图,同时在11.94 min处得到了明显的谱峰(信噪比分别为433和1 621),为了进一步确认BCNU-DNA酶解液中m/z289碎片离子的结构,对其进行了二级全扫描,得到了与标准样品一样的碎片离子峰,包括m/z238,m/z196,m/z178和m/z152,其中m/z178为基峰。结果表明,BCNU和小牛胸腺DNA反应导致鸟嘌呤和胞嘧啶之间形成乙撑方式共价连接的交联物,这与前人[17]提出的有关BCNU导致DNA股间交联的反应机理相吻合。本研究为今后进一步对DNA交联进行定量分析建立了可行的实验方法。
[1] Lai C F, Cao H C, Hearst J E,etal. Quantitative analysis of DNA interstrand cross-links and monoadducts formed in human cells induced by psoralens and UVA irradiation[J].Anal Chem,2008,80:8790-8798.
[2] Kim H Y H, Voehler M, Harris T M,etal. Detection of an interchain carbinolamine cross-link formed in a CpG sequence by the acrolein DNA adduct gamma-OH-1,N2-propano-2′-deoxyguanosine[J].J Am hem Soc,2002,124:9324-9325.
[3] Dai Q H, Lu P, Peng S H,etal. Carcinogenesis switched on by DNA cross-link between complementary bases aroused by aflatoxin andN-nitroso compounds[J].Prog Nat Sci,2003,13:561-567.
[4] Beljanski V, Marzilli L G, Doetsch P W. DNA damage-processing pathways involved in the eukaryotic cellular response to anticancer DNA cross-linking drugs[J].Mol Pharmacol,2004,65:1496-1506.
[5] Mckenna D J, Gallus M, Mckeown S R,etal. Modification of the alkaline Comet assay to allow simultaneous evaluation of mitomycinC-induced DNA cross-link damage and repair of specific DNA sequences in RT4 cells[J].DNA Repair(Amst),2003,2:879-890.
[6] Fisher L A, Bessho M, Bessho T. Processing of a psoralen DNA interstrand cross-link by XPF-ERCC1 complex in vitro[J].J Biol Chem,2008,283:1275-1281.
[7] Shukla P K, Mishra P C, Suhai S. Reactions of DNA bases with theanti-cancer nitrogen mustard mechlorethamine:A quantum chemical study[J].Chem Phys Lett,2007,449:323-328.
[8] Bodell W J, Pongracz K. Chemical synthesis and detection of 1-N3-2-deoxycytidyl],2-[N1-2-deoxyguanosinyl]-ethane in DNA Reacted with 1-(2-chloroethyl)-1-nitrosourea[J].Chem Res Toxicol,1993,6:434-438.
[9] Wilds C J, Xu F, Noronha A M. Synthesis and characterization of DNA containing anN1-2′-deoxyinosine-ethyl-N3-thymidine interstrand cross-link:A structural mimic of the cross-link formed by 1,3-bis-(2-chloroethyl)-1-nitrosourea[J].Chem Res Toxicol,2008,21:686-695.
[10] Bodell W J. DNA alkylation products formed by 1-(2-chloroethyl)-1-nitrosourea as molecular dosimeters of therapeutic response[J].J Neuro-Oncol,2009,91:257-264.
[11] Fischhaber P L, Gall A S, Duncan J A,etal. Direct demonstration in synthetic oligonucleotides thatN,N1-bis(2-chloroethyl)-nitrosourea cross-linksN1of deoxyguanosine toN3of deoxycytidine on opposite strands of duplex DNA[J].Cancer Res,1999,59:4363-4368.
[12] Ishikawa S, Mochizuki M. Mutagenicity and cross-linking activity of chloroalkylnitrosamines,possible new antitumor lead compounds[J].Mutagenesis,2003,18:331-335.
[13] Zhao L J, Zhong R G, She Y B,etal. Ab initio study on the reactivity of non-alpha-metabolites of alkylnitrosamines[J].Acta Phys-Chim Sin,2005,21:883-887.
[14] Zhao L J, Zhong R G, Dai Q H. Theoretical study on anchimeric assistance on the second electrophilic region of carcinogenic beta-methylnitrosopiperazine[J].Chem J Chinese U,2006,27:2386-2389.
[15] Zhao L J, Zhong, R G, Zhen Y. An ONIOM study on the crosslinked base pairs in DNA reacted with chloroethylnitrosoureas[J].J Theor Comput Chem,2007,6:631-639.
[16] Cui Y S, Zhao L J, Liu Y D,etal. Theoretical study on internal rotation of nitrosoureas and toxicological analysis[J].J Theor Comput Chem,2007,6:245-253.
[17] Tong W P, Kirk M C, Ludlum D B. Formation of the cross-link 1-[N3-deoxycytidyl],2-[N1-deoxyguanosinyl]ethane in DNA treated withN,N′-bis(2-chloroehtyl)-N-nitrosourea[J].Cancer Res,1982,42:3102-3105.

