水溶性双甲基化大豆苷元磺酸钴的合成及其晶体结构*
王秋亚, 贺 云, 张尊听
(1. 渭南师范学院 化学化工系,陕西 渭南 714000; 2. 陕西师范大学 化学与材料科学学院,陕西 西安 710062)
大豆苷元(4′,7-二羟基异黄酮)具有抗心律失常[1]、抗缺氧缺血[2,3]、解痉挛[4]、雌性激素[5]、促进骨细胞形成[6]和抑制癌细胞生长[7~9]等广泛的生理活性和较低的毒性,有很好的开发应用价值。但由于其水溶性和脂溶性较差,限制了在临床中的应用。
为了改善其溶解性,解决临床应用中存在的生物利用度低、吸收差、显效慢的缺点,张尊听等[10~12]曾利用磺化反应合成了一些水溶性双甲基化大豆苷元磺酸盐,并对其晶体结构和生理活性进行了研究。研究表明它们具有比母体化合物更好的生理活性。
钴是生命所必需的微量元素之一,是维生素B12的重要组成部分。钴元素对蛋白质、脂肪、糖类代谢、血红蛋白的合成都具有重要的作用,并具有扩张血管、降低血压等生理功能。
本文以大豆苷元为先导化合物合成的水溶性异黄酮衍生物4′,7-二甲氧基异黄酮磺酸钴(1, Scheme 1)将大豆甙元和微量元素钴结合了起来,具有潜在的药理价值。

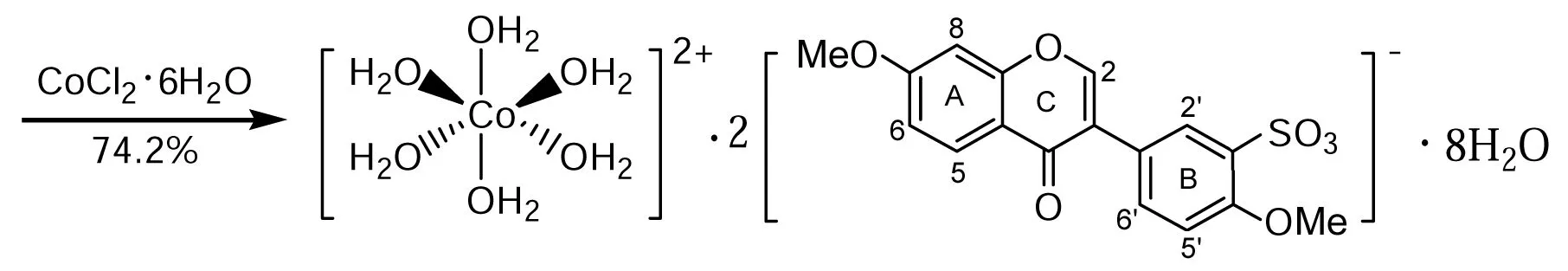
1Scheme 1
1 实验部分
1.1 仪器与试剂
Bruker AM-400型超导核磁共振仪(DMSO-d6为溶剂,TMS为内标);Nicolet 170SX FT-IR型红外光谱仪(KBr压片);PE-2400型元素分析仪;Bruker Smart-1000 CCD型X-射线单晶衍射仪。
大豆苷元,陕西慧科植物开发有限公司;双甲基化大豆苷元-3′-磺酸钠(NaL)按文献[10]方法合成;其它化学试剂均为市售分析纯。
1.2 1的合成
在反应瓶中加入NaL 1 g的水(10 mL)溶液和CoCl2·6H2O的饱和水溶液5 mL,搅拌下加热使其充分溶解,静置,结晶,用水重结晶得粉红色针状单晶1,产率74.2%;1H NMRδ: 8.37(s, 1H, 2-H), 8.05(d,J= 9.0 Hz, 1H, 5-H), 7.60(d,J=2.1 Hz, 1H, 2′-H), 7.32(dd, 1H,J=8.4 Hz, 2.1 Hz, 6′-H), 7.18(d,J=2.4 Hz, 1H, 8-H), 7.08(dd,J=9.0 Hz, 2.4 Hz, 1H, 6-H), 6.75(d,J=8.4 Hz, 1H, 5′-H), 3.91(s, 3H, 7-OCH3), 3.72(s, 3H, 4′-OCH3); IRν: 3 421, 1 636, 1 570, 1 495, 1 445, 1 264, 1 209, 1 090, 1 018 cm-1; Anal. calcd for C34H54O28S2Co: C 39.50, H 5.28; found C 39.42, H 5.20。
1.3 1的晶体结构测定
选取1单晶进行衍射分析,以石墨单色化的Mo Kα射线(0.071 073 nm)为光源,以ω方式扫描,在适当的扫描范围内收集,于298 K收集衍射点,选取I≥2σ(I)可观察点用于结构解析和最小二乘修正,全部强度数据经LP因子校正和经验吸收校正,结构由直接法解出,由可观察点计算最终偏离因子,全部计算均用SHELXS-97程序[13]完成。
2 结果与讨论
2.1 1的波谱表征
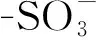

图 1 1的分子结构图Figure 1 Molecular structure of 1
2.2 1的晶体结构
1的晶体学及结构修正数据见表1,部分氢键键长和键角见表2; 分子结构,π┈π堆积作用及其晶胞堆积分别见图1,图2和图3。
由图1可见,1的组成为[Co(H2O)6](C17H13O4SO3)2·8H2O, 即包含一个配位阳离子[Co(H2O)6]2+,两个异黄酮磺酸根阴离子[C17H13O4SO3]-和8个结晶水。其中,Co(Ⅱ)位于晶体结构的对称中心,被6分子水所配位,形成一个变形的八面体配位阳离子,Co-O的平均键长为2.084 0 Å。A环和C环的原子基本共平面,环A(C4~C9)与环C(C1~C4, C9, O1)的二面角为0.9°,为了减少空间阻碍,环B(C10~C15)与环A的夹角为57.2°。 此外,7-OMe与A环基本共面,扭角C16-O3-C7-C8=3.7°; 4′-OMe与B环基本共面,扭角C17-O4-C13-C14=-0.2°。
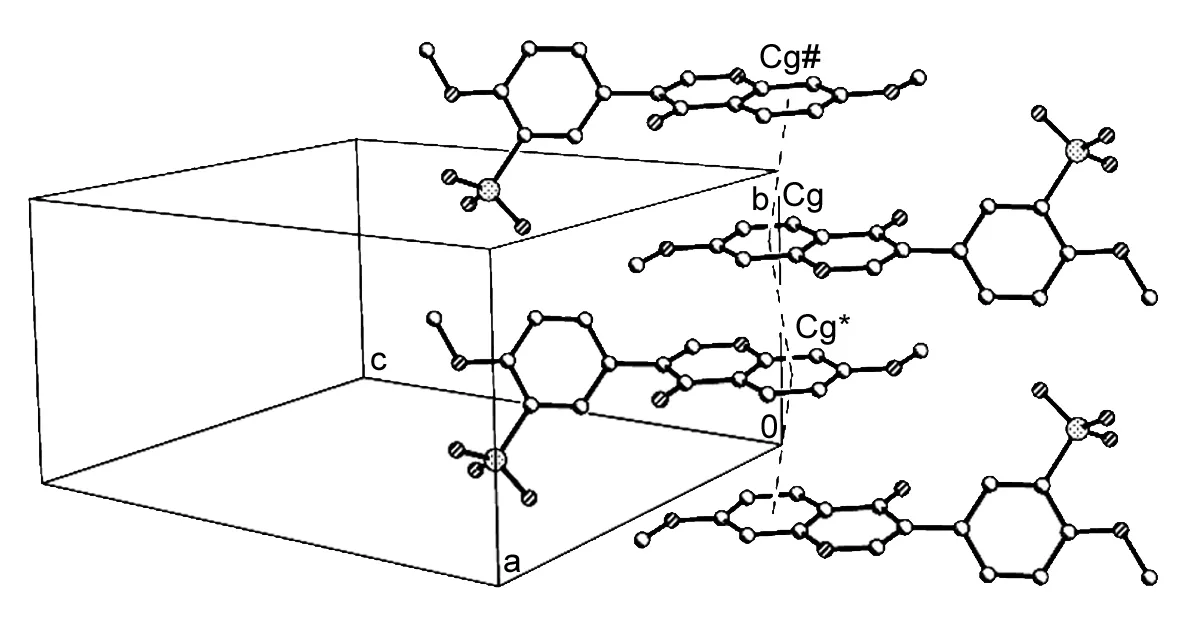
图 2 1中π┈π的堆积作用Figure 2 π┈π stacking interactions in 1# (1-x, 2-y, 2-z), * (1-x, 1-y, 2-z)
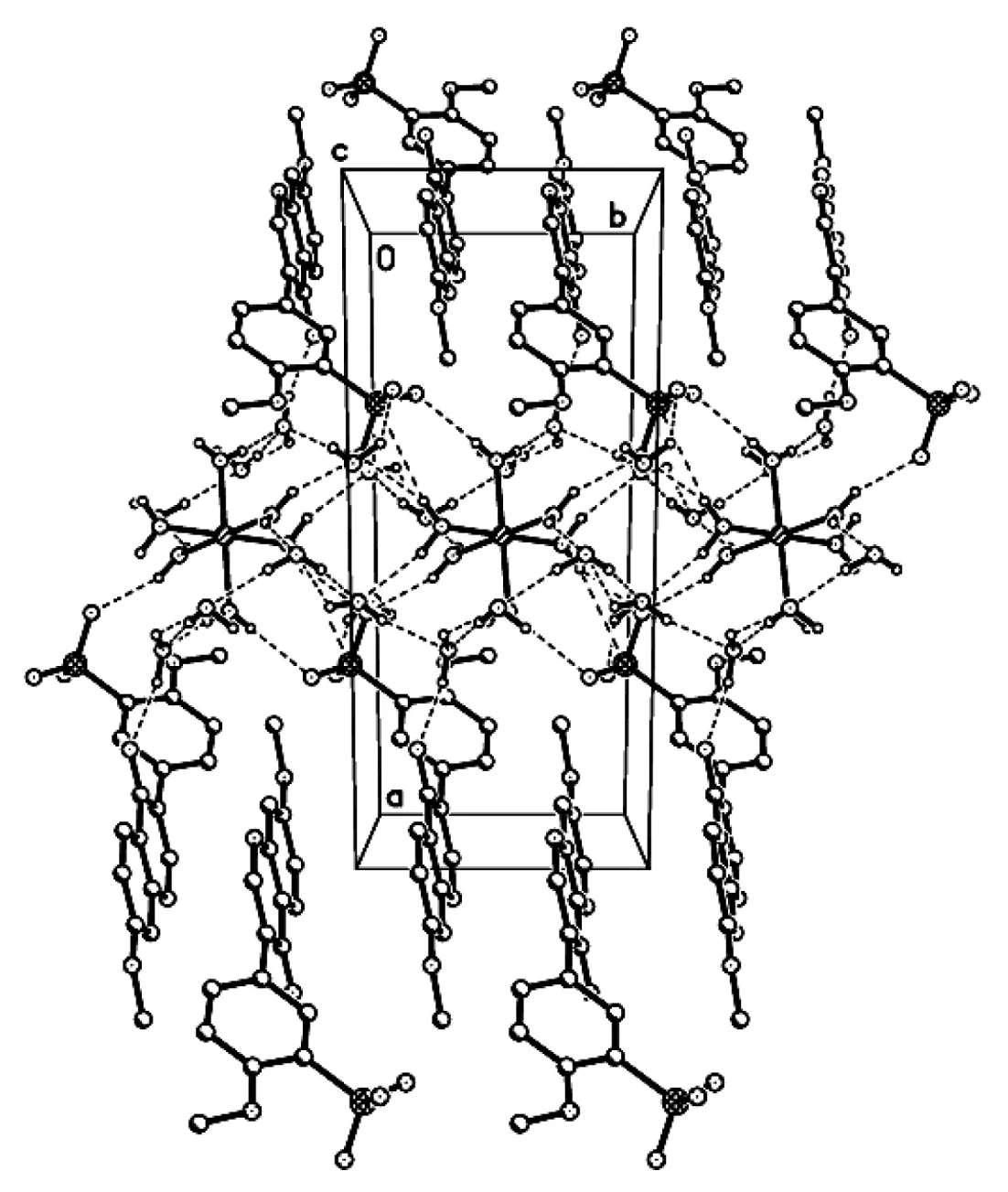
图 3 1的晶胞堆积图Figure 3 Packing diagram of 1

Comp1Empirical formulaC34H54O28S2CoFormula weight1 033.82Crystal size/mm30.49×0.31×0.09Temperature/K298(2)Wavelength/Å0.710 73Crystal systemMonoclinicSpace groupP21/ca/Å18.697(4) b/Å7.358(2) c/Å18.368(4) β/(°)116.233 (1)Volume/Å32 266.6(10) Z2Dc/g·cm-31.515F(000)1 082Scan modeω-2θRange for data collection/(°)2.22^25.02Absorption coefficient/mm-10.565Reflections collected11 381Independent reflections3 988Goodness-of-fit on F21.046R[I>2σ(I)]0.058 8wR20.150 9Largest diff. peak and hole/e·Å-30.587, -0.585
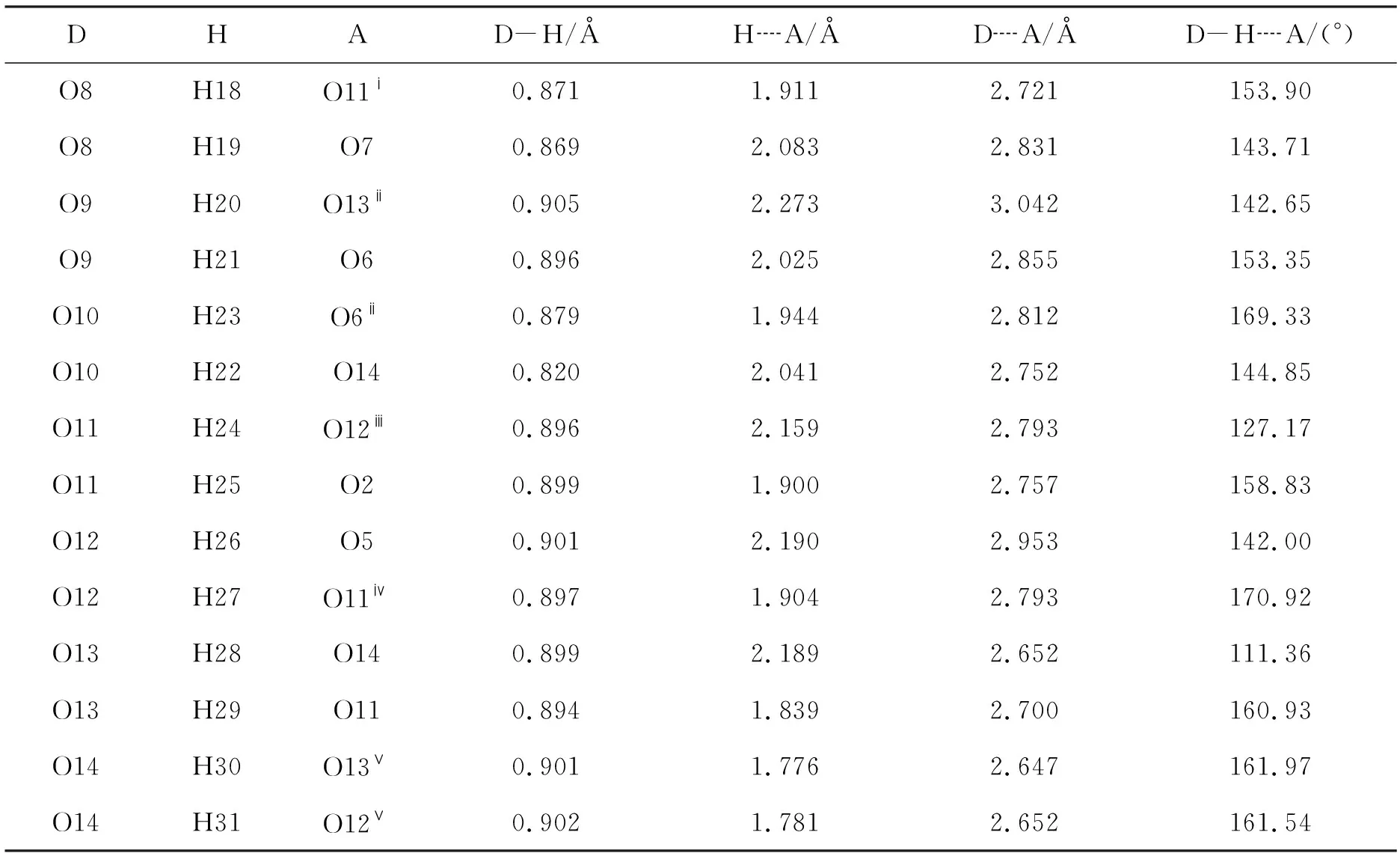
表 2 1的氢键键长和键角Table 2 Hydrogen bond lengths and bond angles of 1
ⅰx, y+1, z;ⅱ-x+1, -y, -z+1;ⅲx, -y-1/2, z-1/2, -z+1;ⅳx, -y-1/2;ⅴx, -y+1/2, z-1/2
在1的晶体结构中,异黄酮骨架上的磺酸根、配位水、结晶水通过7种氢键连接在一起(图1和表2)。首先,磺酸根与配位水之间通过氢键O8-H19┈O7和O9-H21┈O6直接连接在一起。其次, 异黄酮上的羰基氧原子和配位水之间还存在一条氢键链,该条链被结晶水O11, O13和O14所桥联,包含四种氢键,它们分别为O11-H25┈O2, O13-H29┈O11, O13-H28┈O14 和O10-H22┈O14。此外,磺酸根氧原子O5和结晶水O12之间还存在着氢键O12-H26┈O5。上述多个氢键不仅将异黄酮骨架,结晶水和配位水连接在了一起,而且更重要的是对1晶体的组成、稳定和结晶起了非常重要的作用。
此外,在1的晶体结构中,异黄酮骨架层层反向排列,A环(C4-C9)之间存在着π┈π堆积作用,沿b轴方向看去呈现柱状(图2)。从图2可以看出,异黄酮上的A环和其相邻两个异黄酮的A环相互堆积,经计算Cg-Cg#=3.683 Å, Cg-Cg*=3.798 Å, 其中,Cg为(x, y, z)平面上A环的中心,Cg#和Cg*分别为(1-x, 2-y, 2-z) 和(1-x, 1-y, 2-z)平面上A环的中心。其相应的面间垂直距离分别为3.570 9 Å和3.563 3 Å,很显然,以上叠合距离均在π┈π堆积的正常范围之内(3.3 Å~3.8 Å)[14]。
1有着比较特殊的堆积方式(图3)。由于配位水、磺酸根和羰基均为亲水性基团,且它们的距离较近,因而由它们所共同组成的亲水区充满了许多结晶水,在该区域内形成了氢键网络,除了分子结构中所涉及的氢键外,氢键O8-H18┈O11ⅰ和O9-H20┈O13ⅱ存在配位水和结晶水之间;O10-H23┈O6ⅱ存在于磺酸根和配位水之间;而O11-H24┈O12ⅲ, O12-H27┈O11ⅳ, O14-H30┈O13ⅴ和O14-H31┈O12ⅴ均为结晶水间的氢键(表2)。相反由异黄酮骨架所形成的疏水区中没有亲水基团,不存在氢键。在疏水区域,异黄酮骨架呈反方向排列,π┈π堆积作用存在于其中。而磺酸根则是连接亲水区和疏水区的一座桥梁。
3 结论
以大豆苷元为先导化合物, 合成了水溶性异黄酮衍生物4′,7-二甲氧基异黄酮磺酸钴(1)。1的分子组成为[Co(H2O)6](C17H13O4SO3)2·8H2O,其中Co(Ⅱ)位于对称中心并被6分子水所配位。[Co(H2O)6]2+, [C17H13O4SO3]-和H2O之间存在多种氢键,形成晶体结构中的亲水区。异黄酮骨架间反平行排列,存在着π┈π堆积作用,构成晶体结构中的疏水区。而磺酸根则是连接亲水区和疏水区的桥梁。氢键、π┈π堆积作用以及[Co(H2O)6]2+与[C17H13O4SO3]-之间的静电引力,共同将1组装成了具有三维网格结构的超分子。
[1] 范礼理,赵德化,赵敏琦,等. 葛根黄酮抗心律失常作用[J].药学学报,1985,20:647- 651.
[2] Meng Qing-He, Philip Lewis, Kristiina Waähälä. Incorporation of esterified soybean isofla-vones with antioxidant activity into low density lipoprotein[J].Biochim Biophys Acta,1999,1438:369-376.
[3] Tikkanen M J, Wahala K, Ojala S,etal. Effect of soybean phytoestrogen intake on low density lipoprotein oxidation resistance[J].Proc Nad Acad Sci USA,1998,95:3106-3110.
[4] 郭建平,孙其荣,周全. 葛根药理作用研究进展[J].中草药,1995,26:163-165.
[5] Miksicek R J. Commonly occurring plant flavonoids have estrogenic activity[J].Molecular Pharmacology,1993,44:37-43.
[6] Emi S, Masayoshi Y. Stimulatory effect of daidzein in osteoblastic MC3T3-E1 cells[J].Biochem Pharmacol,2000,59:471-475.
[7] 景永奎,韩锐. 大豆甙元对小鼠B16黑色素瘤细胞的分化诱导作用[J].中国药理学与毒理学杂志, 1992,6:278-280.
[8] Sathyamoorthy N, Wang T T Y. Differential effects of dietary phyto-oestrogens daidzein and equol on human breast cancer MCF-7 cells[J].European Journal of Cancer,1997,33:2384-2389.
[9] Jing Y, Nakaya K, Han R. Differentiation of promyelocytic leukemia cells HL-60 induced by daidzein in vitro and in vivo[J].Anticancer Res,1993,13:1049-1056.
[10] 张尊听,王秋亚,贺云,等. 双甲基化大豆苷元磺酸盐的合成、晶体结构及活性研究[J].高等学校化学学报,2005,26:2247-2253.
[11] Wang Q Y, Zhang Z T. Hexaaquanickel(Ⅱ) bis(4′,7-dimethoxyisoflavone-3′-sulfonate)octahydrate[J].Acta Cryst C, 2005,61:m215-m217.
[12] Zhang Z T, Cheng X L. Hydrogen bonding andπ┈πstacking in hexaaquairon(Ⅱ) bis(4′,7-dimethoxyisoflavone-3′-sulfonate)octahydrate[J].Acta Cryst C,2005,61:m529- m531.
[13] Sheldrick G M. SHELX-97,Program Package for Crystal Structure Solution and Refinement[K].University of Gǒttingen:Germany,1997.
[14] Janiak C. A critical account onπ┈πstacking in metal complexes with aromatic nitrogen-containing ligands[J].J Chem Soc Dalton Trans,2000,21:3885-3896.

