N-氰基-N′-取代芳甲基脒基膦酸酯类化合物的合成及其生物活性*
李春晖, 胡方中, 邹小毛, 朱有全, 杨华铮
(南开大学 元素有机化学国家重点实验室,元素有机化学研究所,天津 300071)
自从1991年新烟碱类杀虫剂吡虫啉进人市场后, 吡虫啉已经成为近10年来世界植保界销量最大的杀虫剂品种。目前,新烟碱类杀虫剂已成为发展最快的一类化学杀虫剂,其具有如下特性:温室和田间试验中显示出光稳定性和持效性、极高的杀虫活性、广谱性、优异的内吸作用、植物相容性和环境友好性,尤其是对哺乳动物的毒性低。这些优良的特性,使其从进入市场开始就取得了巨大的成功[1,2]。第二代新烟碱类杀虫剂吡虫啉类似物(Ⅰ, Chart 1)在500 mg·L-1可100%防除桃蚜[3]。磷是生命过程中不可缺少的元素,对生命的维持起重要作用。许多膦酸酯类化合物具有很好的生物活性[4,5]。有机磷类杀虫剂毒性低,与已有杀虫、杀螨剂无交互抗性,且主要用于土壤杀虫。其中噻唑膦具内吸活性,主要用于马铃薯、烟草及蔬菜中防治线虫、线螨;吡唑硫磷兼具触杀及胃毒作用,主要用于棉花、水果及蔬菜中害虫的防治[6]。
12a,2h3a~3i
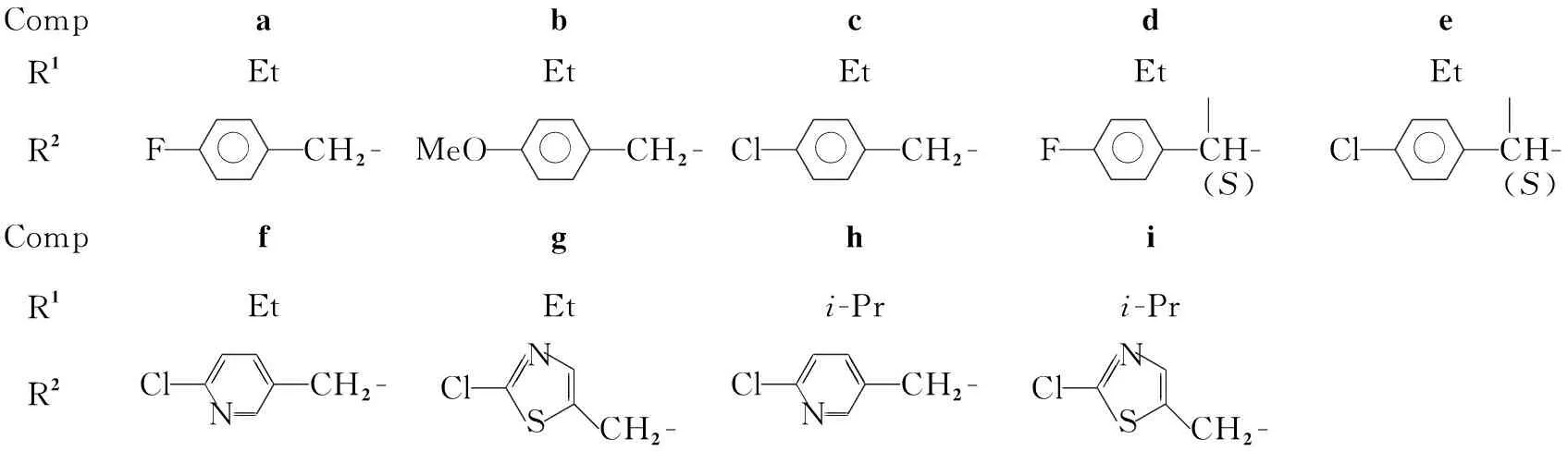
CompabcdeR1EtEtEtEtEtR2FCH2-MeOCH2-ClCH2-FCH-(S)ClCH-(S)CompfghiR1EtEti-Pri-PrR2ClCH2-NClNSCH2-ClCH2-NClNSCH2-
Scheme1
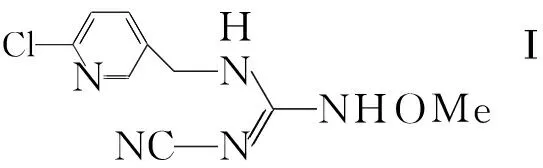
Chart1
本文将膦酰基引入Ⅰ中,期望得到兼具新烟碱类和有机磷类杀虫剂共同优点的新型杀虫剂。N-氰基-S,S-二甲基二硫代碳酸酯(1)通过酰化反应引入膦酰基制得N-氰基-S-甲基亚胺甲基膦酸乙(异丙)酯[2a(2h)]; 2分别与多种取代芳甲胺反应设计合成了9个新的N-氰基-N′-取代芳甲基脒基膦酸酯类化合物(3a~3i, Scheme 1)。
1 实验部分
1.1 仪器与试剂
Yanaco-241型显微熔点仪(温度计未经校正); Bruker AV400型核磁共振仪(CDCl3为溶剂,TMS为内标); Varian QFT-ESI型高分辨质谱仪;Yanaca CHN MT-3型元素分析仪。
亚膦酸二烷基酯,分析纯,用前重蒸;石油醚,30 ℃~60 ℃; THF以二苯甲酮为指示剂用Na回流处理。
1.2 合成
(1)2的合成(以2a为例)[7]
在四口瓶中加入95%NaH 760 mg(30 mmol)的THF(30 mL)溶液,冰浴冷却,搅拌下缓慢滴加亚膦酸二乙酯30 mmol,滴毕,反应3 h;缓慢加入1 1.62 g(10 mmol)的THF(15 mL)溶液,反应约2 h(TLC监测)。抽滤,滤饼溶于水后用稀盐酸调至pH 7,用乙酸乙酯(3×20 mL)萃取,合并萃取液,用无水MgSO4干燥,脱去溶剂得黄色油状液体2a,产率93.6%;1H NMRδ: 1.38(t,J=7.2 Hz, 6H, CH2CH3), 2.50 (s, 3H, SCH3), 4.22~4.36(m, 4H, CH2CH3);31P NMRδ: -3.35。
用类似方法合成黄色油状液体2h,收率96.3%;1H NMRδ: 1.38[d,J=6.4 Hz, 16H, CH(CH3)2], 1.42[d,J=6.4 Hz, 6H, CH(CH3)2], 2.50 (s, 3H, SCH3), 4.84~4.92[m, 2H, CH(CH3)2];31P NMRδ: 12.60。
(2) 3的合成(以3a为例)
在圆底烧瓶中加入2a3 mmol的无水乙醇(10 mL)溶液和对氟苄胺3.1 mmol,搅拌下于0 ℃~5 ℃反应2 h(TLC监测)。用稀盐酸洗涤,二氯甲烷(3×20 mL)萃取,合并萃取液,用无水MgSO4干燥,脱去溶剂,用混合溶剂(石油醚-乙酸乙酯)重结晶得O,O-二乙基-(N-氰基-N′-4-氟苄基)脒基膦酸酯(3a)。
用类似方法合成3b~3i。实验条件见表1,实验结果见表2。

表 1 合成3的实验条件*Table 1 Experamental conditions of synthesizing 3
*重结晶溶剂:石油醚-乙酸乙酯;3d和3e经柱层析(洗脱剂:石油醚-乙酸乙酯)纯化,其余反应条件同1.2(2)
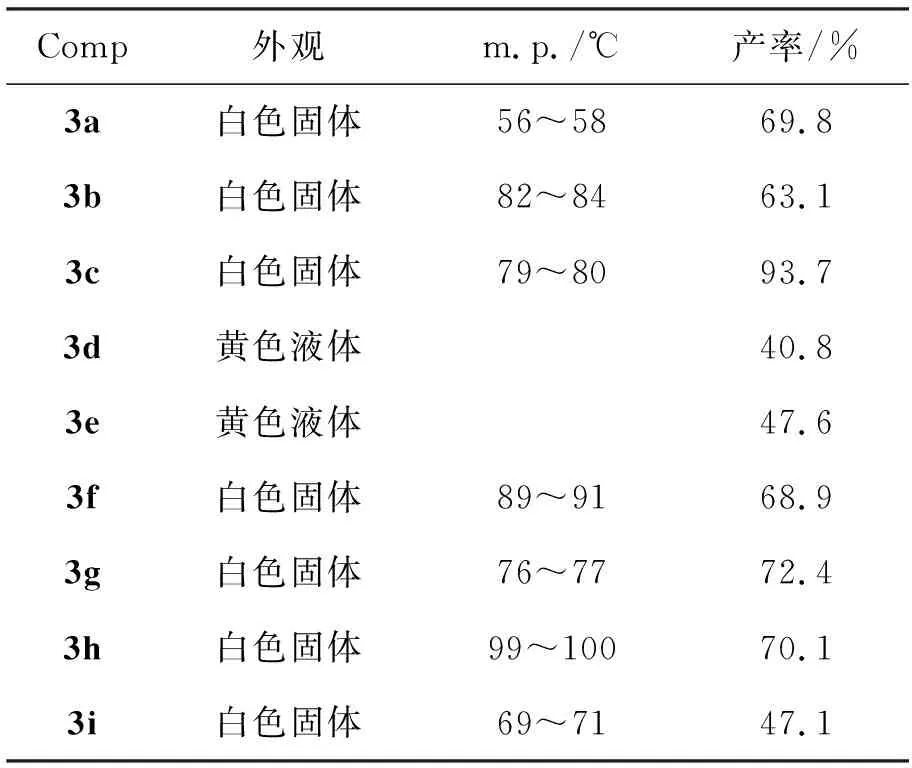
表 2 合成3的实验结果Table 2 Experamental results of synthesizing 3
3a:1H NMRδ: 1.40(t,J=7.2 Hz, 6H, CH2CH3), 4.22~4.34(m, 4H, CH2CH3), 4.52(d,J=5.6 Hz, 2H, ArCH2), 7.01~7.07(m, 2H, ArH), 7.27~7.31(m, 2H, ArH), 7.92(br, 1H, NH);31P NMRδ: -2.10;19F NMRδ: -113.24; HR-MS{ESI/[M+Na]+}: Cacld for C13H17N3O3FP 336.088 4, found 336.088 8。
3b:1H NMRδ: 1.41(t,J=7.2 Hz, 6H, CH2CH3), 3.81( s, 3H, OCH3), 4.22~4.37(m, 4H, CH2CH3), 4.49(d,J=5.6 Hz, 2H, ArCH2), 6.88(d,J=8.4 Hz, 2H, ArH), 7.23(d,J=8.8 Hz, 2H, ArH), 7.57(br, 1H, NH);31P NMRδ: -1.84; HR-MS{ESI/[M+Na]+}: Cacld for C14H20N3O3P 348.108 4, found 348.108 1。
3c:1H NMRδ: 1.34(t,J=7.2 Hz, 6H, CH2CH3), 4.15~4.30(m, 4H, CH2CH3), 4.46(d,J=5.6 Hz, 2H, ArCH2), 7.17(d,J=8.4 Hz, 2H, ArH), 7.26(d,J=8.4 Hz, 2H, ArH), 7.75(br, 1H, NH);31P NMRδ: -2.13; Anal.calcd for C13H17N3O3ClP: C 47.36, H 5.20, N 12.74; found C 47.05, H 5.64, N 12.78。
3d:1H NMRδ: 1.24(t,J=7.2 Hz, 3H, CH2CH3), 1.37(t,J=7.2 Hz, 3H, CH2CH3), 1.51(d,J=6.8 Hz, 3H, CHCH3), 4.03~4.34(m, 4H, CHCH3), 5.05~5.17(m, 1H, CHCH3), 6.92~6.99(m, 2H, ArH), 7.21~7.27(m, 2H, ArH), 7.86(br, 1H, NH);31P NMRδ: -2.25; HR-MS{ESI/[M+Na]+}: Cacld for C14H19N3O3FP 350.104 0, found 350.104 8。
3e:1H NMRδ: 1.25(t,J=7.2 Hz, 3H, CH2CH3), 1.37(t,J=7.2 Hz, 3H, CH2CH3), 1.50(d, J=6.8Hz, 3H, CHCH3), 3.99~4.31(m, 4H, CH2CH3), 5.05~5.16(m, 1H, CHCH3), 7.19(d,J=8.4 Hz, 2H, ArH), 7.24(d,J=8.4 Hz, 2H, ArH), 8.04(br, 1H, NH);31P NMRδ: -2.43; HR-MS{ESI/[M+Na]+}: Cacld for C14H19N3O3ClP 366.074 8, found: 366.075 3。
3f:1H NMRδ: 1.42(t,J=7.2 Hz, 6H, CH2CH3), 4.25~4.37(m, 4H, CH2CH3), 4.57(d,J=5.6 Hz, 2H, ArCH2), 7.35(d,J=8.4 Hz, 1H, ArH), 7.66(dd,J=8.4 Hz, 2.4 Hz, ArH), 7.99(br, 1H, NH), 8.36(d,J=2.4 Hz, 1H, ArH);31P NMRδ: -2.54; HR-MS{ESI/[M+Na]+}: Anal.calcd for C12H16N4O3ClP: C 43.58, H 4.88, N 16.94; found C 43.83, H 5.25, N 16.93。
3g:1H NMRδ: 1.36(t,J=7.2 Hz, 6H, CH2CH3), 4.17~4.33(m, 4H, CH2CH3), 4.60(d,J=5.6 Hz, 2H, ArCH2), 7.41(s, 1H, ArH), 7.76(br, 1H, NH);31P NMRδ: -2.76; HR-MS{ESI/[M+Na]+}: Cacld for C10H14N4O3ClPS) 359.010 5, found: 359.011 2。
3h:1H NMRδ: 1.37[d,J=6.4 Hz, 6H, CH(CH3)], 1.43[d,J=6.4 Hz, 6H, CH(CH3)2], 4.55(d,J=6.0 Hz, 2H, ArCH2), 4.76~4.90[m, 2H, CH(CH3)2], 7.34(d,J=8.4 Hz, 1H, ArH), 7.66(dd,J=8.4 Hz, 2.4 Hz, 1H, ArH), 8.11(d,J=5.6 Hz, 1H, NH), 8.36(d,J=1.6 Hz, 1H, ArH);31P NMRδ: -5.12; Anal calcd for C14H20N4O3ClP: C 46.87, H 5.62, N 15.62; found C 46.72, H 5.42, N 15.65。
3i:1H NMRδ: 1.39[d,J=6.0 Hz, 6H, CH(CH3)2], 1.45]d,J=6.4 Hz, 6H, CH(CH3)2], 4.65(d,J=6.4 Hz, 2H, ArCH2), 4.80~4.89[m, 2H, CH(CH3)2], 7.47(s, 1H, ArH), 8.23(d,J=5.2 Hz, 1H, NH);31P NMRδ: -5.4; HR-MS{ESI/[M+Na]+}: Cacld for C12H18N4O3ClPS 387.041 8, found: 387.041 6。
2 结果与讨论
合成2时,亚膦酸酯的量应保证至少为1的三倍,这样能保证1完全反应且有适中的反应时间。反应过程中产生的白色固体(NaSMe)中包含了大量的2,一定要用稀盐酸先中和到中性后再进行萃取,否则产率降低。
生物活性测试结果显示,施药浓度在10 ppm时,3对黄瓜子叶生根具有一定的促进作用,但活性小于30%。未见其杀蚜虫和杀红蜘蛛的活性。我们推测,可能是由于膦酰基的引入增大了分子的空间位阻,使3不能很好的与新烟碱类杀虫剂的作用靶标相匹配,导致其并没有杀虫活性。这表明在先导化合物A中用膦酰基代替甲氧氨基不利于活性的提高。
[1] 杨吉春,李淼,柴宝山,等. 新烟碱类杀虫剂最新研究进展[J].农药, 2007,46(7):433-437.
[2] Uneme Hideki, Iwanaga Koichi, Higuchi Noriko,etal. Guanidine derivatives,their production and insecticides[P].EP 0 376 279,1990.
[3] Jeschke Peter, Loesel Peter, Nauen Ralf,etal. Substituted oxyguanidines[P]. WO 2 006 056 333,2006.
[4] RongJian Lu, Huazheng Yang. A novel approach to phosphonyl-substituted heterocyclic system(Ⅰ)[J].Tetrahedron Lett,1997,38(29):5201-5204.
[5] 陈凯,胡方中,张锦华,等. 膦酰基杂环化合物的合成方法研究进展[J].有机化学,2000k20(6):866-873.
[6] 刘长令. 杀虫剂及杀螨剂的研究进展[J].农药科学与管理,1998,2:28-31.
[7] Fangzhong Hu, Huazheng Yang.N-cyanoimido-phosphonyl/S-methyl thiocarbonates:Facile,useful reagents for the syntheses of heterocyclic[J].Phosphonates Synth Commun,2001,31(24):3817-3827.

