2,3,4,5-四氢-1,5-甲桥-1H-3-苯并氮杂的合成*
涂 明, 常永娟, 戴立益
(华东师范大学 化学系,上海 200062)
2,3,4,5-四氢-1,5-甲桥-1H-3-苯并氮杂(4)是新型戒烟药伐仑克林的重要中间体。国内尚无相关合成方法的报道。Mazzocchi等[1]的方法总收率仅为1.2%,无工业化应用价值。辉瑞公司[2]的第一条合成路线总收率较高(64%~73%),其缺点是要使用对人体健康和环境有危害的四氧化锇和强致癌的二氯乙烷;其改进路线以1,4-二氢-1,4-甲桥萘(1)为起始原料,经臭氧化,连续多步还原合成4,避免了使用剧毒试剂和溶剂,但路线较长,且总收率只有28%。
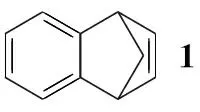
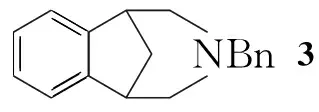
Scheme1
本文以辉瑞公司[2]改进方法为基础,1经臭氧化、还原性胺化和加氢还原三步反应合成了4(Scheme 1),总收率68.8%,其结构经1H NMR和MS确证。
该方法缩短了合成路线,环境友好,收率较高,反应条件较温和,操作简便,适合于工业化放大生产。
1 实验部分
1.1 仪器与试剂
瑞士Bruker AVANCE 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);MAT-212型质谱仪;BHF3-BLO型臭氧发生器。
1(纯度≥ 98.5%)按文献[3,4]方法自制,其余所用试剂均为市售化学纯或分析纯。
1.2 合成
(1)3的合成
在反应瓶中加入130.0 g(211.2 mmol)和二氯甲烷250 mL,搅拌下于-15 ℃均匀通入臭氧,反应约2 h。通入氮气驱赶臭氧和氧气,加入二甲基硫醚(Me2S)19.6 g(316.8 mmol),在室温下继续反应2 h制得2的二氯甲烷溶液。
在反应瓶中加入三乙酰氧基硼氢化钠89.5 g(422.4 mmol),苄胺24.8 g(232.4 mmol)和二氯甲烷600 mL,搅拌下于0 ℃通入氮气驱赶氧气。缓慢滴加新制2的二氯甲烷溶液(约1.5 h),于室温反应2 h。缓慢滴加饱和碳酸钠溶液至pH≈9(反应猝灭),继续搅拌1 h。用二氯甲烷(3×100 mL)萃取,合并萃取液,用饱和食盐水洗涤,无水硫酸镁干燥,旋干溶剂得深红色黏稠液体,经硅胶柱层析[洗脱剂:V(乙酸乙酯) ∶V(石油醚)=1 ∶6]纯化得淡黄色液体337.9 g,收率72.2%(以1计算);1H NMRδ: 7.20(m, 7H), 6.89(m, 2H), 3.49(m, 2H), 3.09(m, 2H), 2.81(d,J=9.5 Hz, 2H), 2.41(d,J=9.5 Hz, 2H), 2.28(m, 1H), 1.66(d,J=10.0 Hz, 1H); MSm/z: 249.3(M+)。
(2)4的合成
在反应瓶中依次加入324.9 g(100 mmol), Pd/C(5%,含水分49.7%) 10 g(2.3 mmol)和乙醇200 mL,以较快流速稳定通入氢气,搅拌下于60 ℃反应3.5 h。抽滤,滤液旋干溶剂得淡黄色液体4(充氮气保护,密封保存) 14.9 g,收率95.4%;1H NMRδ: 7.19(m, 4H), 2.96(m, 4H), 2.67(d,J=12.5 Hz, 2H), 2.41(m, 1H), 1.94(d,J=11.0 Hz, 1H); MSm/z: 159.2(M+)。
2 结果与讨论
合成2时,选择合适的溶剂很重要,参照文献[5,6]方法先后尝试过甲醇、乙醇、氯仿、甲醇-氯仿、甲醇-二氯甲烷等溶剂,但产率和选择性都很低,且副产缩醛和半缩醛。最终选择二氯甲烷作溶剂,2的选择性达到98%,有效地避免了生成副产物。此外,反应温度的控制也很重要。2在常温的空气中很不稳定,易氧化变质。故将反应温度控制在-15 ℃,反应完毕,2的二氯甲烷溶液应直接迅速投入下一步反应,或充氮气保护,低温密封保存。
合成3时,投料顺序对收率产生关键的影响。在通氮气保护下,将2的二氯甲烷溶液缓慢滴加到苄胺和三乙酰氧基硼氢化钠的混合溶液中,2与苄胺生成的中间过渡态能迅速及时地被温和的还原试剂三乙酰氧基硼氢化钠还原[7,8],可有效避免不稳定的中间过渡态被空气氧化导致的产率大幅降低。
合成4时,还原使用的Pd/C催化剂经多次回收套用,催化性能依然较好,有利于放大生产时大量节省成本。4具有游离碱基,在空气中不稳定,可用盐酸酸化成盐,长期存放。
[1] Mazzocchi P H, Stahly B C. Synthesis and pharmacological activity of 2,3,4,5-tetrahydro-1,5-methano-1H-3-benzazepines[J].Journal of Medicinal Chemistry,1979,22:455-457.
[2] Paige R B, Stephan C, Jotham W C. Synthesis of 3,4,5-tetrahydro-1,5-methano-1H-3-benzazepine via oxidative cleavage and reductive amination strategies[J].Synthesis,2004,11:1755-1758.
[3] Muir D J, Stothers J B. An examination ofp-enolization in benzobicyclo[2.2.2], [3.2.1],and [3.2.2] ketones[J].Canadian Journal of Chemistry,1993,71:1290-1294.
[4] Coe J W, Wirtz M C, Bashore C G,etal. Formation of 3-halobenzyne:Solvent effects and cycloaddition adducts[J].Organic Letters,2004,6:1589-1592.
[5] Abad F, Alvarez F. New carbocyclic nucleosides derived from indan[J].Nucleosides,Nucleotides and Nucleic Acids,2001,20(4):1127-1128.
[6] Molander G A, Cooper D J. Ozonolysis of unsaturated organotrifluoroborates[J].Journal of Organic Chemistry,2007,72(9):3558-3560.
[7] Katritzky A R, Fan Wei-Qiang. A novel and versatile synthesis of 1-alkyl-,1-aryl-,1-(alkylamino)-,or 1-amido-substituted and of 1,2,6-trisubstituted piperidines[J].Journal of Organic Chemistry,1990,55(10):3205-3209.
[8] Abdel-Magid A F, Carson K G,etal. Reductive amination of aldehydes and ketones with sodium iacetoxyborohydride[J].Journal of Organic Chemistry,1996,61(11):3849-3862.

