新型1,1′-二取代二茂铁双二氨基硫脲腙席夫碱化合物的合成及其对金属离子的电化学识别*
冯文浩, 乔纯杰, 冉春玲, 杜 薇, 徐 琰, 樊耀亭
(郑州大学 化学系,河南 郑州 450052)
由于二茂铁(FcH)衍生物可逆的单电子氧化还原性,以其为结构单元的氧化还原型受体分子的研究非常活跃[1,2]。二茂铁氨基硫脲因具有可能与茂环共轭的硫脲基团,不仅具有较强的生物活性[3,4]和优良的配位性能[5],还能够作为阴离子受体识别某些阴离子[6],但其对阳离子的识别的研究却很少。
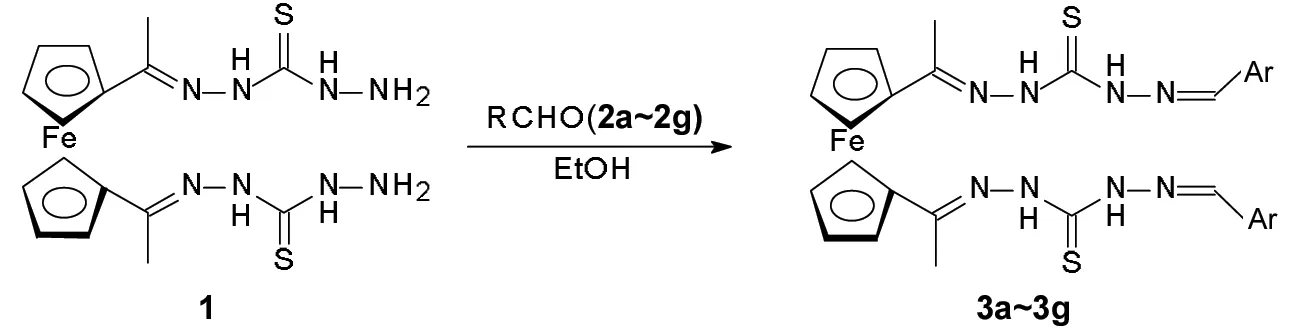
在结构上,该类配体的配位方式灵活多样,与金属配位时,通常存在多样的配位方式,可以用来构筑多维和各种拓扑结构的超分子化合物[7~10]。考虑到有延伸π电子共轭体系的金属有机化合物在光、电、磁性等方面有的独特性能[11~14],本文在硫脲基团的基础上进一步增加配位原子,增强化合物的离域π键,以二茂铁双二氨基硫脲腙(1)和取代醛(2a~2g)为原料,经取代反应合成了7个新型的1,1′-二取代二茂铁双二氨基硫脲腙席夫碱化合物(3a~3g, Scheme 1),其结构经UV,1H NMR, IR和元素分析表征。研究了2对金属离子的电化学识别性能。
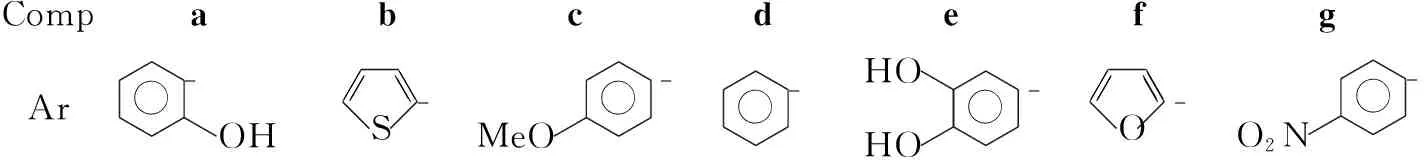
CompabcdefgAr-OHS-MeO--HOHO-O-O2N-
Scheme1
1 实验部分
1.1 仪器与试剂
北京科仪XT4A型显微熔点仪;HP8453型紫外光谱仪(室温,DMF为溶剂);Bruker DPX 400 MHz型核型共振仪(CDCl3为溶剂,TMS为内标);Nicolet NEXUS 470 FT-IR型红外光谱仪(KBr);美国FLASH 1112型元素分析仪;美国CHI公司650A型电化学工作站1参照文献[15]方法合成,其余所用试剂均为分析,使用前未进一步纯化;所用溶剂使用前均经干燥处理。
1.2 3的合成通法
在三颈瓶中加入1 0.45 g(1 mmol),无水乙醇20 mL,蒸馏水60 mL及冰醋酸2 mL,搅拌溶解使其溶解;氮气保护下滴加2(约2 mmol)的无水乙醇(20 mL)溶液,滴毕,回流(70 ℃)反应2 h。减压过滤,滤饼用蒸馏水(3×10 mL)洗涤后再用热无水乙醇(2×10 mL)洗涤,常温干燥得3a~3g。
3a: 橙红色固体,产率86%, m.p.>220 ℃; UVλmax: 307, 335 nm;1H NMRδ: 2.49(s,J=6.09 Hz, 6H, CH3), 4.46(s,J=4.07 Hz, 4H, FcH), 4.94(s,J=3.99 Hz, 4H, FcH), 6.92~7.39(m,J=8.12 Hz, 8H, ArH), 8.76(s,J=2.10 Hz, 2H, CH=N), 10.74(s,J=1.99 Hz, 2H, NH), 11.65(s,J=1.96 Hz, 2H, OH); IRν: 3 441, 3 288, 1 619, 1 520, 1 126, 1 042, 756, 479 cm-1; Anal.cacld for C30H30N8O2S2Fe: C 55.05, H 4.62, N 17.12, S 9.80; found C 54.46, H 4.06, N 16.49, S 9.42。
3b: 橙红色固体,产率72%, m.p.205 ℃~206 ℃; UVλmax: 335 nm;1H NMRδ: 2.49(s,J=6.00 Hz, 6H, CH3), 4.45(s,J=4.03 Hz, 4H, FcH), 4.80(s,J=4.12 Hz, 4H, FcH), 6.92~7.39(m,J=6.06 Hz, 6H, ArH), 8.30(s,J=2.23 Hz, 2H, CH=N), 10.40(s,J=1.84 Hz, 2H, NH); IRν: 3 448, 3 315, 1 592, 1 520, 1 112, 1 041, 853, 481 cm-1; Anal.cacld for C26H26N8S4Fe: C 49.20, H 4.13, N 17.66, S 20.21; found C 50.03, H 4.02, N 17.42, S 18.46。
3c: 橙红色固体,产率83%, m.p.211 ℃~212 ℃; UVλmax: 331 nm;1H NMRδ: 2.49(s,J=6.50 Hz, 6H, CH3), 3.86(s,J=6.00 Hz, 6H, OCH3), 4.32(s,J=4.00 Hz, 4H, FcH), 4.76(s,J=4.09 Hz, 4H, FcH), 6.95~7.66(m,J=8.31 Hz, 8H, ArH), 8.04(s,J=2.20 Hz, 2H, CH=N); IRν: 3 444, 2 961, 1 605, 1 114, 1 072, 1 027, 829, 481 cm-1; Anal.cacld for C32H34N8O2S2Fe: C 56.30, H 5.02, N 16.41, S 9.39; found C 55.36, H 4.80, N 15.65, S 8.72。
3d: 黄色固体,产率80%, m.p.180 ℃~181 ℃; UVλmax: 327 nm;1H NMRδ: 2.49(s,J=6.00 Hz, 6H, CH3), 4.33(s,J=4.13 Hz, 4H, FcH), 4.46(s,J=4.01 Hz, 4H, FcH), 6.56~7.85(m,J=10.20 Hz, 10H, ArH), 8.60(s,J=1.60 Hz, 2H, CH=N), 11.57(s,J=1.88 Hz, 2H, NH); IRν: 3 441, 3 284, 2 997, 1 601, 1 130, 1 067, 876, 505 cm-1; Anal.cacld for C30H30N8S2Fe: C 57.87, H 4.86, N 18.00, S 10.30; found C 58.88, H 4.81, N 17.76, S 10.16。
3e: 橙红色固体,产率76%, m.p.240 ℃; UVλmax: 319 nm;1H NMRδ: 2.49(s,J=6.02 Hz, 6H, CH3), 4.46(s,J=4.01 Hz, 4H, FcH), 4.94(s,J=4.11 Hz, 4H, FcH), 6.92~7.28(m,J=8.05 Hz, 8H, ArH), 8.75(s,J=1.87 Hz, 2H, CH=N), 10.69(s,J=2.08 Hz, 2H, NH); IRν: 3 448, 1 626, 1 521, 1 469, 1 353, 1 306, 1 284, 1 234, 1 129, 1 039, 886, 834, 744, 575 cm-1; Anal.cacld for C30H30N8O4S2Fe: C 52.48, H 4.40, N 16.32, S 9.34; found C 52.04, H 4.73, N 15.59, S 9.10。
3f: 橙红色固体,产率68%, m.p.212 ℃~213 ℃; UVλmax: 304 nm;1H NMRδ: 2.49(s,J=6.18 Hz, 6H, CH3), 4.46(s,J=4.17 Hz, 4H, FcH), 4.94(s,J=4.22 Hz, 4H, FcH), 6.93~7.39(m,J=8.31 Hz, 8H, ArH), 8.69(s,J=1.88 Hz, 2H, CH=N), 10.80(s,J=1.89 Hz, 2H, NH); IRν: 3 448, 3 125, 2 967, 1 621, 1 516, 1 471, 1 373, 1 302, 1 248, 1 135, 1 112, 1 042, 1 017, 938, 897, 851, 794, 590 cm-1; Anal.cacld for C26H26N8O2S2Fe: C 51.83, H 4.35, N 18.60, S 10.64; found C 51.13, H 4.34, N 17.80, S 10.26。
3g: 浅紫色固体,产率90%, m.p.215 ℃~219 ℃; UVλmax: 367 nm;1H NMRδ: 2.49(s,J=6.06 Hz, 6H, CH3), 4.46(s,J=4.14 Hz, 4H, FcH), 4.94(s,J=4.03 Hz, 4H, FcH), 6.96~7.39(m,J=7.82 Hz, 8H, ArH), 8.76(s,J=2.19 Hz, 2H, CH=N), 10.74(s,J=1.79 Hz, 2H, NH);ν: 3 442, 2 923, 1 600, 1 468, 1 357, 1 297, 1 112, 1 035, 897, 815, 675, 585, 472 cm-1; Anal.cacld for C30H28N10O4S2Fe: C 50.57, H 3.96, N 19.66, S 9.00; found C 50.98, H 4.08, N 19.82, S 8.44。
1.3 3的电化学性质测定
以玻碳电极为工作电极,Ag/AgCl电极为参比电极,铂丝为辅助电极,以c(TBAP)=0.1 mol·dm-3的DMF溶液为支持电解质,在c(3)=5×10-4mol·dm-3下,在室温和0.4 V~1.4 V电位下,对其进行循环伏安扫描,测定3的电化学性质。
2 结果与讨论
2.1 3的表征
IR分析表明,3在1 130 cm-1~1 112 cm-1, 1 067 cm-1~1 027 cm-1和514 cm-1~476 cm-1为FcH的νC-H和νFe-Cp振动特征吸收峰;3 448 cm-1和3 284 cm-1为亚氨基的伸缩振动峰;1 619 cm-1和1 592 cm-1为-CH=N的特征伸缩振动峰,与其它化合物的-CH=N的相比,3的振动峰均发生了不同程度的红移[16]。
由3的1H NMR数据可见,甲基质子对应2.49, FcH为4.32~4.94,苯环为6.56~7.85, -CH=N为8.04~8.76,均和各功能团图谱相符。
从3的UV数据可以看到在327 nm~335 nm有一较强的吸收峰,可能是FcH环与-CH=N电子共轭体系产生的吸收峰;在304 nm~307 nm和335 nm 两处的吸收峰,可以归属于苯环和芳香亚胺的π-π*跃迁[17,18]。
2.2 电化学性质
3的电化学实验结果表明,3a~3g均在0.8 V附近出现了一不可逆氧化峰。在第二周扫描时,峰电流明显降低;第五周时不可逆氧化峰趋于消失,说明在高电位的氧化还原反应中,产物在电极表面形成钝化层,阻碍了电极与反应物的接触。
考察了3对Ag+, Zn2+, Ni2+, Cr3+, Cu2+, Ho3+, Eu3+和Er3+(M+)的识别性能(图1和图2),结果表明,只有3a和3b对金属离子有较好的电化学响应。3a只对Ag+的明显响应,对其余M+几乎无响应。此外,当加入等物质量的Cu2+, Ag+, Ni2+, Cd2+, Co2+, Mn2+, Hg2+, Pb2+和Ba2+时,其氧化峰电位(Epa)正移程度和单独加入Ag+时无明显差别。

Potential/V图1 3a, Ag+和3a+Ag+的循环伏曲线*Figure 1 Cyclic voltammetry curves of 3a, Ag+和3a+Ag+*DMF, c=5×10-4 mol·dm-3
从图1可以看出自由Ag+的Epa为518 mV,自由配体相比之下峰值未标出,3a+Ag+的Epa为812 mV, Ag+的Epa正移达294 mV,可见Ag+与3a发生了一定程度的络合,3a可以对Ag+进行电化学识别。

Potential/V图2 3b和3b+Zn+的循环伏曲线*Figure 2 Cyclic voltammetry curves of 3b和3b+Zn2+*乙腈, c=5×10-4 mol·dm-3
在乙腈中,3b对Cu2+, Ni2+, Cd2+, Co2+, Mn2+, Hg2+, Pb2+和Ba2+等几乎无响应,当加入等物质量的Zn2+, Cu2+, Ni2+, Cd2+, Co2+, Mn2+, Hg2+, Pb2+和Ba2+时,其Epa正移程度和单独加入Zn2+时无明显差别。从图2可见,3b的Epa为826 mV,而3b+Zn2+的Epa为961 mV,3b的Epa正移达135 mV,说明Zn2+和3b也发生了一定程度的络合,3b可以对Zn2+进行电化学识别。
3 结论
合成了7个新型的1,1′-二取代二茂铁双二氨基硫脲腙席夫碱化合物。电化学研究结果表明,3a和3b对Ag+和Zn2+有较好的电化学识别能力。
[1] Morad M S, Sarhan A A O. Application of some ferrocene derivatives in the field of corrosion inhibition[J].Corros Sci,2008,50:744-753.
[2] Kwon E J, Lee T G. Surface-modified mesoporous silica with ferrocene derivatives and its ultrasound-triggered functionality[J].Appl Surf Sci,2008,254:4732-4737.
[3] Lichtenberger D L, Fan H J, Gruhn N E. Ligand-mediated metal-metal interactions and localized versus delocalized mixed-valence cation states of biferrocene and bis(μ-fulvalenediyl)diiron characterized in the gas phase by valence photoelectron spectroscopy[J].J Organomet Chem,2003,666:75-85.
[4] Zhang L Y, Yuan Y F, Hu A G,etal. Synthesis and molecular structure of a novel ferrocene-containing macrocyclic acyl thiourea derivative[J].J Organomet Chem,2001,637-639:204-208.
[5] 云益鸣. 含二茂铁基缩氨基硫服及其过渡金属配合物的合成和抑菌活性研究[D].呼和浩特内蒙古大学硕士论文,2007.
[6] 韩洁,黎朝,刘文侠,等.N-(二茂铁酰胺基)硫脲类阴离子受体[J].化学学报,2006,64(16):1716-1722.
[7] Rapheal P F, Manoj E, Kurup M R P,etal. Structural and spectral studies of novel Co(Ⅲ) complexes ofN(4)-substituted thiosemicarbazones derived from pyridine-2-carbaldehyd[J].Polyhedron,2007,26(3):60-616.
[8] Katti K V, Singh P R, Barnes C L. Transition-metal chemistry of main-group hydrazides.Part 2.A new oxime thiosemicarbazide framework as a novel SN multifunctional tripodal ligand for palladium(Ⅱ):Synthetic and X-ray crystal structural investigations[J].J Chem Soc,Dalton Trans,1993:2153-2156.
[9] Ferrari M B, Fava G G, Tarasconi P,etal. Synthesis,spectroscopic and structural characterization,and biological activity of aquachloro(pyridoxal thiosemicarbazone) copper(Ⅱ) chloride[J].J Inorg Biochem,1994,53:13-25.
[10] Argüelles M C R, Sànchez A, Ferrari M B,etal. Transition-metal complexes of isatin-P-thiosemicarbazone.X-ray crystal structure of two nickel complexes[J].J Inorg Biochem,1999,73:7-15.
[11] Elangovan A, Kao K M, Yang S W,etal. Electrochemiluminescence of donor-substituted phenylethynylanthronitrile[J].J Org Chem,2005,70:4460-4469.
[12] Marsden J A, Miller J J, Shirtcliff L D,etal. Structure-property relationships of donor/acceptor-functionalized tetrakis(phenylethynyl)benzenes and bis(dehydrobenzoannuleno)benzenes[J].J Am Chem Soc,2005,127:2464-2476.
[13] Zhang W W, Yu Y G, Lu Z D,etal. Ferrocene-phenothiazine conjugated molecules:Synthesis,structural characterization,electronic properties,and dft-tddft computational study[J].Organometal,2007,26:865-873.
[14] Casas J S, Castano M V, Cifuenies M C,etal. Complexes of dichoro[2-(dimethylamino-methyl)phenyl-C1,N] gold(Ⅲ),[Au(damp-C1,N)Cl2],with formylferroeene thiosemicarbaxones:Synthesis,structure and cytotoxicity[J].J Inorg Biochem,2004,98:1009-1016.
[15] Osborne A G, Silva M W, Hursthouse M B,etal. Synthetic,structural and electrochemical studies on some ferrocenylazines:Crystal structures of (1,4-dimethyl-2,3-diazabuta-1,3-dien) ferrocenophane and [42](1,1′)-bis(1,4-dimethyl-2,3-diazabuta-1,3-dien) ferrocenophane[J].J Organomet Chem,1996,516:167-176.
[16] Chohan Z H, Khan K M, Supuran C T. Synthesis of antibacterial and antifungal cobalt(Ⅱ),copper(Ⅱ),nickel(Ⅱ) and zinc(Ⅱ) complexes with bis-(1,1′-disubstituted ferrocenyl)thiocarbohydrazone and bis-(1,1′-disubstituted ferrocenyl) carbohydrazone[J].Appl Organomet Chem,2004,18:305-310.
[17] Lampard C, Murphy J A, Lewis N. On the mechanism of homolytic acylation of ferrocenes[J].Tetrahedron Lett,1991,32:4993-4994.
[18] 徐新,徐玉明,张海英. 二茂铁甲酸的合成[J].精细石油化工进展,2002,3:39-40.

