原儿茶酸在大鼠血浆中的药代动力学研究
蔡文涛,柳力,陈勇,韩凤梅
(湖北大学 中药生物技术湖北省重点实验室,湖北 武汉 430062)
原儿茶酸(protocatechuic acid,简记为:PA)广泛存在于无梗五加、荭草等常用中草药中[1-2],是一种水溶性酚酸成分,不仅具有显著降低心肌耗氧量,提高心肌耐氧能力,减慢心率等药理作用[3],还有明显抗乙型肝炎病毒(hepatitis B Virus,HBV)的作用.研究表明,原儿茶酸对 HepG 2.215 细胞中HBV-DNA及抗原有较强抑制作用,对HBeAg的抑制作用要强于对HBsAg的抑制作用,且其作用机制不同于目前广泛使用的核苷类似物[4].目前关于原儿茶酸的药动学研究资料很少,仅有1篇文献报道了大鼠单剂量给药后其药动学[5].文中研究低、中、高3个剂量的原儿茶酸对大鼠灌胃给药后的药代动力学.
1 实验材料
1.1仪器Agilent 1100型 HPLC仪,DAD UV-Vis检测器,Agilent Chemstation数据处理系统(Agilent公司),BioTron Ecospin 3180C离心真空浓缩仪(BioTron公司),Sigma 2K15C台式高速离心机(Sigma 公司),PHS-2C精密数显酸度计(上海伟业仪器厂).
1.2药品与试剂原儿茶酸(纯度≥98%,购于施瑞科技武汉有限公司),对羟基苯甲酸(简记为:PHBA,纯度≥98%),乙腈(色谱纯),Millipore超纯水,肝素(150 U·mg-1).
1.3实验动物SPF级 Wistar大鼠:体重(200±20) g,雌雄各半,购于湖北省疾病预防控制实验动物研究中心,合格证号:SCXK(鄂)2003-0005.
2 实验方法
2.1色谱条件色谱柱:Inertsil ODS-3(4.6 mm×250 mm,5 μm);流动相:乙腈-水(V∶V=14∶86,pH=2.1);流速:1.2 mL/min;检测波长:260 nm;进样量:20 μL;柱温:25 ℃.
2.2血浆样品的处理精密量取血浆 200 μL, 加入 40 μL纯水,20 μL 30 mg/L对羟基苯甲酸内标溶液,涡旋振荡 1 min,加 100 μL甲醇,500 μL乙腈,涡旋振荡 1 min后[5],12 000 r/min离心 10 min,取上清液置于离心真空浓缩机中 45 ℃挥干,残渣用 100 μL流动相复溶,12 000 r/min离心 5 min,取上清液 20 μL进样.
2.3动物实验取SPF级 Wistar大鼠 18 只,随机分成 3 组,每组 6 只,雌雄各半,给药前禁食 12 h,不禁水.按10 mL·kg-1量分别灌胃低、中、高剂量(合50、100、150 mg原儿茶酸/kg剂量)药液,分别于给药后10,20,30,45,60,75,90,120,180,300,480 min 眼底静脉丛取血0.5 mL,立即移入经肝素处理的 1.5 mL 离心管中,3 000 r/min 离心10 min,取血浆,于-20 ℃ 保存待测.
3 结果
3.1方法的专属性在上述色谱条件下,测得空白血浆、加原儿茶酸和对羟基苯甲酸内标的空白血浆、大鼠灌胃原儿茶酸后的血浆样品的色谱图(图 1).由图示,血浆中内源性物质与原儿茶酸的可能代谢物不干扰原儿茶酸和对羟基苯甲酸内标的测定.
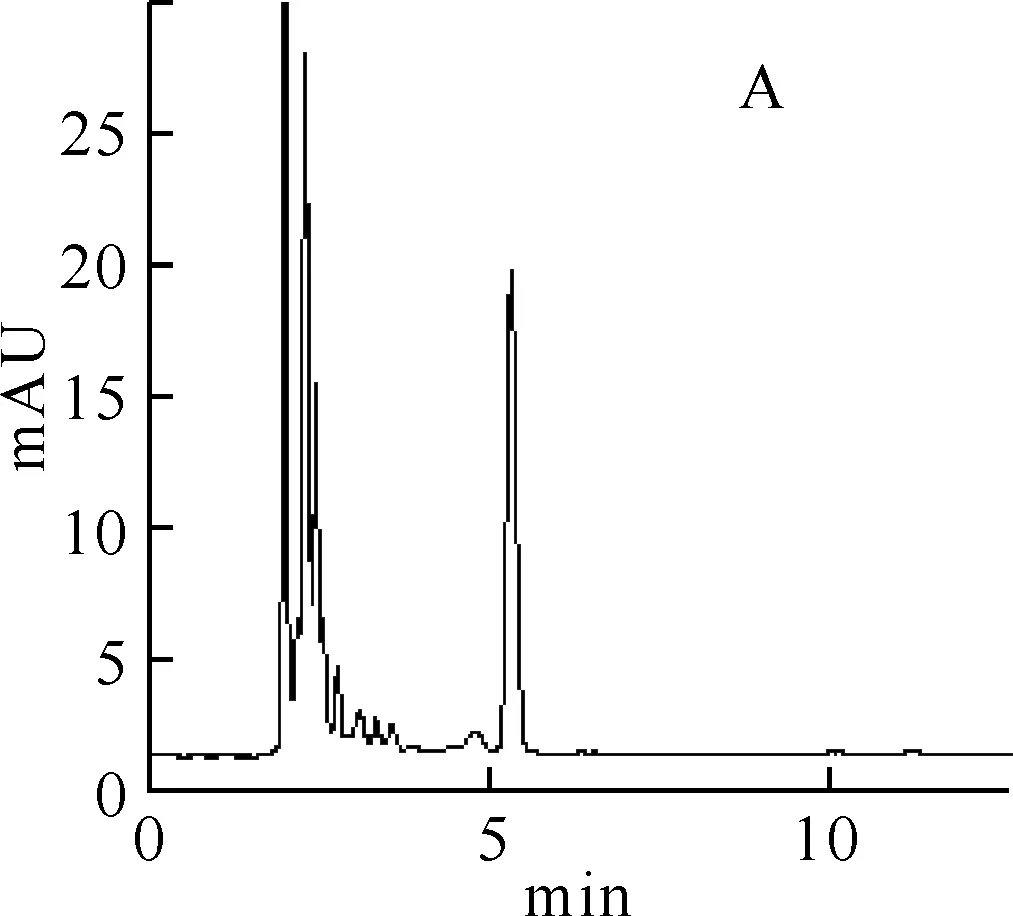
A:空白血浆

B:添加对照品和内标的空白血浆
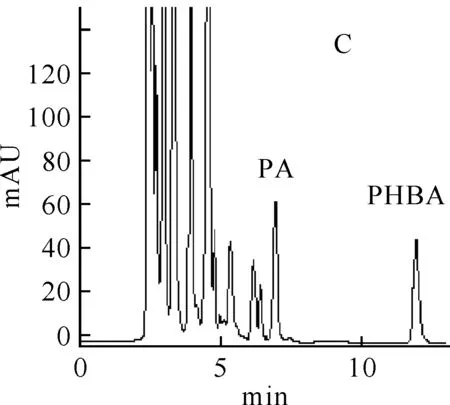
C:大鼠给药后的血浆样品
3.2线性范围取大鼠空白血浆 200 μL,加入40 μL原儿茶酸系列对照品溶液,20 μL 30 mg/L对羟基苯甲酸内标溶液,配制成不同浓度的原儿茶酸标准样品,除不加 40 μL 纯水外,其余按2.2项操作,以原儿茶酸与对羟基苯甲酸的峰面积比值(Y)对原儿茶酸的浓度(X)作图,得线性回归方程为Y=0.179 8X+0.003 4,r=0.998(n=6),线性范围:0.15~80 mg/L,最低定量限为 0.15 mg/L(S/N>10).
3.3精密度和准确度配制含原儿茶酸0.5、3、20 mg/L(低、中、高)3 个浓度血浆样品,连续测定 3 d.以当天的标准曲线计算原儿茶酸的浓度,求得方法的精密度和准确度,结果见表 1.
3.4提取回收率配制含原儿茶酸0.5、3、20 mg/L 3个浓度血浆样品,以测得的目标物的峰面积与相应标准对照品峰面积的比值作为提取回收率,结果见表 2.

表 1 方法的精密度和准确度
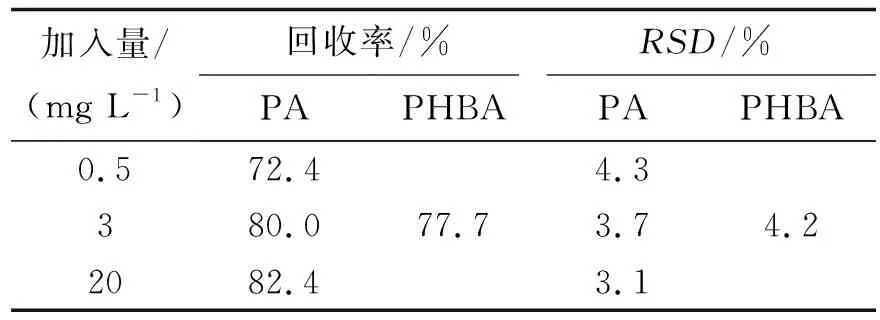
表 2 血浆中PA与PHBA的提取回收率

图2 灌胃 50、100 和150 mg/kg 原儿茶酸后大鼠体内的血药浓度-时间曲线
3.5稳定性配制含原儿茶酸0.5、3、20 mg/L 3 个浓度血浆样品,分别置于室温下保存 1 d和-20 ℃ 冰箱中保存 1 周后处理并测定,考察样品的稳定性.结果样品测定的RE均小于5%,稳定性良好.
3.6原儿茶酸在大鼠血浆中的药代动力学研究大鼠灌胃低、中、高3个剂量原儿茶酸的平均血药浓度-时间曲线见图 2.实验数据采用3P97 药代动力学软件进行分析.根据拟和优度值及 AIC 最小原则,结合测量值与估算值间的相关性、数据的精密度,得相关药动学参数见表3,原儿茶酸在大鼠体内的药动学过程符合二室开放模型,权重为1/C2.
表 3 大鼠单次灌胃 PA 50、100和150 mg/kg后的药动学参数±s)
4 讨论
由图1显示灌胃原儿茶酸后的大鼠血浆样品中有许多杂峰,经DAD光谱扫描发现其紫外吸收图谱与原儿茶酸的极其相似,推测应为其代谢物.我们曾用大鼠肝微粒体对原儿茶酸进行体外温孵代谢时,却没有发现相应代谢物.由于肝微粒体中主要是Ⅰ相代谢酶,故推测PA在大鼠体内的生物转化主要以Ⅱ相代谢为主.
本文中通过低、中、高3个剂量原儿茶酸在大鼠体内的药动学研究发现,当PA灌胃剂量由 50 mg/kg增至 100 mg/kg时,AUC由(361±120)增至(3 492±767) mg·L-1·min、Cmax由(2.19±1.06)增至(30.41±7.27) mg·L-1,即剂量增加了1倍,而AUC增加了8.67倍,Cmax增加了12.89倍,CL从(0.14±0.04)下降至(0.03±0.01) mg·kg-1·min-1/mg·L-1.当PA灌胃剂量由100 mg/kg增至 150 mg/kg时,AUC由(3 492±767)增至(5 218±1 860) mg·L-1·min、Cmax由(30.41±7.27)增至(49.33±28.43) mg·L-1,即剂量增加了0.5倍,而AUC增加了0.49倍(R2=1),Cmax增加了0.62倍(R2=0.996 8),CL基本不变,线性良好.
由以上数据对比知,原儿茶酸在剂量由 50 mg/kg增至 100 mg/kg时药动学过程呈现出非剂量依赖,随着剂量的增加,AUC和Cmax增加得更快,而CL却下降,表明体内药物清除变慢,药物积蓄使AUC和Cmax急剧升高,说明在此剂量范围,药动学过程呈非线性特征.原儿茶酸在剂量由 100 mg/kg增至 150 mg/kg时药动学过程呈现出剂量依赖,说明在此剂量范围,药动学过程呈线性特征.
对于其产生非线性特征的原因,存在酶饱和等诸多因素,需要通过进一步实验进行研究确证.
我们曾研究了原儿茶酸对小鼠的最大给药量,结果表明给予最大容量最大浓度(5 g/kg)的原儿茶酸时,其毒性非常小,同时参考文献[5],文中设置上述低、中、高剂量.虽然原儿茶酸在大鼠体内呈非线性药动学特征,推测其因给药剂量变化而产生的毒副反应的可能性较小.但在进行临床相关试验时,由于物种差异、生理病理状况等复杂因素,还是有必要对其进行血药浓度的实时监测.
参考文献:
[1] 李勇军,何迅,刘丽娜,等.荭草化学成分的研究[J].中国中药杂志,2005,30(6):444-446.
[2] 高晓忠,周长新,张水利,等.毛茛科植物石龙芮的化学成分研究[J].中国中药杂志,2005,30(2):124-126.
[3] 饶曼人,刘广余,高长忠,等.原儿茶酸对缺血区心肌代谢及心肌梗塞范围的影响[J].中国药理学报,1988,9(1):27-30.
[4] 刘厚佳,胡晋红,孙莲娜,等.原儿茶酸等化合物对HBV-DNA转染人肝细胞株的作用[J].第二军医大学学报,2001,22(7):661-663.
[5] 韩瑛,熊志立,杨春娟,等.高效液相色谱法测定大鼠血浆中的原儿茶酸[J].色谱,2007,25(2):207-210.

