作物生长对土壤苯并[a]蒽(BaA)污染的响应
杨兰芳,祁士华,李海波,王向琴,李杰,李军
(1. 湖北大学 资源环境学院,湖北 武汉 430062; 2. 中国地质大学(武汉) 环境学院,湖北 武汉 430074)
多环芳烃(PAHs)是指两个或两个以上的苯环以稠环和非稠环形式相连接的、具有强烈的毒性-致癌、致畸变和致突变性的化合物[1].其来源广泛,在大气、水体和土壤等环境中普遍存在,对环境的危害性极大,因此多环芳烃在环境中的行为正被研究者们广泛关注.多环芳烃水溶性低而疏水性强,会被强烈地分配到非水相中,吸附于颗粒物上,土壤便成为其环境归宿之一[1],据估计在英国有90%以上多环芳烃储存在土壤中[2].被多环芳烃污染的土壤在城市周围、污水排放和灌溉区、工业区、交通要道附近等大量存在,因此多环芳烃污染土壤的修复问题值得重视.生物修复技术是一种价廉便捷的修复技术,其利用前景非常广阔.植物生长能够促进土壤多环芳烃降解,如在1、10、50 mg/kg苯并[a]芘处理浓度下,有黑麦草生长土壤的降解率分别为90.3%、87.5%、78.6%,没有黑麦草生长土壤的降解率则为79.3%、66.4%、55.6%[3].但当前有关植物与土壤多环芳烃关系的研究主要集中在低环和非农作物,高环多环芳烃以及多环芳烃与农作物生长关系的研究较少.高环多环芳烃的毒性比低环更强,因此研究作物生长与高环多环芳烃污染之间的相互关系,更有利于环境安全和人类健康.苯并蒽(BaA)是一种4环多环芳烃,被国际癌症研究中心认为是很可能致癌的物质[4],有关其环境行为和污染修复方面的研究少见报道.本试验通过盆栽大豆和小麦,初步研究了作物生长与土壤BaA污染的相互影响,可以为高环多环芳烃污染对植物生长的影响和污染土壤的生物修复提供科学依据.
1 材料与方法
1.1材料盆栽试验土壤为长江冲积母质发育的冲积土,采自湖北大学校园内,其基本理化性质如表1.

表1 供试土壤的基本理化性质
所用多环芳烃苯并[a]蒽(BaA)购自国药集团上海化学试剂公司,为Fluke公司生产.
所用作物有大豆(GlycinemaxMerr)和小麦(TriticumaestivumL),大豆和小麦种子购于武汉市大东门种子市场.
1.2盆栽试验所用盆钵为高18 cm、体积为3.2 L圆台形陶瓷钵.采用0、1、10、50 mg/kg 4种BaA处理水平,设置裸土、小麦、大豆3种处理方式,每处理重复3次,每盆装土2.0 kg.将BaA配成0、0.2、2、10 mg/mL的丙酮溶液,播种前按处理每盆加入相应浓度的BaA溶液10 mL,待丙酮挥发后,再加入相应的底肥一起拌均匀后装盆播种.土壤含水量维持在持水量的70%左右.每kg土施入150 mg N、75 mg P、150 mg K作为小麦的底肥,而大豆和裸土则每kg土施用N、P、K分别为75、75、150 mg.N、P、K分别用硫酸铵、磷酸二氢钾和硫酸钾为肥源.2006年3月13日播种,管理至种子成熟7月2日收获,生长时间为110 d.
1.3样品制备
1.3.1 土壤样品制备 盆栽试验结束后,将植物根系剔除后,将土壤混合均匀后按四分法取约200 g土壤装入纸袋带回实验室,平铺在干净的塑料盘在阴凉处吹干,用有机玻璃摩擦绸布产生静电吸附植物残体,并磨细过1 mm筛,装入自封袋或塑料瓶中密封,低温保存备用.
1.3.2 植物样品制备 大豆和小麦按根系、茎杆、籽粒分开.茎杆和根系带回室内洗干净后,用剪刀剪成小于1 cm的小段,装入纸袋中在60 ℃烘箱中烘干,干燥器中冷却后称重,籽粒直接装入纸袋中在60 ℃烘干,于干燥器中冷却后称重.
1.4分析方法
1.4.1 土壤基本理化性质分析用常规法[5]即土壤有机质用硫酸-重铬酸钾外加热容量法,碱解氮用碱解扩散法,速效磷用钼蓝比色法,速效钾用火焰光度法,土壤pH用精密pH计电位法,土壤阳离子交换量(CEC)用醋酸铵法,土壤质地用吸管法.
1.4.2 土壤多环芳烃的测定用GC-MS法[6]称取过1 mm筛的土壤10 g,用滤纸包好,放入索氏提取器中加入二氯甲烷100 mL在 40 ℃水浴中提取24 h,然后转移到旋转蒸发器中浓缩,加入正己烷后过硅胶柱,再用2∶3的二氯甲烷与正己烷的混合液洗脱,洗脱液在转移至旋转蒸发器中浓缩,用氮气吹至0.2 mL后保存与冰柜中,然后上机,经过气相色谱仪分离,质谱检测器定量.
1.5数据处理试验数据用SPPS10.0软件中的One-Way ANOVA进行方差分析和多种比较,显著水平为0.05.
2 结果
2.1土壤BaA污染对作物生长的影响表2表明,土壤BaA污染对作物生物量积累的影响因作物而异.对于大豆,不同BaA水平下的总生物量和籽粒重量与对照(不加BaA)的差异均不显著,但加BaA 1.0 mg/kg的籽粒显著高于加BaA 50 mg/kg的处理,其余各处理之间的籽粒产量无显著差异;加BaA 10.0 mg/kg总生物量显著高于加BaA 50.0 mg/kg,其余各处理的总生物量之间无显著差异.对于小麦,加BaA 50.0 mg/kg的籽粒产量和总生物量均显著低于对照和其余处理,其籽粒和总生物量分别比对照低36.6%和23.2%,而其余处理与对照之间无显著差异.
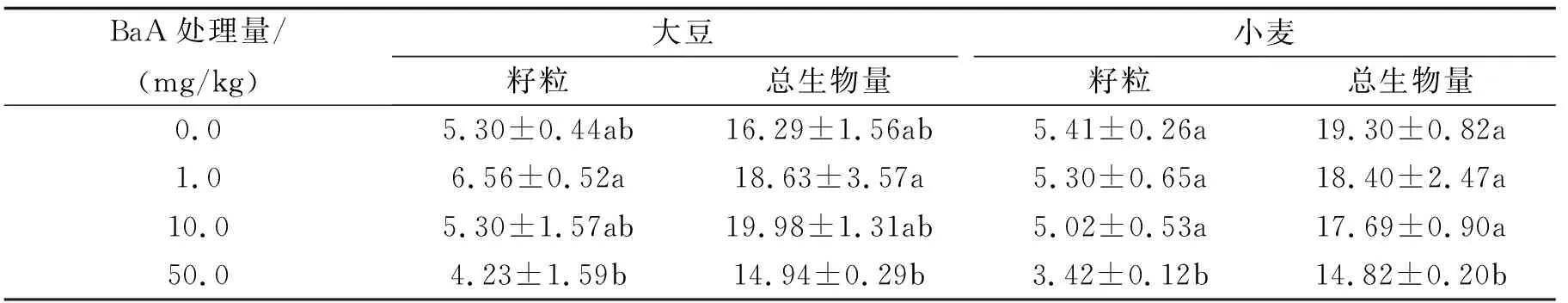
表2 不同土壤BaA处理下大豆和小麦的生物量 g
同一栏中不同字母表示显著水平达到0.05,下同.
2.2作物生长对BaA去除的影响表3可见,作物收获后,裸土、种小麦土和种大豆土的BaA残留浓度均随土壤BaA加入量的增加而增加,土壤BaA残留浓度与土壤BaA加入量之间的线性相关系数在裸土、小麦土和大豆土分别为0.988 4、0.988 5、0.988 2,均超过0.05的显著水平(0.950),即土壤BaA含量与BaA的加入量呈显著的线性相关.在不加BaA的处理下,裸土、小麦土和大豆土三者之间的土壤BaA含量无显著差异,但在不同土壤BaA加入量下,作物收获后土壤BaA含量呈裸土>小麦土>大豆土的规律,在土壤加入BaA 1.0 mg/kg处理下,裸土与小麦土无显著差异,而大豆土则显著低于小麦土和裸土,在土壤加入BaA10.0和50.0 mg/kg处理下,裸土、小麦土和大豆土之间的差异均极显著.同裸土相比,在加入BaA1.0、10.0、50.0 mg/kg下,小麦土的BaA残留量比裸土分别低14.2%、19.4%、20.8%,大豆土的BaA残留量则比裸土分别低32.6%、36.4%、34.2%.

表3 作物收获后土壤BaA的含量 μg/kg

图1 作物生长对土壤BaA去除率的影响
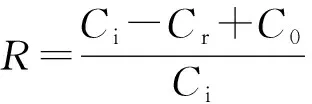
3 讨论
3.1土壤多环芳烃污染对作物生长的影响小麦在50 mg/kg的处理下其籽粒产量和总生物量均显著低于对照和其余处理,表明在此浓度下小麦的生长受到了显著的抑制.本试验结果与周立祥等[7]研究菲、芘、蒽对赤潮微藻,邢维芹等[8]研究奈和菲对冬小麦,郑威等[9]研究柴油处理对栾树幼苗、Smith等[10]研究多环芳烃、煤焦油、受多环芳烃严重污染的炼焦厂土壤对草类,洪有为等[11]研究菲和萤蒽对秋茄的影响结果一致.本试验中大豆生长受BaA的影响不显著,证明在相同的条件下,大豆抗BaA污染的能力比小麦强,也说明多环芳烃对植物生长的影响随作物种类和多环芳烃含量的不同而异.
3.2植物生长对土壤多环芳烃去除的影响植物可以通过挥发、固定、转化、积累、泵取和根际作用等去除土壤污染物[12],用燕麦、羽扇豆、油菜、莳萝、胡椒、萝卜、金钱松、红松、白松等9种植物进行培养试验的结果表明,种植物土壤芘的去除率显著高于不种植物的土壤,证明所有植物都促进了土壤芘的去除[13].本试验结果表明小麦和大豆生长显著促进了土壤BaA的去除,即作物生长有助于去除土壤BaA污染.植物对土壤污染物降解的促进作用主要归因于植物根际的作用,根际同非根际相比,有很多差别,如根际养分有效性高、根际微生物活性高、根际pH和Eh不同于非根际、根际有根系分泌物存在等[14],这些导致根际的理化和生物学性质不同于非根际.有关植物生长对土壤多环芳烃去除影响方面的研究很多,如种植苜蓿、酥油草、苏丹草和柳枝稷可使土壤中蒽和芘的去除率比无植物土壤高30%~44%[15],同时用14C标记芘试验发现芘的最高矿化率出现在用植物根系和微生物分泌有机酸灌溉的处理,而消毒土壤的矿化率最小[16],这说明土壤多环芳烃的降解是微生物过程,植物的促进作用是由于根系分泌物增强了土壤微生物活力.植物根系土柱试验表明,玉米根系分泌物能显著增加14C标记芘的降解,其增加程度相当于种植玉米的盆栽试验,消毒土壤中芘降解几乎为零[17],这说明玉米根际分泌物是通过增加土壤微生物活性来促进芘的降解.土壤掺入1 g/kg的多环芳烃直接种植和存化6个月后种植黑麦草的试验表明,无论是存化还是没有存化处理,根际多环芳烃的含量显著低于非根际,根际微生物的数量也是根际高于非根际[18].
植物生长对土壤多环芳烃降解实质上是植物和微生物的联合作用,其基本原理有:一是植物根区的菌根真菌与植物共生,有独特酶途径,用以降解不能被细菌单独转化的有机物,二是植物根区分泌物刺激了细菌的转化作用,三是植物还可以为微生物提供生存场所并可转移氧化,使根区好氧化作用能够正常进行[2].利用酥油草、苜蓿、苏丹草和三叶草研究他们对石油污染土壤中多环芳烃的降解,发现在种植植物下,14C标记的蒽和芘的降解率都有显著提高,其原因一方面是根际作用增加了微生物降解菌的数量,另一方面是植物分泌物为微生物共代谢提供了共代谢底物[19].黑麦草的试验发现, 离根系越近,异养菌和多环芳烃降解菌数量越高,在距离根0~3、3~6、6~9 mm的土层中多环芳烃的降解率依次为86%、48%和36%,而没有植物土壤中各层的降解率无差异[20],有酥油草生长下的土壤苯并[a]蒽残留浓度显著低于无植物的,其微生物活性显著高于无植物的土壤[21].在1、10、100 mg/kg 3种浓度处理下,紫花苜蓿在接种菌根菌下对苯并[a]芘分别为86.2%、86.6%、57.0%,不接种菌根菌时为75.9%、77.7%、53.4%,而没有植物下的降解率分别为54.9%、52.6%、34.1%[22].说明根际高的降解率是由于根际微生物活性高所致.一般认为微生物对多环芳烃代谢有两方面,一是以多环芳烃为唯一碳源和能源,二是与其他有机物共代谢,低环多环芳烃以第一种方式为主,而高环多环芳烃的代谢以共代谢为主[23].桑橙、杂交柳和心形木的根提取物和桑树根的分泌物在24 h内增加了15%~20%苯并[a]芘的降解,这与加入琥珀酸培养效果相当[24],表明植物根际能够提供降解多环芳烃的共代谢底物.
本试验中小麦和大豆对苯并[a]蒽的去除率为87%~98%,高浓度下的去除率低于低浓度下的去除率.有关研究表明,多环芳烃在土壤中的降解率变化较大.如在5、50、500 mg/kg菲处理下,黑麦草在60 d内对菲的降解率可达93%~95%[25];用苜蓿、柳枝稷、蓝径草培养6个月后,可使总多环芳烃减少57%[26];在1、10、50 mg/kg苯并[a]芘处理浓度下,有黑麦草生长土壤的降解率分别为90.3%、87.5%、78.6%,没有黑麦草生长土壤的降解率则为79.3%、66.4%、55.6%[4],种植紫花苜蓿可使13种多环芳烃的总量减少86%[28].这说明多环芳烃在土壤中的降解率与多环芳烃类型、植物种类以及环境条件等有关,同这些结果相比,本试验的结果也是在合理的范围内.
3.3植物类型对降解多环芳烃的影响本试验中,相同条件下,种植大豆后的土壤BaA残留浓度比种植小麦后土壤BaA的残留浓度低约17%~21%,说明大豆同小麦相比更能促进土壤BaA的降解,也表明植物类型不同,对土壤多环芳烃降解的影响是不同的.Spriggset等[28]研究表明,对苊、蒽、荧蒽、萘和菲的降解率呈黑柳>杂交白杨>岑树的规律.芦苇和苜蓿都促进了土壤中沥青和多环芳烃的降解,多环芳烃的降解率在苜蓿土、芦苇土和无植物土中分别为74.5%、68.7%和44.5%[29].大豆对BaA的去除率高于小麦,其原因一方面可能是大豆根系分泌物不同于小麦,因而对微生物的影响也不同.大豆作为固氮植物,其根系分泌物中的含氮物质比非豆类植物小麦丰富,丰富的氮素有益于土壤微生物活动.在50 mg/kg BaA处理下,大豆生长同对照相比没有受到影响,而小麦在此处理下的籽粒产量和总生物量均显著低于对照,表明小麦生长已经受到了严重影响,植物生长受到影响,必然会降低植物根系的活性,也会影响到土壤BaA的降解.这也证明不同植物抗多环芳烃污染的能力不同.本试验结果证明大豆抗多环芳烃污染的能力比小麦强.另一方面有可能是根瘤菌的影响.将黑麦草和白三叶草混种,接种根瘤菌的处理中多环芳烃的降解率和多环芳烃降解菌的数量高于没有接种根瘤菌的处理[30],证明根瘤菌可以促进土壤多环芳烃的降解.因此种植豆类植物有利于增强土壤去除多环芳烃的能力.
4 结论
(1)本试验的BaA处理水平对大豆生长无显著影响,而50 mg/kg的处理显著降低了小麦的籽粒产量和总生物量,说明土壤BaA污染对植物生长的影响受植物类型和污染水平影响,大豆抗BaA污染的能力比小麦强.
(2)作物收获后,土壤BaA残留浓度呈现为裸土>小麦土>大豆土,土壤BaA的去除率呈大豆土>小麦土>裸土,说明作物生长显著减少土壤BaA的残留,促进了土壤BaA的去除,大豆对土壤BaA的去除能力大于小麦.
(3)无论种植物土壤还是裸土,多环芳烃的残留量均与加入量呈显著的线性相关,而且高浓度下的去除率显著低于低浓度下的去除率.
参考文献:
[1] 刘世亮,骆永明,曹志洪,等.多环芳烃污染土壤的微生物与植物联合修复研究进展[J].土壤,2002,(5):257-365.
[2] Cousins I T,Jones K C.Air-soil exchange of semi-volatile organic compounds(SOCs) in the UK[J].Environ Pollut,1998,102:105-118.
[3] 刘世亮,骆永明,丁克强,等.黑麦草对苯并[a]芘污染土壤的根际修复及酶学机理研究[J].农业环境科学学报,2007,26(2):526-532.
[4] Zhang X X,Cheng S P,Zhou C J,et al.Microbial PAH-degradation in soil:degradation pathways and contributing factors [J].Pedosphere,2006,16(5):555-565.
[5] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000:12-195.
[6] 郭丽,惠亚梅,郑明辉,等.气相色谱-质谱联用测定土壤及底泥样品中的多环芳烃和硝基多环芳烃[J].环境化学,2007,26(2):192-196.
[7] 周立明,孟祥红,肖慧,等.3种多环芳烃和 UV-B辐射对3种赤潮微藻生长的作用[J].武汉大学学报:理学版,2006,52(6):773-777.
[8] 邢维芹,骆永明,吴龙华,等.多环芳烃对冬小麦早期生长的影响研究[J].土壤学报,2008,45(6):1170-1173.
[9] 郑威,闫文德,田大伦,等.PAHs对栾树幼苗生长及其土壤微生物数量的影响[J].中南林业科技大学学报,2008,28(2):19-24.
[10] Smith M J,Flowers T H,Duncan H J,et al.Effects of polycyclic aromatic hydrocarbons on germination and subsequent growth of grasses and legumes in freshly contaminated soil and soil with aged PAHs residues[J].Environ Pollut,2006,141:519-525.
[11] 洪有为,袁东星.秋茄幼苗对菲和荧蒽污染的生理生态效应[J].生态学报,2009,29(1):445-455.
[12] 陈来国,冉勇.植物修复多环芳烃研究现状[J].环境科学与技术,2004,27(5):99-101.
[13] Liste H-H,Alexander M.Plant-promoted pyrene degradation in soil [J].Chemosphere,2000,40:7-10.
[14] 陆景陵主编.植物营养学[M].2版.北京:中国农业大学出版社,2003:148-160.
[15] Reilley K A,Banks M K,Schwab A P.Dissipation of polycyclic aromatic hydrocarbons in the rhizoshpere[J].J Environ Qual,1996,25:212-219.
[16] Child R,Miller C D,Liang Y,et al.Pyrene mineralization by mycobacterium sp.Strain KMS in a barley rhizosphere[J].J Environ Qual,2007,36:1260-1265.
[17] Yoshitomi K J,Shann J R.Corn(ZeamaysL.) root exudates and thie impact on 14C-pyrene mineralization[J].Soil Biol & Biochem,2001,33:1769-1776.
[18] Binet P,Portal J M,Leyval C.Diddipation of 3-6-ring polycyclic hydrocarbons in the rhizoshpere of ryegrass[J].Soil Biol & Biochem,2000,32:2011-2017.
[19] Corhé S C,Joner E J,Leyval C.Rhizospheric degradation of phenanthrene is a function of proximity to roots[J].Plant and Soil,2003,257:143-150.
[20] Nichols T D,Wolf D C,Rogers H B,et al.Rhizosphere microbial populations in contaminated soils[J].Water, Air and Soil Pollution,1997,95:165-176.
[21] Banks M K,Lee E,Schwab A P.Evaluation of dissipation mechanisms for benzo[a]pyrene in the rhizosphere of tall fescue[J].J Environ Qual,1999,28:294-298.
[22] 刘世亮,骆永明,丁克强,等.苯并[a]芘污染土壤的丛枝菌根真菌强化植物修复作用研究[J].土壤学报,2004,41(3):336-342.
[23] 高学晟,姜霞,区自清.多环芳烃在土壤中的行为[J].应用生态学报,2002,13(4):501-504.
[24] Rentz J A, Alvarez P J J, Schnoor J L.Benzo[a]pyrene co-metabolism in the presence of plant root exacts and exudates:Implications for phytoremediation[J].Environ Pollut,2005,136:477-484.
[25] 丁克强,骆永明,刘世亮,等.黑麦草对菲污染土壤修复的初步研究[J].土壤,2002(4):233-236.
[26] Pradhan S P,Conrad J R,Paterek J R,et al.Potential of phytoremediation for treatment of PAHs in soil at MGP site [J].J Soil Contam,1998,7:467-780.
[27] Joner E J,Hirmann D,Szolar O H J,et al.Priming effects on PAH degradation and ecotoxicity during a phytoremediation experiment [J].Environ Pollut,2004,128:429-435.
[28] Spriggs T,Banks M K,Schwab P.Phytoremediation of polycyclic aromatic hydrocarbons in manufactured gas plant-impacted soil [J].J Environ Qual,2005,34:1755-1762.
[29] Muratova A Y,Turkovshaya O V,Hübner T,et al.Studies of the efficacy of alfalfa and reed in the phytoremediation of hydrocarbon-polluted soil [J].Appl Biochem and Microbiol,2003,39:599-605.
[30] Johnsaon D L,Anderson D R,McGrath S P.Soil microbial response during the phytoremediation of a PAH contaminated soil [J].Soil Biol & Biochem,2005,37(12):2334-2336.

