次甲基蓝与DNA作用的共振光散射光谱研究及机理分析
盛立娇,彭毛,周建刚,宋功武
(湖北大学 有机功能分子合成与应用教育部重点实验室,湖北 武汉 430062)
脱氧核糖核酸(DNA)是重要的生物大分子,也是遗传信息的载体和基因表达的物质基础. 核酸的定量测定可为生物体体液中其他组分的测定及遗传疾病的诊断提供重要信息,因而成为人们关注和研究的重要课题.DNA内源荧光很弱,因而直接利用其天然荧光进行研究受到限制,共振光散射法逐渐成为研究热点[1-5].
在早期的荧光分析中,散射光常作为一种干扰源而被消除.1993年,Pasternack等使用普通的荧光分光光度计建立了共振光散射(Resonance Light Scattering,RLS)技术,研究卟啉分子在DNA分子表面的组装和聚集[1].黄承志等人在此基础上做了大量的研究工作并将其作为高灵敏方法应用于核酸的测定[2-4].RLS法测定核酸主要利用具有大共轭体系的“生色团”(染料或金属螯合物)在核酸分子上的聚集作用或长距组装而产生强烈的共振散射,作为生色团的主要是有机小分子碱性染料,卟啉类试剂(如TAPP及其质子化产物[2])及金属螯合阳离子(如CO(Ⅱ)-5-Cl-PADAB螯合物[3])等.目前,利用增强有机染料共振光散射测定核酸的报道有藏红T[4],罗丹明B[5],耐尔蓝硫酸盐[6],亮绿[7]和中性红[8]等.

图1 次甲基蓝的分子结构
亚甲基蓝(即次甲基蓝,一种深蓝色的水溶性染料,分子结构见图1)已在近中性介质中(pH 5.5~7.5)被作为共振光散射探针测定脱氧核糖核酸[9],但在早期研究中只是作为一种新方法提出.笔者在文献[9]的基础上研究了次甲基蓝(MB)在偏酸性介质中(pH 3.51~4.49)与DNA作用的共振光散射光谱,对实验条件进行了详细优化,并应用红外光谱、紫外-可见吸收光谱等初步探讨了MB与DNA作用的机理.
1 实验部分
1.1仪器与试剂RF-540荧光分光光度计(日本岛津); UV-2300紫外-可见分光光度计(美国PE公司); 傅立叶红外光谱仪(美国PE公司);pHB-4 pH计(上海雷磁仪器厂); WH-2微型旋涡混流仪(上海沪西分析仪器厂).
Tris(三羟甲基氨基甲烷)- HCl 缓冲溶液,浓度为 0.1 mol·L-1; 脱氧核糖核酸溶液:将一定量的小牛胸腺DNA(ctDNA,华美生物工程公司)于0~4 ℃下缓慢溶于二次蒸馏水中,并于低温保存,操作液浓度为90 mg·L-1.次甲基蓝(MB)储备液浓度为5.04×10-3mol ·L-1,操作液浓度为5.04×10-4mol·L-1.用1 mol·L-1的NaCl水溶液控制离子强度.所用试剂均为分析纯,实验用水均为二次蒸馏水.
1.2实验方法在25 mL 比色管中依次加入0.3 mL MB溶液,适量DNA溶液,1.0 mL Tris-HCl 缓冲溶液,用二次蒸馏水稀释至10 mL,旋涡混合,放置5 min.将溶液置于λem=λex处进行同步扫描,可得共振光散射光谱.于最大共振光散射峰368 nm处测量核酸加入前后溶液的共振光散射强度差ΔIRLS.
2 结果与讨论
2.1 MB-DNA体系的共振光散射(RLS)光谱图2为MB-DNA体系的共振光散射光谱(RLS光谱).结果表明,碱性染料次甲基蓝本身的RLS信号较微弱,在加入DNA后,其RLS信号大大增强,在368、470、550 nm左右出现了增强的共振光散射峰,但368 nm处的增强信号较明显且峰形较好,本实验选择368 nm为测量波长.
2.2条件优化
2.2.1 介质酸度的选择 向海艳等[9]研究了亚甲基蓝与脱氧核糖核酸在近中性范围内(pH=5.5~7.5)的共振光散射光谱.而本文以Tris-HCl 缓冲溶液调节溶液的pH值,旨在研究偏酸性范围内,次甲基蓝共振光散射法测定DNA含量的各种条件及有机染料与生物大分子的作用机理.Tris-HCl 缓冲溶液的用量在1.0~1.8 mL时RLS强度较大.因此,实验选择用1.0 mL pH=4.49的Tris-HCl 缓冲溶液控制介质的酸度.
2.2.2 离子强度的影响 用1 mol·L-1的NaCl 水溶液控制离子强度,测定MB-DNA体系的共振光散射强度,实验结果如图3所示.由图可知,当NaCl溶液的浓度小于0.01 mol·L-1时,溶液的离子强度对体系几乎无影响;继续增大离子强度则会导致体系RLS强度逐渐减小.因此,在体系中应避免有高浓度的电解质存在,在配置缓冲溶液时,应尽量避免以电解质作为缓冲介质.离子强度的影响从一定程度上说明了MB与DNA之间存在静电相互作用[3].
2.2.3 试剂加入顺序的影响及稳定性实验 实验中试剂的加入顺序对RLS影响不大,但当按照染料MB-DNA-缓冲溶液时,体系的共振光散射强度最大.按顺序加入试剂,放置4~5 min后,反应基本完成,体系在至少35 min内测定,结果稳定.
2.2.4 DNA热变性的影响 实验研究了热变性DNA(将DNA 在沸水浴中加热30 min后迅速放入冰水浴中冷却15 min以防止其复性)和天然DNA 对体系RLS 强度的影响,结果见图4.由图可知,热变性DNA的共振光散射强度增大,这是由于高温和迅速冷却使得双螺旋的DNA 解链为单链,有利于MB分子在DNA表面的堆积.
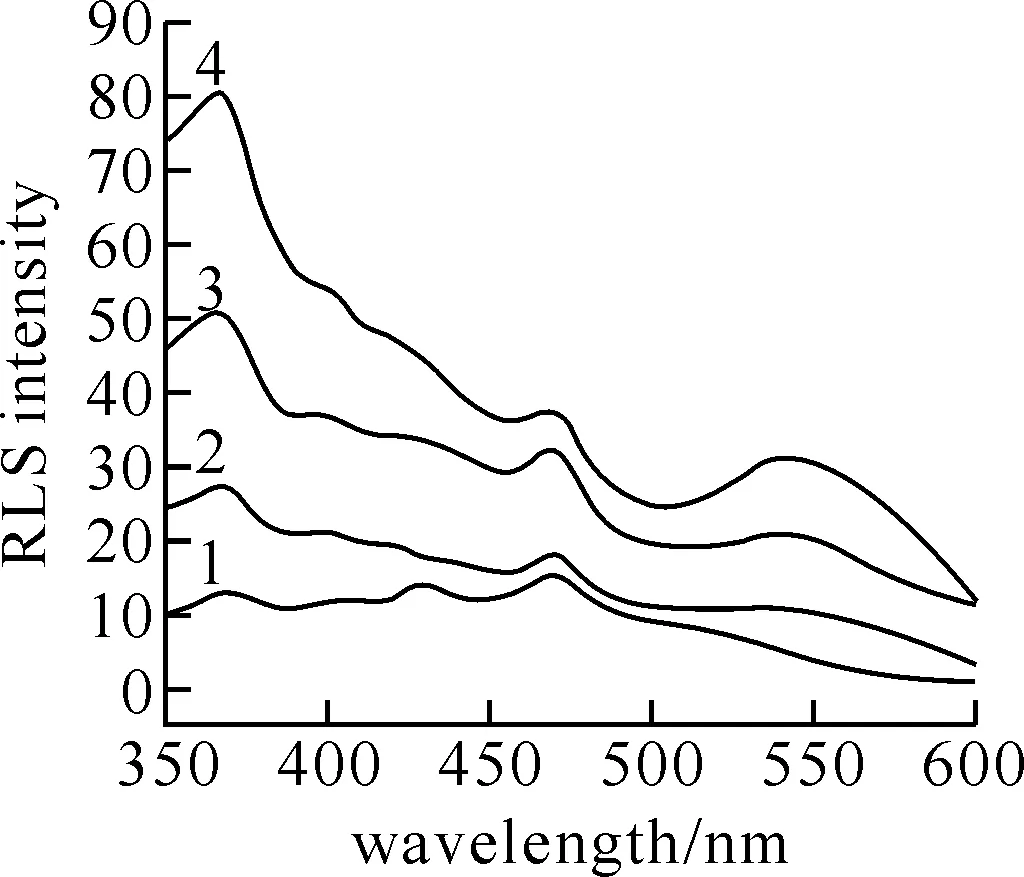
图 2 MB-DNA 体系共振光散射光谱CMB:1.512×10-5 mol·L-1; pH=4.49;CDNA(mg·L-1)(1→4): 0.0,0.9,1.8,2.7.
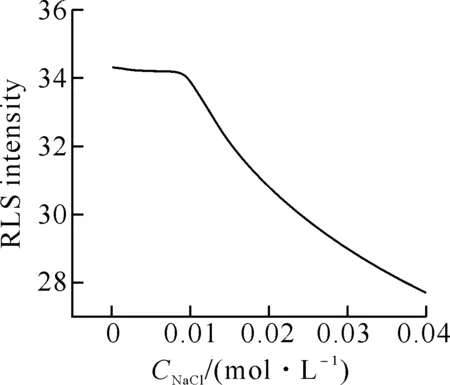
图3 离子强度对MB-DNA体系RLS的影响CMB:1.512×10-5 mol·L-1;pH=4.49;CDNA: 1.8 mg·L-1.

图 4 天然DNA(1)和变性DNA(2)对体系RLS强度的影响CMB: 1.512×10-5 mol·L-1;pH=4.49.
2.2.5 共存物质的干扰 在0.9 mg·L-1DNA 存在下,考虑了多种共存物质对测定的影响,结果见表1.从表1 可以看出,大多数生物体内存在的金属离子(如Ca2+和Ba2+)和氨基酸以及糖类不干扰测定,说明该方法具有实际应用价值.由于Fe3+会与DNA发生络合反应,干扰此实验,故在实验前,应将其除去.BSA对体系干扰很大,这是由于BSA与MB产生相似反应之故.

表1 共存物质对测定DNA的影响
2.2.6 工作曲线 在上述确定的最佳反应条件下,绘制了测定DNA 的工作曲线.当DNA 的质量浓度为0~1 440 ng·mL-1时,体系的共振光强度与DNA 的质量浓度呈较好的线性关系.其工作曲线的线性拟合方程为ΔIRLS=-2.442 + 49.765C(C: mg/L)(pH=4.49),相关系数为r=0.995 3.该方法检测限(3σ)为14.1 ng·mL-1.
2.2.7 合成样品的测定 根据表1 中共存离子组分干扰允许量配置了3个合成样品.表2列出了合成样品的测定结果,证明此法重复性好,结果令人满意.

表2 合成样品中DNA的测定
3 机理探讨
有机分子与生物大分子相互作用的机理是研究的热点,已有人使用分子吸收和发射光谱及圆二色谱等方法进行研究[10-11],本文中是在应用RLS法测定DNA含量的实验基础上,综合应用红外光谱、紫外-可见吸收光谱、RLS光谱等光谱技术,并结合离子强度对体系RLS信号的影响来初步探讨MB与DNA作用的机理.

图 5 MB-DNA 体系的红外光谱(1)DNA,(2)MB-DNA.

3.2 RLS光谱除了可以应用RLS法灵敏测定生物大分子的含量外,还能根据共振光散射光谱研究有机分子在核酸分子表面的长距组装.根据文献[6,10-11]解释,带正电荷的有机分子对核酸具有凝聚作用(condensing effect),当有机分子与核酸的摩尔比较高且介质的离子强度很低时,有机分子在核酸分子表面进行长距组装(long range assembly),形成远程堆积结构并将诱导核酸超螺旋结构的形成,当光与核酸的超螺旋结构作用时便产生了光共振现象,导致共振光散射增强.因而,如果有机分子与核酸作用时导致强烈的RLS信号增强,则意味着该有机分子在核酸表面进行堆积,形成了一种核酸超螺旋结构.本实验中,MB与DNA的结合,从图1看出,随着DNA的加入,体系的共振光散射增强,可初步说明MB分子在DNA分子表面长距组装,形成大的聚集体.
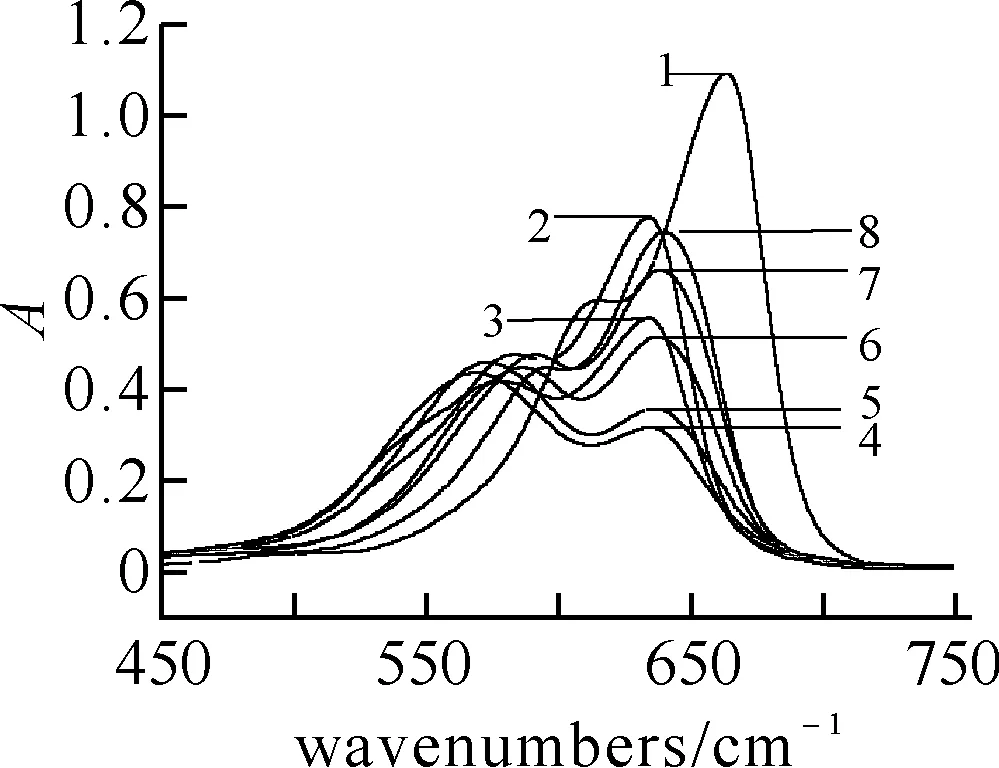
图 6 MB-DNA体系吸收光谱CMB: 1.512×10-5 mol·L-1; pH=4.49;CDNA(mg·L-1)(1-8):0.0,2.7,4.5,13.5,22.5,45.0,63.0,88.2.
3.3紫外-可见吸收光谱次甲基蓝(MB),吖啶橙(AO),耐尔蓝A(NB),中性红(NR),罗丹明6G(R6G)等离子型染料在水溶液中都存在单体(M)-二聚体(D)平衡(the monomer-dimer equilibrium,M+M=D)[12].次甲基蓝,别名品蓝,属于醌亚胺类染料,可用作染料,生物染色剂,氧化还原指示剂等,水溶液中其单体的吸收峰位于668 nm处,而二聚体的吸收带位于612 nm处[13].图6为体系的紫外-可见吸收光谱.图6曲线1中612 nm即MB二聚体的吸收峰,而664 nm处即单体吸收.由图可知,当DNA加入已发生聚集的MB溶液中,体系在664 nm处的吸收下降(曲线1~4),发生减色效应并伴随着波长紫移.根据共振光散射理论,增强的RLS信号与紫外光谱的减色效应,可进一步确定MB在DNA分子表面的堆积和长距组装[4].当DNA的质量浓度继续增大,吸收峰又开始增大,波长红移.其原因有二,可能是随着MB单体与DNA反应,单体-二聚体平衡朝单体方向移动,使二聚体(D)浓度降低[9].此外,当DNA浓度增加到一定值后,MB与DNA的作用可能经历了从表面聚集(H-aggregation)到解聚(dissociation mechanism)的转变[4],不利于MB与DNA的反应.
3.4从离子强度的影响角度探讨作用机理从微观上分析,有机小分子与核酸结合的部位是碱基,磷酸骨架和戊糖环,作用的方式主要分为3种:不可逆的共价结合,剪切结合和可逆的非共价结合[14].其中非共价作用是研究的热点,其基本方式有:静电作用、沟槽作用、嵌插作用和远程组装与外围结合(亦称长距组装)几种方式[14].静电作用主要是阳离子小分子沿着核酸双螺旋结构的双壁与负电荷的磷酸根发生反应,小分子与核酸的这种相互作用可根据离子强度对测定体系的影响进行判断[15].
由图3看出,当NaCl溶液的浓度大于0.01 mol·L-1后,继续增大离子强度则会导致体系RLS强度逐渐减小,这是因为MB的分子结构中环外N原子带正电荷,可与DNA骨架上带负电荷的磷酸基团作用,而Na+也能以静电引力的方式与磷酸基相互作用,从而离子强度的增大削弱了阳离子染料MB与DNA之间的静电引力,不利于次甲基蓝与DNA的结合.据此分析,MB与DNA的结合有一定的静电作用.
综合上述分析可知,MB可能通过静电作用等以DNA分子为模板在其表面形成了聚集和长距组装,这种聚集增强了体系的RLS响应[3],并成为定量测定核酸的基础.
参考文献:
[1] Pasternack R F,Bustamante C,Collings P.Porphyrin assemblieson DNA as studied by a resonance light - scattering technique[J].J Am Chem Soc,1993,115:5393-5399.
[2] Huang C Z,Li K A,Tong S Y.Determination of nanograms of nucleic acids by a resonance light-scattering technique withα,β,γ,δ-tetrakis[ 4-(trimethylammonium)phenyl ]porphine[J].J Anal Chem,1996,68(13):2259-2263.
[3] Huang C Z,Li K A,Tong S Y.Determination of nanograms of nucleic acids by their enhancement effect on the resonance light scattering of the Cobalt(Ⅱ)/4-[(5-Chloro-2- pyridyl)azo]-1,3-diaminobenzene complex[J].J Anal Chem,1997,69(3):514-520.
[4] Huang C Z,Li Y F,Liu X D.Determination of nucleic acids at nanogram levels with safranine T by a resonance light - scattering technique[J].Anal Chim Acta,1998,375(1/2):89-97.
[5] Liu Y,Ma C Q,Li K A,et al.Simple and sensitive assay for nucleic acid by use of Rayleigh light scattering technique with rhodamine B[J].Anal Chim Acta,1999,379(1-2):39-44.
[6] 黄承志,李原芳,李念兵,等.耐尔蓝硫酸盐在核酸分子表面的长距组装及核酸的三波长共振光散射测定[J].分析化学,1999,27(11):1241-1247.
[7] 黄新华,舒为群,李原芳,等.溴代十六烷基三甲基铵敏化亮绿-脱氧核糖核酸作用的共振光散射增强研究[J].分析化学,2001,29(3):271- 275.
[8] Wang Y T,Zhao F L,Li K A,et al.Molecular spectroscopic study of DNA binding with neutral red and application to assay nucleic acids [J].Anal Chim Acta,1999,396:75-81.
[9] 向海艳,陈小明,李松青,等.亚甲基蓝共振光谱散射法测定脱氧核糖核酸[J].分析化学,2000,28(11):1398-1401.
[10] Carvlin M J,Fiel R J.Intercalative and nonintercalative binding of large cationic porphyrin ligands to calf thymus DNA[J].Nucleic Acids Research,1983,11:6121-6139.
[11] Huang C Z,Li K A,Tong S Y.Spectrophotometry of nucleic acids by their effect on the complex of cobalt(Ⅱ) with 4-[(5-chloro-2-pyridyl)azo]-1,3-diaminobenzene[J].Ana Chim Acta,1997,345:235-242.
[12] Antonov L,Gergov G,Petrov V,et al.UV-Vis spectroscopic and chemometric study on the aggregation of ionic dyes in water[J].Talanta,1999,49:99-106.
[13] 曾云鹗,张华山,陈震华.现代化学试剂手册(第四分册)[M].北京:化学工业出版社,1989:421- 422.
[14] 陈小明.核酸在三元体系中的共振光散射光谱性质的研究与应用[D].湘潭:湘潭大学,2005.
[15] 凌连生,杨洗,何治柯,等.Ru(bipy)2(dppz)2+与DNA相互作用的光谱研究[J].分析科学学报,2001,17(1):11-15.

