黄芩素磺化物的合成、抗氧化活性及其与DNA作用的研究
何 清,王彦昌,贺 云,张尊听*,张小清
1陕西师范大学化学与材料科学学院,西安 710062;
2温州大学化学与材料工程学院,温州 325027;3西安医学院,西安 710021
黄芩素磺化物的合成、抗氧化活性及其与DNA作用的研究
何 清1,2,王彦昌1,贺 云1,张尊听1*,张小清3
1陕西师范大学化学与材料科学学院,西安 710062;
2温州大学化学与材料工程学院,温州 325027;3西安医学院,西安 710021
以黄芩素为先导化合物利用磺化反应首次合成水溶性黄酮——黄芩素-8-磺酸钠,采用 I R、1H NMR和元素分析对黄芩素-8-磺酸钠结构进行了表征;同时,对磺化反应条件进行了优化。通过DPPH(1,1-二苯基-2-苦肼基自由基)法对黄芩素-8-磺酸钠清除自由基作用进行了研究;以溴化乙錠(EB)为荧光探针,研究了黄芩素-8-磺酸钠与 CT-DNA的相互作用。实验结果表明:最佳的磺化反应条件为:黄芩素与浓硫酸比例 1∶8(g/mL),100℃时反应 12 h。黄芩素-8-磺酸钠具有强抗氧化活性,与DNA结合作用显著。
黄芩素;黄芩素-8-磺酸钠;抗氧化活性;CT-DNA
黄芩素 (Baicalein,4氢-1-苯并吡喃-4-酮-5,6,7-三羟基-2-苯)是唇形科植物黄芩的有效成分之一,也存在于紫葳科植物木蝴蝶、车前科植物大车前中,具有抗菌[1]、抗病毒[2]、抗炎[3]、抗变态反应[4]、抗氧化、清除氧自由基[5]、抗癌、抗肿瘤[6]、抗凝、抗血栓形成[7]和保护肝脏、心脑血管、神经元[8]等多种药理作用,目前临床主要用于抗菌消炎和抗感染。由于黄酮化合物水溶性较差,限制了其在临床中的应用。为了改善黄酮化合物的溶解性,解决临床应用中存在的生物利用度低、吸收差、显效慢的缺点,我们曾利用磺化反应合成了大豆苷元-3′-磺酸钠[9]、双甲氧基大豆苷元-3′-磺酸钠[10]、尼泊尔鸢尾苷元-3′-磺酸钠[11]及白杨素-6-磺酸钠[12]等,并对其晶体结构和生理活性进行了研究。本文探索了黄芩素磺化反应的最佳条件,合成出水溶性化合物黄芩素-8-磺酸钠,对其进行了结构表征;同时进行了黄芩素-8-磺酸钠抗氧化活性试验,研究了其与 CTDNA的作用。黄芩素-8-磺酸钠在不改变先导化合物黄芩素结构的基础上引入一个磺酸基,克服了黄芩素水溶性差的缺点,同时保留了黄芩素结构中的活性部位,为黄酮类药物的剂型改造提供新化合物。
1 仪器与试剂
1.1 仪器
Vario EL III元素分析仪;Nicolet 170SX FT-I R红外光谱仪 (KBr压片);Bruker AM-300超导核磁共振仪;UV-1810紫外可见分光光度计;CRT-970荧光分光光度计。
1.2 试剂
黄芩素(成都欧康植化科技有限公司);DPPH (日本东京化成工业株式会社);溴化乙錠 (华美生物工程公司);小牛胸腺DNA(CT-DNA,华美生物工程公司);三羟基甲基氨基甲烷 (Tris,Sigma公司);其它化学试剂均为市售分析纯。
2 实验方法
2.1 黄芩素磺化条件的优化
影响黄芩素磺化反应的主要因素有磺化剂的用量、反应温度、反应时间等。本实验采用单因素法确定反应条件。首先,固定反应温度和时间,1 g黄芩素与不同体积浓硫酸作用,结果见表 1。其次,在反应最佳比率黄芩素∶浓硫酸 =1∶8(g/mL)时,固定反应温度,延长反应时间,结果见表 2。最后,固定比率和反应时间,升高反应温度,结果见表 3。
2.2 黄芩素-8-磺酸钠的合成
称取 1.0 g黄芩素置于 25 mL烧瓶中,加入 8 mL浓 H2SO4在 100℃下搅拌反应 12 h,倒入 25 mL饱和NaCl水溶液中,析出黄色沉淀,静置 4 h,过滤,再用饱和NaCl水溶液洗沉淀至中性,将沉淀物加适量水溶解,向溶液中加入 NaCl固体搅拌溶解至出现混浊,加热溶液使变清亮,静置过夜,析出淡黄色固体。反复溶解盐析,直至 TLC检测已纯,得黄芩素-8-磺酸钠 (图 1),80℃真空干燥,mp.290℃(分解)。:3541.6,3443.1,1672.3,1618.6,1580.4, 1450.1,1366.0,1315.3,1268.8,1213.5,1158.5, 1109.0,1044.4,1029.2,849.2,778.7,767.8,684.6, 654.8,627.3,586.3,535.1 cm-1;1H NMR(DMSO-d6,300MHz)δ:7.04(1H,s,H-3),8.30(2H,d,J= 6.72 Hz,H-2′,H-6′),7.58(2H,d,J=6.72 Hz,H-3′,H-5′),7.57(1H,s,H-4′)。按 C15H9NaO8S的计算值(%):C 48.39,H 2.44;实验值 (%):C 48.16, H 2.19。

图 1 黄芩素-8-磺酸钠的合成路线Fig.1 Route of synthesis of sodium baicalein-8-sulfonate
2.3 清除自由基实验
2.3.1 溶液的配制
DPPH(1,1-二苯基-2-苦肼基自由基)溶液:以无水乙醇为溶剂配制浓度为 2.0×10-4mol/L的DPPH溶液。
黄芩素-8-磺酸钠储备溶液:以无水乙醇为溶剂配制浓度为 4.0×10-4mol/L的黄芩素-8-磺酸钠溶液。
2.3.2 抗氧化作用的测定
取稀释后的黄芩素-8-磺酸钠溶液 2 mL及 2.0 ×10-4mol/L DPPH溶液 2 mL加入同一具塞试管中,摇匀。30 min后用无水乙醇做参比测定其吸光度Ai,同时测定 2 mL 2.0×10-4mol/L DPPH溶液与2 mL无水乙醇混合液的吸光度 Ac,以及 2 mL黄芩素-8-磺酸钠与 2 mL无水乙醇混合液的吸光度Aj。
DPPH法中抗氧化能力用抑制率来表示,其公式为:

其中,Ac为未加抗氧化剂时 DPPH溶液的吸光度;Ai为加抗氧化剂后 DPPH溶液的吸光度;Aj为黄芩素-8-磺酸钠在测定波长的吸光度。
分别测定不同浓度黄芩素-8-磺酸钠溶液对DPPH的抑制率,用抑制率对浓度的对数作图得抑制率曲线(图2)。
2.4 与 EB-DNA作用
2.4.1 溶液的配制
Tris-HCl缓冲溶液的配制:以二次去离子水为溶剂配制 50 mmol/L Tris-50 mmol/L NaCl溶液,室温密封保存,使用前用 HCl调至 pH=7.4。
EB溶液:以缓冲溶液为溶剂配制 3.0×10-5mol/L的 EB溶液。
CT-DNA:以缓冲溶液为溶剂配制 CT-DNA溶液,浓度以吸收系数ε(p)260=6600确定[13],为3.20×10-5mol/L,经 UV光谱检测 A260/A280> 1.8[13]。溶液置于冰箱中 4℃保存。
黄芩素-8-磺酸钠溶液:称取适量黄芩素-8-磺酸钠,以少量 DMSO溶解后,用缓冲溶液定容并逐级稀释,配制浓度为 3.0×10-4mol/L的溶液。
2.4.2 与 EB-DNA作用荧光光谱的测定
在 10mL具塞刻度试管中分别加入 3.0×10-5mol/L EB溶液 1 mL,3.20×10-5mol/L DNA溶液 1 mL,室温下摇匀反应 30 min后,再分别加入不同量的待测化合物,摇匀,30 min后,用缓冲溶液定容至10 mL,以激发波长525 nm,狭缝 Ex=Em=10 nm,在550~750 nm范围内扫描其荧光发射谱(图 3)。
3 结果与讨论
3.1 黄芩素磺化反应工艺的优化
黄酮类磺化反应属于亲电取代反应机理,黄酮骨架上的-OH、-OCH3可使苯环活化,在它们的邻、对位发生亲电取代反应,得到相应的磺化产物。黄芩素A环上有3个-OH,实验中得到A环磺化产物。通过单因素实验,得到黄芩素最佳磺化条件为:黄芩素∶浓硫酸 =1∶8(g/mL),在 100℃反应 12 h。该条件下副产物少,收率高,产率约 75%。

表 1 浓硫酸用量对磺化反应的影响Table 1 Effect of the volume of sulphuric acid on the sulfonation reaction

表 2 反应时间对磺化反应的影响Table 2 Effect of the t ime on the sulfonation reaction

表 3 温度对磺化反应的影响Table 3 Effect of the temperature on the sulfonation reaction

8 100 12 75 8 120 12 74 8 140 12 70
3.2 黄芩素-8-磺酸钠的结构表征
黄芩素-8-磺酸钠在 1672.3 cm-1处的强吸收峰是– C=O的吸收。1109.0(宽而强)、1044.4 cm-1是-S的吸收。黄芩素磺化产物的 1H NMR图谱和黄芩素的1H NMR图谱比较相似,B环上所有质子及 C-3位上质子的峰形及化学位移和耦合常数均没有明显变化,而 A环上质子消失,说明取代基位于C-8位。
3.3 清除自由基实验
DPPH是一种稳定的自由基,呈紫色,在 517 nm处有强吸收。有自由基清除剂存在时,DPPH的单电子被配对而使其颜色变浅,在最大吸波长处的吸光度变小,因此,此处的吸光度可以用来检测自由基的清除情况,从而评价试验样品的抗氧化能力。DPPH法用于研究药物的抗氧化能力较多[15-17],氧化能力用抑制率来表示,抑制率越大,抗氧化性越强。
在黄芩素-8-磺酸钠抑制率曲线图 2中,当黄芩素-8-磺酸钠浓度为 4.0×10-4mol/L时,抑制率高达95%,稀释 10倍后,对 DPPH仍有 50%清除作用。由图 1求得黄芩素-8-磺酸钠对 DPPH的半抑制率I C50(抑制率为 50%时抗氧化剂的浓度)为 4.0× 10-5mol/L,与人工合成的强抗氧化剂 THBQ(特丁基对苯二酚)相当[18],表明黄芩素-8-磺酸钠对 DPPH有强抑制作用。
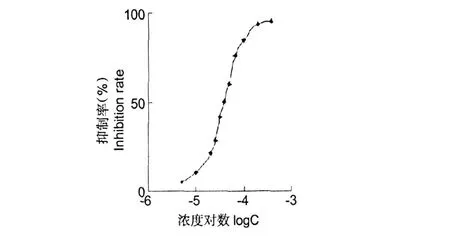
图 2 黄芩素-8-磺酸钠抑制率曲线Fig.2 Inhibition rate curve of sodium baicalein-8-sulfonate
3.4 对 EB-DNA体系荧光强度的影响
EB是一种典型的嵌入式荧光探针,自身荧光很弱,但嵌入DNA双螺旋结构后荧光强度显著增强。如果在 EB-DNA体系中加入的有机小分子M也能够与DNA发生类似于 EB的嵌入作用,这个小分子就会与EB竞争DNA的结合位点,将EB从EB-DNA复合物中挤出,使 EB-DNA体系的荧光强度降低,因此 EB常作为荧光探针研究DNA与小分子化合物的相互作用[19]。
黄芩素-8-磺酸钠对 EB-DNA体系荧光强度的影响见图 3。随着黄芩素-8-磺酸钠浓度的增加,EBDNA体系荧光强度显著降低。令 EB-DNA体系的荧光强度 RF=F/F0(F为添加猝灭剂时 EB-DNA体系的荧光强度,F0为未添加猝灭剂时 EB-DNA体系的荧光强度),RC=CM/CDNA(CM为猝灭剂的浓度,CDNA为DNA的浓度)。实验结果显示,在 RC= 40时,RF=65.5%,认为黄芩素-8-磺酸钠与 DNA发生了显著作用[20]。随着黄芩素-8-磺酸钠浓度的增加,体系荧光强度随 RC的增大而减小,说明黄芩素-8-磺酸钠与 EB竞争与 CT-DNA的结合位点,使体系中游离的 EB增多,因而体系的荧光强度降低。

图 3 黄芩素-8-磺酸钠对 EB-DNA体系荧光强度的影响Fig.3 Effect of sodium baicalein-8-sulfonate on the emission spectra
4 结论
本实验通过优化后的反应工艺合成了水溶性化合物黄芩素-8-磺酸钠,采用 IR、1H NMR和元素分析进行了结构表征。黄芩素-8-磺酸钠对 DPPH有强抑制作用,半抑制率 IC50为 4.0×10-5mol/L;与DNA作用较强,能使 EB-DNA体系荧光强度显著降低。
1 Zhou LG(周立刚),Zhang YJ(张颖君),Cai Y(蔡艳),et al.Antifungal activities in vitro of flavonoids and steroids from medicinal plants.Nat Prod Res Dev(天然产物研究与开发),1997,9:24-29.
2 Ahn HC,Lee SY,K im JW,et al.Binding aspects of baicalein to H IV-1 integrase.M ol Cells,2001,12:127-130.
3 Hong T,Jin GB,Cho S,et al.Evaluation of the anti-inflammatory effect of baicalein on dextran sulfate sodium-induced colitis in mice.Planta M ed,2002,68:268-271.
4 Lin CC,Shieh DE.The anti-inflammatory activity ofScutellaria rivularisextracts and its active components,Baicalin, Baicalein and wogonin.Am J Chin M ed,1996,24:31-36.
5 Gao ZH,Huang KX,Yang XL,et al.Free radical scavenging and antioxidant activities of flavonoids extracted from the radix ofScutellaria baicalensisgeorgi.B ich im B iophys Acta, 1999,1472:643-650.
6 Lee HZ,Leung HW,Lai MY,et al.Baicalein induced cell cycle arrest and apoptosis in human lung squamous carcinoma CH27 cells.Anticancer Res,2005,25:959-964.
7 Kimura Y,Matsushita N,Yokoi-Hayashi K,et al.Effects of baicalein isolated fromScutellaria baicalensisradix on adhesion molecule expression induced by thrombin and thrombin receptor agonist peptide in cultured human umbilical vein endothelial cells.Planta M ed,2001,67:331-334.
8 Liu JJ,Huang TS,Cheng WF,et al.Baicalein and baicalin are potent inhibitors of angiogenesis:inhibition of endothelial cell proliferation,migration and differentiation.Int J Cancer, 2003,106:559-565.
9 Liu QG(刘谦光),Zhang ZT(张尊听),Xue D(薛东).Synthesis,crystal structure and activity of sulfated daidzein. Chem J Chin Univ(高等学校化学学报),2003,24:820-825.
10 Zhang ZT(张尊听),Wang QY(王秋亚),He Y(贺云),et al.Syntheses,crystal structures and biological activity of bimethylation daidzein sulfonates.Chem J Chin Univ(高等学校化学学报),2005,26:2247-2253.
11 Zhang ZT(张尊听),Guo YN(郭亚宁),Liu QG(刘谦光). Syntheses and crystal structures of[Na(H2O)](C17H13O6SO3)·2H2O and[Ni(H2O)6](C17H13O6SO3)2· 4H2O.Chin J Chem,2004,22:971-977.
12 Zhang ZT(张尊听),Guo YN(郭亚宁),Liu QG(刘谦光). Syntheses,crystal structures and photoluminescence of a novel tetra-nuclear calcium complex[{Ca(C15H8O7S)(H2O) (DMSO)}3{Ca(C15H8O7S)(DMSO)2}]·4DMSO.Sci China SerB(中国科学B辑),2004,34:225-234.
13 Pyle AM,Rehmann JP,Messhoyrer CV,et al.Mixed-ligand complexes of ruthenium(Ⅱ):factors governing binding to DNA.J Am Chem Soc,1989,111:3051-3055.
14 Ning YC(宁永成).Structural Identification ofOrganic Compounds and Organic Spectroscopy(有机化合物结构鉴定与有机波谱学).Beijing:Science Press,2000.497-498.
15 Nicole C.Antioxidant properties of hydroxy-flavones.Free Radical B iolM ed,1996,20:35-43.
16 Alexandre C,Kurt H,Wahjo D,et al.Antioxidant and lipophilic constituents of Tinospora crispa.Planta M ed,1998, 64:393-396.
17 ZhangLX(张立新),Hang H(杭瑚).Studies on antioxidative activity of 21 kinds of wild plants.Chin Tradit Herb D rugs(中草药),2000,31:609-610.
18 Zhang ZT(张尊听),He Y(贺云),Liu QG(刘谦光),et al. Spectrophotometric determination of antioxidative activity of 20 kinds of Chinese traditional and herbal drugs in the Tai Baimountain.Chin J Anal Lab,2002,21:50-52.
19 Zhou QH,Yang P.Crystal structure andDNA-binding studies of a new Cu(Ⅱ)complex involving benz imidazole.Inorg Chem Acta,2006,359:1200-1206.
20 Li ZL(李志良),Chen JH(陈建华),Zhang KC(章开诚), et al.Study on the fluorescentmethod of preliminary filtration Schiff base non-platinium anticancer complex.Sci China Ser B(中国科学B辑),1991,11:1193-1200.
Synthesis of Sulfonated Ba icalein and Its Antioxidative Activity and Interaction with DNA
HE Qing1,2,WANG Yan-chang1,HE Yun1,ZHANG Zun-ting1*,ZHANG Xiao-qing31School of Chem istry and M aterials Science,Shaanxi Nor mal University,Xi’an 710062,China;2College of Chem istry and M aterials Science,W enzhou University,W enzhou 325027,China;3Xi’an M edical University,Xi’an 710012,China
A sulfonate was introduced to the molecular structure of baicalein by sulfonation reaction and water-soluble flavone sodium baicalein-8-sulfonate was synthesized.Sodium baicalein-8-sulfonate was characterized by IR,1H NMR, and elemental analyses.And the conditions of sulfonation reaction were optimized.The antioxidative activity of sodium baicalein-8-sulfonate was tested by the method ofDPPH(1,1-diphenyl-2-picrylhydrazyl free radical).Furthermore,the interaction of sodium baicalein-8-sulfonate with DNA was studied by fluorescent spectroscopy of EB as a spectral probe in Tris-HCl buffer(pH =7.4).The result indicated that the optimal sulfonation reaction conditions are the ratio of baicalein and sulphuric acid=1∶8(g/mL),temperature 100℃,and t ime 12 h.The antioxidative activity of sodium baicalein-8-sulfonate was stronger than baicalein,and its interaction with DNA was higher.
baicalein;sodium baicalein-8-sulfonate;antioxidative activity;CT-DNA
1001-6880(2010)06-0961-05
2009-05-26 接受日期:2009-07-28
教育部重点项目 (107138);陕西省自然科学基金资助(SJ08B19)
*通讯作者 E-mail:zhangzt@snnu.edu.cn
Q946.91;R285;O614
A

