合欢皮提取物抑制血管生成作用的研究
花 慧,冯 磊,张小平,张莲芬,金 坚*
1江南大学医药学院天然药物研究室;2江南大学工业生物技术教育部重点实验室,无锡 214122
合欢皮提取物抑制血管生成作用的研究
花 慧1,冯 磊1,张小平1,张莲芬2,金 坚2*
1江南大学医药学院天然药物研究室;2江南大学工业生物技术教育部重点实验室,无锡 214122
本文采用体外细胞培养法和体内鸡胚尿囊绒膜模型、荷瘤模型检测合欢皮提取物抑制人微血管内皮细胞(HMEC-1)的增殖、迁移活性,观察合欢皮提取物的抑制血管生成情况。发现合欢皮提取物能显著抑制HMEC-1的增殖 (I C50为 30μg/mL)和迁移,并且呈明显的剂量依赖性。在体内同时具有抑制鸡胚尿囊膜和肿瘤组织中血管生成的作用。
合欢皮;血管生成;内皮细胞
血管生成 (angiogenesis)是指毛细血管从已存在的血管周围生成的过程,包括血管内皮细胞的激活、细胞外基质的降解、内皮细胞的增殖与移行、形成新的血管和血管网,并且与已存在的血管连接。正常成年人的血管内皮细胞一般处于相对静止状态,生理情况下内皮细胞平均每数年分裂一次,但在病理状态下血管生成是有害的,它能促进疾病的必然发生,主要发生在动脉粥样硬化、固体肿瘤生长及与风湿性关节炎相联系的慢性炎症。有文献报道肿瘤新生血管内皮细胞快速增生,形成血管,从而导致肿瘤组织得到充分的营养供应,将原发癌细胞输送、转移至靶器官,最终导致肿瘤的转移[1-4]。因此,抗血管生成药物已经成为肿瘤治疗的重要药物。本课题首先建立了天然药物库,运用多个体内、体外模型来筛选有抑制血管生成作用的天然药物。经过反复实验,发现了三位具有显著抑制血管生成作用的天然药物,合欢皮便是其中之一。
合欢皮是一味常用中药,为豆科植物合欢 A lbizia julibrissinDurazz.的干燥树皮,具有解郁安神、活血消肿的功能,用于心神不安、忧郁失眠、肺痈疮肿、跌扑伤痛等症。文献报道合欢皮提取物具有广泛的体内、体外抑制肿瘤细胞增殖的活性[5-7]。但它是否具有纯粹的抗血管生成作用,以及它的抗肿瘤作用是否与其抑制肿瘤血管形成有关尚不清楚。
1 材料
1.1 主要仪器
Model 3110细胞培养箱 (Ther mo-For ma公司); MK3型酶标仪 (Thermo-Labsystems公司);BX-40光学显微镜(Olympus公司)。
1.2 药品与试剂
合欢皮、甘草药材购自江苏省无锡市山禾药业股份有限公司,由南京中医药大学陈健伟教授鉴定分别为 A lbizia julibrissinDurazz.的干燥树皮和 Glycyrrhiza uralensisFisch.的干燥根及根茎。受精白皮种蛋购自无锡马山养鸡场。EGF、MTT、MCDB-131细胞培养基 (Gibco BRL公司),胰酶、小牛血清、L-谷氨酰胺 (华美生物工程公司),CD31单克隆抗体及免疫组化试剂盒(北京中杉金桥生物技术服务有限公司),其他试剂均为国产分析纯。
1.3 实验动物
BALB/c-nu/nu裸小鼠(来源于上海市肿瘤研究所,雌性)。
1.4 实验细胞系
SV40病毒转染的人微血管内皮细胞传代株(HMEC-1,法国国家卫生医学研究院 U553研究所(INSERM U553)陆核教授馈赠),C51结肠癌细胞(中国科学院上海细胞库提供)。
2 方法
2.1 合欢皮提取物的制备
1 kg合欢皮用 10 L的 75%乙醇回流提取两次(1.5、1 h),合并提取液后减压浓缩回收乙醇,浸膏冷冻干燥,其干物质的得率为 13.45%。甘草提取物的制备与上述方法相同冷冻干燥后得到粉末,干物质的得率为 18.45%。
2.2 细胞培养
HMEC-1细胞采用MCDB培养液 (由MCDB-131细胞培养基、1μg/mL氢化可的松、10 ng/mL表皮生长因子(EGF)、15%小牛血清和 0.01%L-谷氨酰胺配制成)。C51结肠癌细胞采用含 10%小牛血清的 RPM I-1640培养基培养。以上两种细胞株置于 37℃、5%CO2饱和湿度下常规培养传代,观察细胞生长状况并确保细胞生长良好。实验均用处于对数生长期的细胞。
2.3 细胞增殖抑制实验(MTT法)
用 0.25%胰酶将 HMEC-1细胞消化并制成单细胞悬液,按每孔 6000~7000个细胞接种于 96板, 37℃、5%CO2过夜,加入不同浓度的样品溶液,分别以单纯的培养液和未经药物作用的细胞作为空白对照和阴性对照,每组设 8个复孔 (实验重复 3次),继续培养48 h。每孔加MTT(5 mg/mL)20μL,继续培养 4 h,弃上清液,每孔加 DMSO 150μL,37℃孵育 10 min,酶标仪检测 490 nm波长处的吸光度(A490)值。按以下公式计算平均抑制率。

2.4 人微血管内皮细胞迁移能力的抑制实
取对数生长期的 HMEC-1细胞,以 105 cell/mL细胞接种于 24孔板,1 mL/孔,每组设 4个平行孔,细胞贴壁后,沿孔中线划去细胞,培养基洗涤,去除死细胞,分别加水阴性对照组和合欢皮提取物 30 μg/mL,分别在 0、6、12、24 h.拍照,量取中间空白带的宽度,记录。
2.5 CAM血管生成形态学检测
受精白皮种蛋,参考文献方法[8]制备鸡胚尿囊膜。用打孔器制备直径为 6 mm的微孔滤膜圆片,湿热高压消毒。设合欢皮提取物给药组 100、500、1000μg/mL和生理盐水阴性对照组。分别取 1 mL以上不同浓度药物滴于滤纸上,制成药膜,吹干备用。鸡胚培养 3 d后分组,将药膜贴于 CAM的部位。加药 48 h后,观察计数药膜周围 8 mm内大、中、小血管数,并摄影记录。
2.6 体内荷瘤模型小鼠分析血管内皮细胞中CD31分子表达的影响
用 PBS制成 C51结肠癌细胞系细胞的细胞悬液,以 200万 cell/200μL接种至 8周大 BALB/cnu/nu裸鼠的右股部皮下。待瘤体生长至 5 mm×5 mm大小时,随机分成三组:生理盐水对照组,甘草提取物阴性对照(0.4 mL、100 mg/mL),合欢皮提取物用药组(0.4 mL、100 mg/mL),每组 5只。连续灌胃给药 60 d,每天记录瘤体的长径和短径。用药期间,小鼠未出现不良反应。处死小鼠后,取出肿瘤称重记录,然后按以下公式计算肿瘤抑制率:肿瘤抑制率 =[1-给药组平均瘤重/生理盐水对照组平均瘤重]×100%。肿瘤组织制成冰冻切片,应用 SABC法对上述冰冻切片进行 CD31免疫组织化学染色,显微镜下观察 (×200)记录血管数,微血管密度(MVD)的测定标准参照文献[9]的方法。
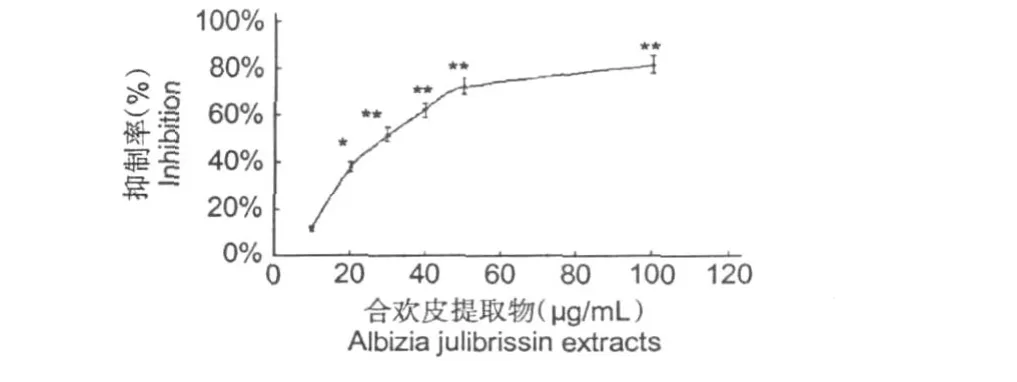
图 1 合欢皮提取物对人微血管内皮细胞(HMEC-1)增殖的影响Fig.1 Effect ofA lbizia julibrissinextracts on proliferation of HMEC-1
3 结果
3.1 合欢皮提取物对人血管内皮细胞增殖的影响
结果见图 1,合欢皮提取物对人血管内皮细胞增殖有显著的抑制作用,其半数抑制量为 30μg/ mL,而且这种抑制作用有剂量依赖关系。
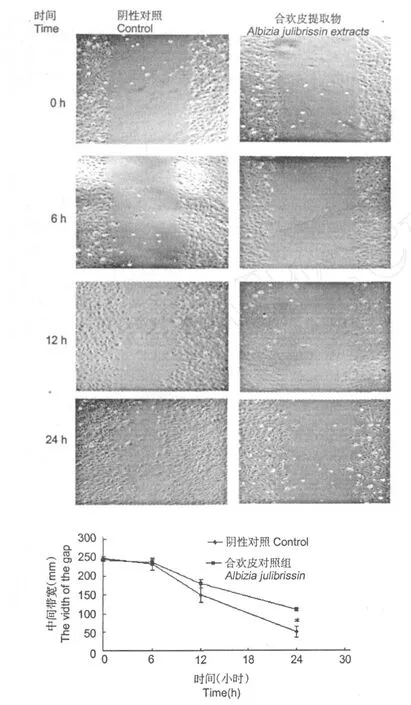
图 2 合欢皮提取物对人血管内皮细胞 (HMEC-1)迁移的影响Fig.2 Effect ofA lbizia julibrissinextracts on migration ofHMEC-1
3.2 合欢皮提取物对内皮细胞迁移的影响
结果如图 2所示,6 h后阴性对照组细胞之间的空白带的宽度较加入合欢皮提取物加以干预的小。说明HMEC-1经合欢皮提取物干预后迁移能力减弱。
3.3 合欢皮提取物抑制 CAM新生血管的形成
CAM是经典的血管生成评价模型。本实验发现生理盐水阴性对照组CAM血管生成非常明显,整体呈鲜红色,血管在药膜下呈放射状生长,血管粗大,血液充盈,血管分支较多,毛细血管密度大。合欢皮提取物给药组浓度为 500μg/mL时则明显抑制了血管生成,放射状生长的血管数目大为减少,血管主要以零星、杂乱、叶脉样等表现形式存在,血管细小,稀疏,血管分支少,血管色淡浅黄,在药膜片下及周围局部鲜有血管区,或者血管断裂或消失,而当浓度为 1000μg/mL这些现象更加明显。结果表明合欢皮提取物能显著抑制新生血管生成。结果如图3、表 1所示。

图 3 合欢皮提取物对CAM新生血管生成的影响(×10)Fig.3 Effect ofA lbizia julibrissinextracts on neovascularization in CAM(×10)
表 1 合欢皮提取物对CAM新生血管生成的影响Table 1 Effect ofA lbizia julibrissinextracts on neovascularization in CAM(±s,n=12)

表 1 合欢皮提取物对CAM新生血管生成的影响Table 1 Effect ofA lbizia julibrissinextracts on neovascularization in CAM(±s,n=12)
*P<0.05,**P<0.01 vs Control
合欢皮提取物Albizia julibrissin extracts大血管数Large vessel中血管数Middle vessel小血管数Small vessel 0μg/mL(Control) 2.5±0.2 3.5±0.67 19.7±0.47 100μg/mL 2.1±0.34 3.9±0.53 15.6±0.29 500μg/mL 2.6±0.54 2.8±0.97 10.7±0.19*1000μg/mL 2.5±0.67 2.5±0.27 6.8±0.48**
3.4 合欢皮提取物对荷瘤模型小鼠的肿瘤组织中血管内皮细胞中CD31分子表达的影响
合欢皮提取物用药组相对与生理盐水对照组抑瘤率高达 67.5%,而甘草提取物组与生理盐水对照组的平均瘤重几乎无显著差异结果见表 2。通过肿瘤组织切片免疫组化染色发现生理盐水对照组中微血管呈棕褐条索状分布,血管密集。合欢皮提取物用药组的肿瘤组织的微血管 CD31分子表达明显稀少,几乎观察不到血管,结果表明合欢皮提取物具有抑制肿瘤组织中血管内皮细胞 CD31分子表达,即降低血管内皮细胞之间的黏附作用,从而抑制新生血管形成的作用。而甘草提取物对新生血管形成没有明显抑制作用。

表 2 各组荷瘤裸鼠治疗后抑瘤率和微血管密度Table 2 The rate of inhibition(IR)of tumor growth and microvessel density(MVD)of different groups
4 讨论
肿瘤的血管系统已成为一个崭新的、有希望的抗肿瘤治疗靶点。开发和研究能破坏或抑制血管生成,有效地阻止肿瘤生长和转移的药物是非常有前途的。血管生成抑制剂最大的优点在于它不容易产生耐药性,大多数实体瘤都能得到满意的治疗效果。
世界各国目前已经开发出许多血管生成抑制剂,有的正在进行Ⅰ~Ⅲ期临床试验研究,例如血管生成抑素 (angiostatin)、内皮抑素 (endostatin)等生物制剂。但是这些药物毒性大、稳定性欠佳、有效浓度高、需要长期注射给药、价格昂贵,因此限制了其在临床上的使用。寻找与开发无毒、高效、可以口服、价格便宜的血管生成抑制剂是该领域的热点和难点。我国的传统中药以其独特的优点,日益受到药物研究者的重视,从中药中寻找抗肿瘤血管生成的药物已成为国内外药物研究的一个重要策略。
合欢皮作为传统中药材,临床上一直被用作解郁安神类药物使用。现代药理实验表明,合欢皮提取物具有镇静、抗生育、PAF受体拮抗、抗癌和抗炎等作用。迄今为止未发现以抗新生血管为靶点对合欢皮进行系统研究的报道。本课题组以抑制血管生成活性作为切入点,主要研究了合欢皮提取物对体外培养的人脐静脉内皮细胞增殖和迁移、体内抑制血管的形成、以及肿瘤组织中 CD31血管内皮细胞表达的影响。
血管内皮细胞的持续性增殖和迁移是血管生成的基础及重要特征。人体正常情况下,内皮细胞的更新需要几百天,而在发生血管生成的时候,血管内皮细胞的增殖速度平均只需5 d,而且表现出很强的迁移性。因此药物具有抑制内皮细胞增殖和迁移的作用,可认为其具有抗新生血管的活性。我们研究发现,合欢皮提取物在极低浓度下 (0~100μg/mL)对 HMEC-1表现出明显的抑制增殖和迁移的活性。这种抑制作用呈现剂量依赖关系,IC50为 30μg/mL。当浓度为 30μg/mL时,HMEC-1迁移数目极少,迁移行为几乎被完全阻断。提示抑制内皮细胞增殖和迁移是合欢皮提取物抗血管生成的重要途径之一。
现代基础医学研究表明血管内皮细胞形成小管样结构是新生血管的必然过程。通过鸡胚尿囊膜血管生成实验结果表明,合欢皮提取物对体内内皮细胞管状结构的形成和血管新生也有明显的抑制作用。在肿瘤模型中,以 CD31血小板内皮细胞黏附分子 21(PECAM21)用来作为血管内皮细胞的标志物是由于在发育和成熟个体的所有血管内皮细胞都有高度表达 (CD31),CD31是介导内皮细胞黏附的重要分子,而内皮细胞相互间的黏附是血管生成的基本过程[10]。免疫组化染色显示小鼠口服合欢皮提取物后对可减少接种的肿瘤组织中内皮细胞CD31的表达,也就是减少内皮细胞之间黏附。具有抑制新生血管形成的作用。实验过程中我们选用临床报道具有抗肿瘤作用的甘草作阴性对照,目的是为了更好的突出合欢皮抑制肿瘤生长与新生血管生成有关。综合上述实验结果,合欢皮提取物作用是多方面的,它抑制 HMEC-1内皮细胞的增殖、迁移和小管形成,降低 CD31的表达,多途径抑制新生血管的形成,从而降低肿瘤的病灶面积和抑制肿瘤生长和转移。因此,合欢皮有可能成为一个具有较好前途的肿瘤血管形成的抑制剂。
1 Tímár J,Döme B,Fazekas K,et al.Angiogenesis-dependent diseases and angiogenesis therapy.Pathol Oncol Res,2001, 7:85-94.
2 Folkman J.Angiogenesis in cancer,rheumatoid and disease. NatM ed,1995,1:27-31.
3 DAmato RJ,AdamisAP.Angiogenesis inhibition in age-related macular degeneration.Ophthalm ology,1995,102:1261-1262.
4 Arbiser JL.Angiogenesis and the skin:a primer.J Am Acad Der m atol,1996,34:486-497.
5 Zheng L,Zheng J,ZhaoY,et al.Three anti-tumor saponins fromA lbizia julibrissin.B ioorg M ed Chem Lett,2006,16: 2765-2768.
6 Zou K,Zhao Y,Tu G,et al.Two diastereomeric saponinswith cytotoxic activity from A lbizia julibrissin.Carbohydr Res, 2000,324:182-188.
7 Zou K,Zhao YY,Tu GZ,et al.A triterpenoid saponin from A lbizia julibrissin.J Asian Nat Prod Res,1999,1:313-318.
8 Zhang SC(张树成),Wu ZK(吴志奎),Wang L(王蕾),et al.Application of chicken chorioallantoic membrane as a model for study of effects of Chinese medicine on angiogenesis.Chin J BasicM ed in Tradit Chin M ed(中国中医基础医学杂志),1999,5:16-19.
9 Gasparini G,Harris AL.Clinical importance of the determination of tumor angiogenesis in breast carcinoma much more than a new prognostic tool.J Clin Oncol,1995,13:765.
10 DeLisser HM,Christofidou-Solomidou M,Strieter RM,et al. Involvement of endothelial PECAM-1/CD31 in angiogenesis. Am J Pathol,1997,151:671-677.
The Study on the Anti-angiogenen ic Effect ofA lbizia julibrissinExtracts
HUA Hui1,FENGLei1,ZHANG Xiao-ping1,ZHANGLian-fen2,J IN Jian2*1Laboratory of NaturalM edicine,School of M edicine and Phar m aceutics,Jiangnan University;2The Key Laboratory of Industrial B iotechnology,M inistry of Education,Jiangnan University,W uxi 214122,China
The anti-angiogenenic effect ofA lbizia julibrissinextracts was examined by the model of HMEC-1 in vitro, chick chorioallantoicmembrance and cancerin vivo.The results showed thatA lbizia julibrissinextracts could significantly inhibit the proliferation andmigration of HMEC-1 in a dose-dependentmanner(IC50=30μg/mL).It also inhibited the angiogenesis in chick chorioallantoic membrance and cancer in vivo.
A lbizia julibrissinDurazz;angiogenesis;HMEC-1
1001-6880(2010)02-0215-05
2008-05-06 接受日期:2008-08-01
2008年教育部博士点新教师基金(200802951021)
*通讯作者 Tel:86-532-88963253;E-mail:jinjian31@126.com
R332;R282.71
A

