从镍钼矿冶炼烟尘浸出液中还原硒的热力学及应用
侯晓川,肖连生,高丛堦 ,张启修,张贵清,曹佐英, 李青刚
(1. 中南大学 冶金科学与工程学院,长沙 410083;2. 金川有色金属公司,金昌 737100)
从镍钼矿冶炼烟尘浸出液中还原硒的热力学及应用
侯晓川1,2,肖连生1,高丛堦1,张启修1,张贵清1,曹佐英1, 李青刚1
(1. 中南大学 冶金科学与工程学院,长沙 410083;2. 金川有色金属公司,金昌 737100)
分析SO2在溶液中的存在形态,并对亚硫酸钠在酸性水溶液中还原硒进行热力学分析。通过实验研究验证热力学分析结果的正确性,并确定亚硫酸钠还原硒的最优技术参数:还原温度80 ℃,还原酸度3.5 mol/L,搅拌速率400 r/min,还原时间120 min,亚硫酸钠加入系数β(亚硫酸钠质量与溶液中硒的质量比)为10。在最佳技术条件下,硒的还原率为99.18%,研制的硒粉品位为99.684%。XRD和SEM-EDS的分析结果表明:硒粉微观形态复杂,只观察到元素硒的特征谱线,证明还原硒粉纯度较高。
硒;亚硫酸钠;还原;热力学;应用
随着现代冶金工业的快速发展,镍和钼的应用领域不断扩大,导致对镍、钼的需求量逐年增加。而独立的镍、钼矿床较少,并逐渐枯竭。镍钼矿是一种富含镍、钼的多金属复合矿,广泛分布于我国的贵州、湖南、云南和浙江等地区[1−2]。由于其巨大储量和有价金属镍、钼含量较高(w(Ni): 0.7%~7.7%;w(Mo):2%~11%),从而引起国内外冶金工作者的高度关注。据估算,镍钼矿中含钼5 220万t、镍4 515万t、金510 t、银10 800 t、钯480 t、稀有金属501 t[3]。因此,开发和利用镍钼矿具有重要的意义。
镍钼矿的生产工艺主要采用火法冶金与湿法冶金相结合,从中综合提取有价元素。在氧化焙烧过程中,硒和砷被氧化为二氧化硒和砷的氧化物,此类氧化物挥发进入烟气。在湿式收尘过程中,绝大部分二氧化硒被烟气中的二氧化硫还原为元素硒,从而沉降在冶炼烟尘中,致使烟尘中有价元素硒的含量高达 5%,而有害元素砷高于18%。长期以来,这些生产厂家缺乏有效处理镍钼矿冶炼烟尘的工艺,导致该冶炼烟尘多年堆积,常年经受风吹雨淋,对环境极其有害的元素硒、砷流入江河湖泊,或渗透进入土壤,对环境产生极大的污染。同时,有价元素硒大量流失,未能得到综合回收利用。
硒是人体和动物生命活动必须的微量元素[4−5],硒缺乏就会导致多种疾病[6−7];但过量摄入硒就会产生硒中毒[8−10]。因此,为了消除硒对人类及其生存环境的破坏,达到综合利用资源和保护环境的目的,进行镍钼矿冶炼烟尘中硒的提取工艺研究。
目前,提取硒的主要原料为电解精炼铜、镍、铅的阳极泥,硫酸和纸浆生产中产生的酸泥等原料。传统提取硒的工艺为氧化焙烧含硒原料,水吸收二氧化硒,二氧化硫还原吸收液中亚硒酸得到硒粉[11]。本研究中,镍钼矿冶炼烟尘中的硒,在盐酸和硫酸的复合介质中,经过氧化浸出进入浸出液。在一定的还原条件下,采用亚硫酸钠将浸出液中的亚硒酸还原为金属硒粉。目前,未见有从镍钼矿冶炼烟尘中提取硒的工艺报道。热力学计算表明, 采用亚硫酸钠为还原剂, 可以将镍钼矿冶炼烟尘浸出液中的硒还原为硒粉,并通过实验证明热力学分析结果。通过对该工艺的研究,回收镍钼矿冶炼烟尘中的硒,消除该烟尘中的硒和砷对环境的严重污染,具有重要的社会效益和经济效益。
1 热力学分析
1.1 水溶液中SO2存在的形态
在酸性水溶液中,采用Na2SO3或NaHSO3作还原剂,在酸的作用下分解产生SO2:
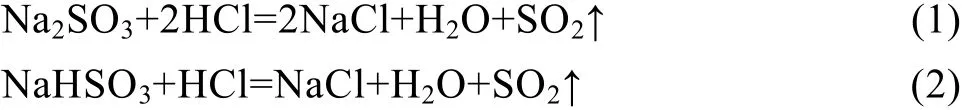
因此,用Na2SO3或NaHSO3作还原剂的还原过程,实质上属于二氧化硫的还原[12]。
气体 SO2溶解于水溶液中,首先生成 H2SO3,H2SO3进一步离解为 HSO3−和 SO32−,反应方程式如下[13]:
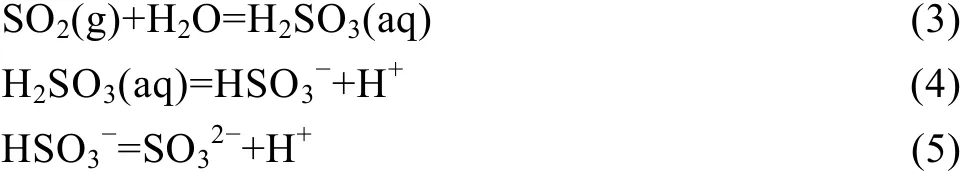
溶液中SO2组分的总浓度[SO2]T为
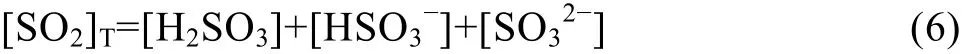
在SO2分压p(SO2)=105Pa,大气压pΘ=105Pa的条件下,采用热力学数据[13],由式(3)~(6)分别计算25 ℃和75 ℃时溶液中SO2各组分浓度与pH的关系,其结果如图1所示。
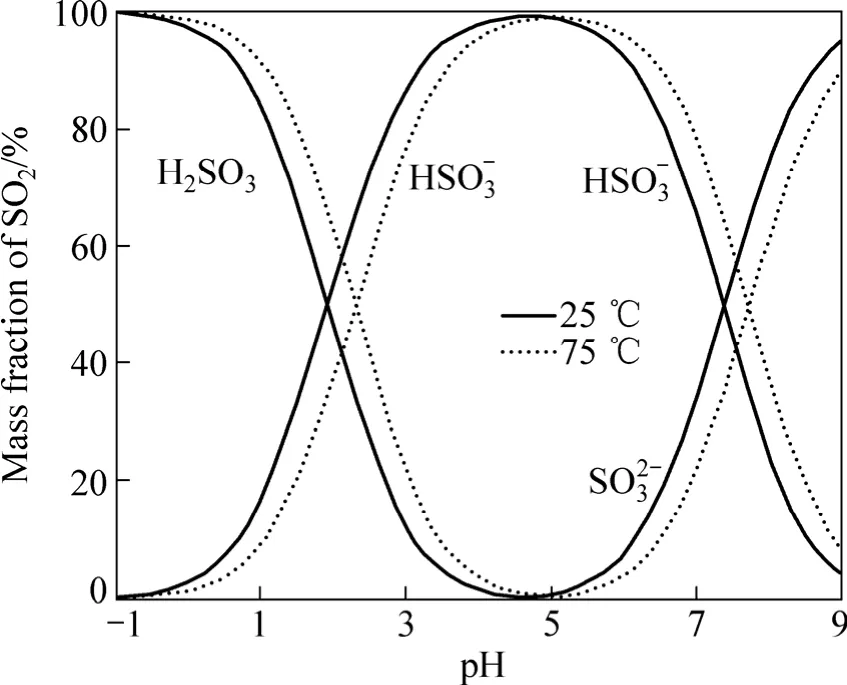
图1 溶液中各组分SO2的浓度与pH的关系Fig.1 Relationships between SO2 concentration and pH
从图1可以看出,在pH<0的强酸性溶液中,SO2溶解于溶液中以H2SO3形态存在;在弱酸及碱性溶液中,SO2主要以HSO3−和SO32−形态存在。溶液的温度由25 ℃升高到75 ℃,H2SO3稳定存在的pH范围有所扩大。
1.2 SO2还原的热力学分析
实验所用溶液中的Se以H2SeO3存在, As和P分别以 HAsO2和 H3PO3形态存在,Al、Fe、Ni、K 和Ca分别以Al3+、Fe2+、Ni2+、K+和Ca2+形态存在,被还原溶液的主要成分如表1所列。
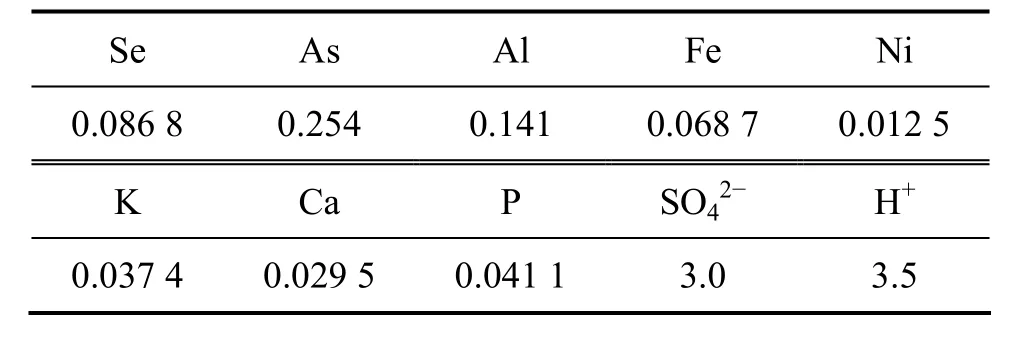
表1 溶液的主要成分Table 1 Main composition of solution (mol/L)
在盐酸浓度为3.5 mol/L的溶液中加入Na2SO3,此时发生式(1)的化学反应,生成SO2气体。SO2易溶于水,在常温下,1 L水中可溶解约40 L的SO2。在水溶液中,SO2的还原性表现为S的价态由+4价升高至+6价,即转化为SO42−。其电极反应:
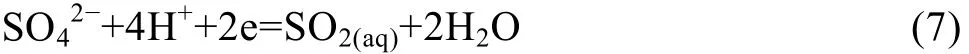
反应的电极电势为
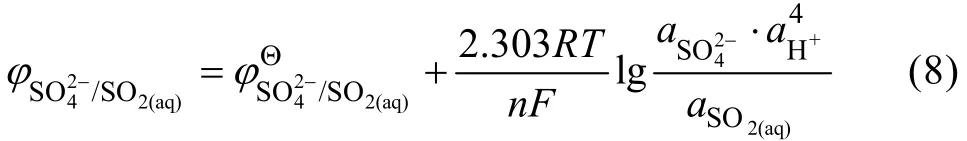
在25 ℃时的电极电势为

当SO2溶解于水溶液中,发生式(3)、(4)和(5)的反应时,反应生成的 SO32−同样具有还原性,其电极反应:

同理,在25 ℃时的电极电势为
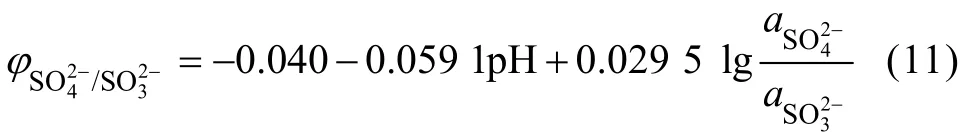
由式(9)和(11)可以看出, ϕSO24−/ SO2(aq)或ϕSO24−/SO23−均随着溶液中SO42−活度的增大而增大,随着pH值的升高而降低,因此,提高溶液的pH值有利于提高SO2的还原能力。但是,随着溶液 pH值的提高及溶液中SO32−浓度的增大,溶液中金属阳离子则会发生水解,或与 SO32−反应生成难溶于水的亚硫酸盐(碱金属的亚硫酸盐除外)。因此,当用 SO2(Na2SO3或 NaHSO3)从溶液中还原金属时,均需在一定浓度的酸性介质中进行。
假设SO2发生式(3)的化学反应,在溶液中均生成H2SO3。SO2还原金属的反应如下:
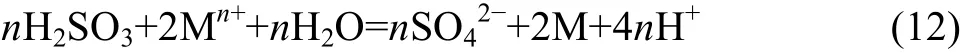
电极反应分别为
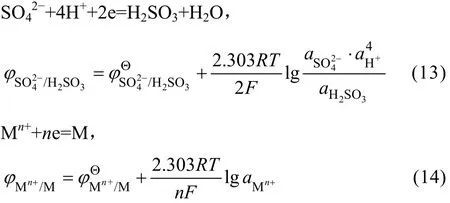
显然, SO2还原反应能够进行的热力学条件是:。两者电极电位差值越大, 则反应进行的可能性越大,金属被还原的程度越高。从式(14)可以看出,当一定时,可以通过改变溶液酸度和浓度来调节, 从而实现选择性还原溶液中的金属离子。溶液中主要金属离子可能存在的电极反应、标准电极电位以及按表1溶液成分(以离子的浓度代替活度)计算离子的电极电位列于表2中。
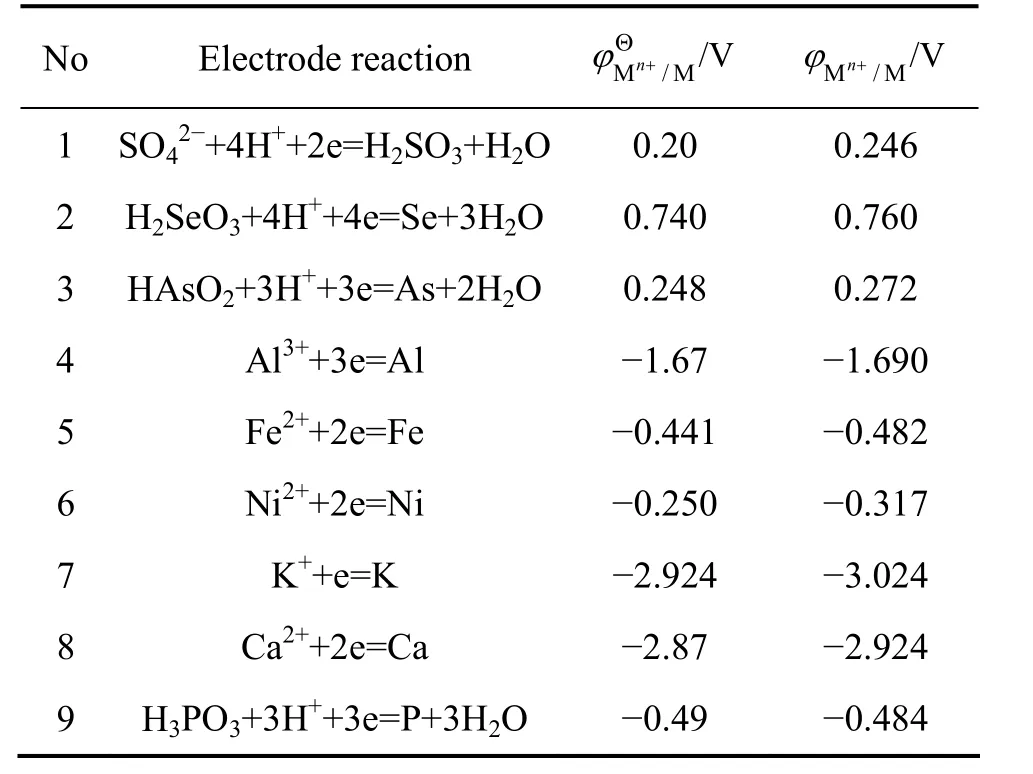
表2 溶液中主要离子的标准电极电位和实际电极电位[14]Table 2 Standard and actual electrode potential for major ion in solution[14]
1.3 标准平衡常数分析
在酸性介质中,采用亚硫酸钠还原溶液中H2SeO3的化学反应方程式为
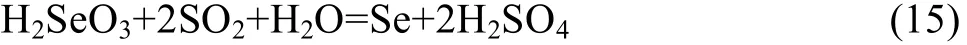
该氧化−还原反应进行的程度,可由反应的标准平衡常数KΘ大小来判断:

由式(16)和(17)可得:

反应(15)可分解为两个电极反应:
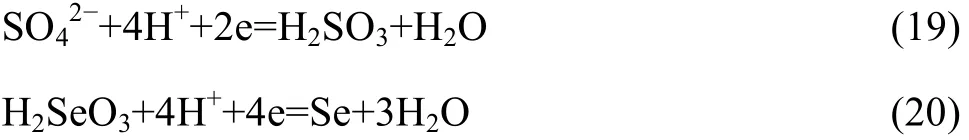
2 实验
2.1 实验原料
实验所用原料为镍钼矿冶炼烟尘浸出液,其主要成分如表1所列。
2.2 实验方法
采用250 mL三口烧瓶作还原容器,向容器中量取一定量的被还原溶液。采用机械搅拌和水浴加热,当加热到实验要求的温度后,向容器中加入一定量的浓盐酸。同时,用蠕动泵向反应容器中加入一定浓度的亚硫酸钠溶液。保持实验要求的还原温度,达到还原时间后,停止搅拌和加温,静置冷却。过滤、洗涤并低温(50 ℃)烘干还原所得硒粉,分别计量硒粉质量和还原后溶液的体积。采用美国Baird公司的PS−6型电感耦合等离子发射光谱(ICP)分析检测元素,使用日本理学D/MAX−RB型X射线衍射仪(XRD)分析还原硒粉的物相,采用JSM−6301F场发射扫描电子显微镜(SEM−EDX)观察硒粉的微观形貌,并用EDX分析其组成元素。
3 结果与讨论
3.1 还原温度对硒还原率的影响
还原实验的基本条件:β(亚硫酸钠质量与溶液中硒的质量比)8,还原时间120 min,搅拌速率350 r/min,被还原溶液的酸度3 mol/L。考察还原温度对硒还原率的影响,实验结果如图2所示。
从图2可以看出,在25~80 ℃的范围内,硒的还原率随着还原温度的升高而逐渐增大;在80 ℃时,硒的还原率达到最大;当还原温度高于80 ℃时,硒的还原率随温度的升高而逐渐降低。其主要原因是温度越高,化学反应的速率越快,但温度过高时,由于硒的还原反应在较高的酸度下进行,从而导致单位时间内还原剂 Na2SO3的分解加剧,反应生成的 SO2释放较快;另一方面,随着温度的升高,SO2在溶液中的溶解度逐渐降低,部分SO2未来得及与溶液中的H2SeO3反应就溢出体系,造成SO2利用率降低,硒的还原率下降。因此,硒的还原温度在80 ℃较好。

图2 还原温度对硒还原率的影响Fig.2 Effect of reaction temperature on reduction rate of Se
3.2 亚硫酸钠的加入量对硒还原率的影响
还原实验的基本条件:还原温度80 ℃,还原时间120 min,搅拌速率350 r/min,还原酸度3 mol/L。在此实验条件下,改变亚硫酸钠用量,考察β(亚硫酸钠质量与溶液中硒的质量比)对硒还原率的影响,实验结果如图3所示。从图3可以看出,随着β的增加,硒的还原率呈快速增大的趋势。当β增加到10,还原时间为120 min
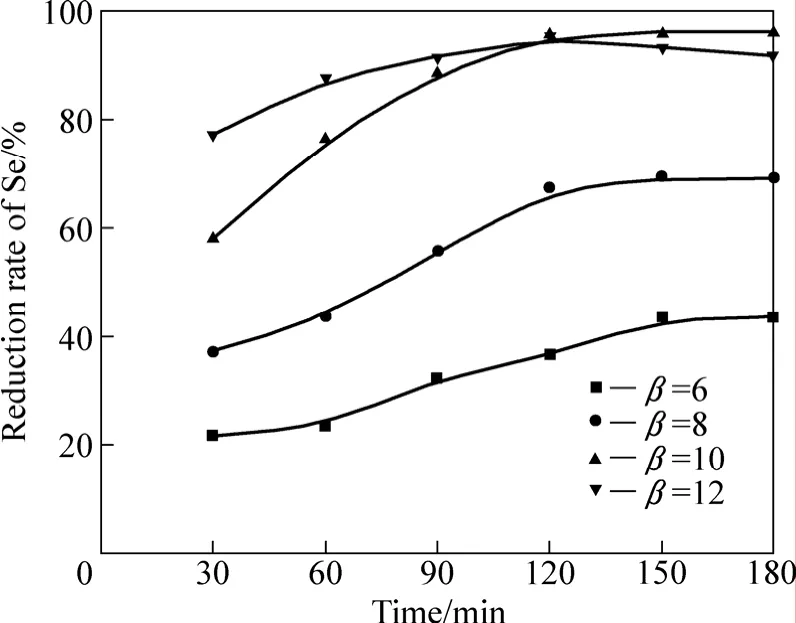
图3 β对硒还原率的影响Fig.3 Effect of β on reduction rate of Se
时,硒的还原率达到最大;当β增大到12,还原时间大于120 min后,硒的还原率呈现出缓慢降低的趋势。
这是由于随着亚硫酸钠加入量的增加,亚硫酸钠与酸反应产生的SO2气体对溶液的搅动变得越来越剧烈,提高了气、液传质效率和SO2气体在还原体系中的浓度,加速了H2SeO3与SO2的还原反应,使硒的还原率逐渐增加;随着加入亚硫酸钠质量的进一步增加,还原体系中的亚硫酸钠的质量浓度也急剧增加,由于硒可与亚硫酸钠的水溶液发生式(15)的反应生成

致使还原生成的少部分硒返溶进入溶液,从而导致硒的还原率呈现出缓慢降低的趋势。
3.3 还原时间对硒还原率的影响
还原实验的基本条件:β为10,还原温度80 ℃;搅拌速率350 r/min,还原酸度3 mol/L。在上述实验条件下,考察还原时间对硒还原率的影响,实验结果如图4所示。
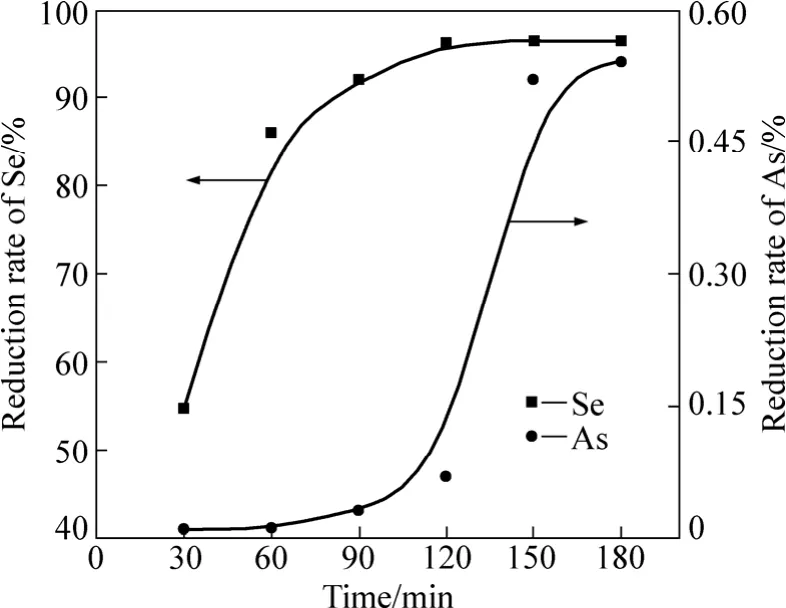
图4 还原时间对硒还原率的影响Fig.4 Effect of reaction time on reduction rate of Se
从图4可以看出,硒的还原率随反应时间的延长而不断增大,当还原时间达到120 min后,硒的还原反应基本完成,硒的还原率趋于稳定。图4中曲线表明:硒优先于砷被还原,当溶液中的H2SeO3基本被还原后,砷才开始被还原,这与前面的热力学分析结果一致。
3.4 搅拌速率对硒还原率的影响
还原实验的基本条件:β为10,还原温度80 ℃,还原时间120 min,还原酸度3 mol/L。在此实验条件下,考察搅拌速度对硒还原率的影响,实验结果如图5所示。
采用水蒸气蒸馏法提取黄丝郁金的挥发油,实验中考察了提取时间和料液比例,12.5倍水量并保持微沸5 h挥发油即可提取完全。在产区上,四川省乐山市的挥发油含量略高于其他产区,但也存在S12等个别含量较低的问题,表明不同产区黄丝郁金挥发油含量存在差异,相同产区也具有一定差异性,可能是受药材产地采收加工、包装储藏等因素影响。

图5 搅拌速度对硒还原率的影响Fig.5 Effect of stirring speed on reduction rate of Se
从图5可以看出,随着搅拌速度的加快,硒的还原率逐渐升高。当搅拌速度达到400 r/min后,继续加快搅拌速度对硒的还原率影响较小。其主要原因是当搅拌速度较小时,加入的亚硫酸钠与酸反应生成的SO2气体,不能尽快扩散到整个还原体系,只有在亚硫酸钠附近溶液中的 H2SeO3能与 SO2气体接触并发生还原反应,而远离亚硫酸钠的H2SeO3需要经过SO2的扩散、传质,彼此相互接触后,才能进行还原反应。搅拌能使亚硫酸钠很快均匀分散到整个还原体系,反应产生的SO2能迅速与H2SeO3接触反应,被还原后的溶液也能尽快从SO2浓度较高区域迁移走,因此,搅拌加快了气、液、固三相间的传质速度。
3.5 溶液的酸度对硒还原率的影响
还原实验的基本条件:β为10,还原温80 ℃,搅拌速率400 r/min,还原时间120 min。在上述试验条件下,考察酸度对硒还原率的影响,实验结果如图 6所示。
从图6可以看出,随着体系酸度的增加,硒的还原率逐渐增大;在相同酸度条件下,随着还原时间的延长,硒的还原率呈逐渐增大趋势。当体系中盐酸浓度为3.5 mol/L时,硒的还原率达到最大,对应的还原率为99.18%。这是由于当还原体系的酸度较小时,化学反应式(1)进行不完全,难以满足溶液中 H2SeO3全部被还原所需SO2的量,这与前面的热力学分析结果(用SO2作还原剂从溶液中还原金属,均在一定浓度的酸度下)一致。
3.6 还原硒粉的表征
3.6.1 还原硒粉的化学成分
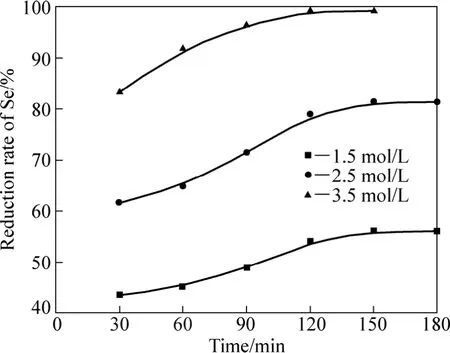
图6 酸度对硒还原率的影响Fig.6 Effect of acid concentration on reduction rate of Se

表3 综合条件下还原所得硒粉成分Table 3 Chemical composition of reducing selenium powder under general conditions(mass fraction, %)
从表3 可以看出,产品中硒的含量为99.684%,达到GB1477—79中Se—3的标准。硒粉中含有的Si和 Ca是还原时大气中沙尘进入产品所致;而含有的少量Cl和S,主要是还原过程中,体系中SO42−和Cl−浓度较高,SO42−和 Cl−被比表面积极大的硒粉吸附所致。
3.6.2 还原硒粉的XRD分析
在综合条件下得到的还原硒粉的 XRD谱如图 7所示。从图7可以看出,只出现了元素硒的特征谱线,与纯硒粉的标准谱线一致,未见有硒的化合物及其它物质的衍射峰出现,表明在实验确定的工艺条件下,还原所得硒粉纯度较高,这与前述热力学分析相吻合。3.6.3 还原硒粉的SEM−EDX分析
在最佳还原条件下,还原硒粉的SEM−EDX图如图8所示。从图8(a)可看出,硒粉微观形态较复杂,以不规则形状聚合体居多,球形体、棒状聚合体相对较少,其粒径在1~40 µm范围内。图8(b)所示为图8(a)中所选区域的EDX谱。从图8(b)可以看出,只有元素硒的特征谱线,未见其它元素的波峰,表明在实验条件下,采用亚硫酸钠还原所得硒粉品位较高。
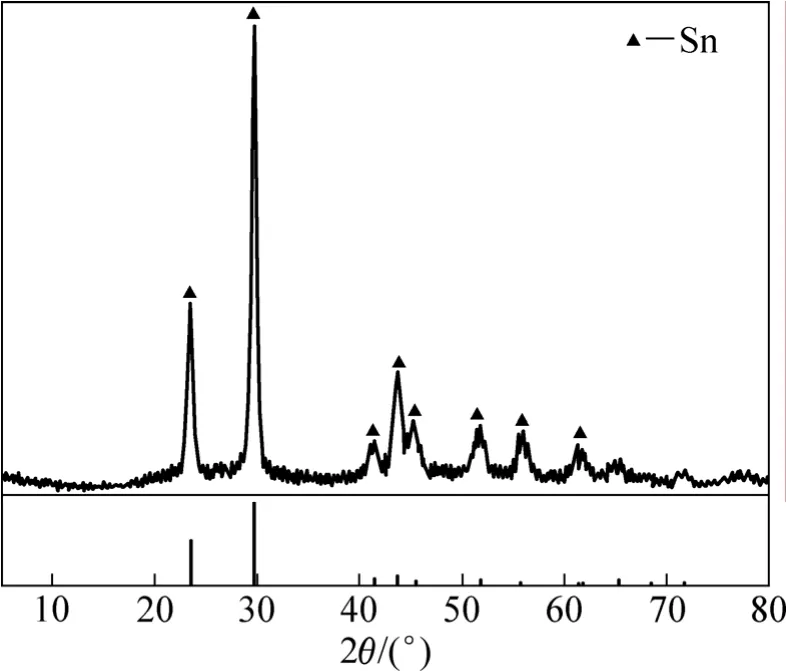
图7 还原硒粉的XRD谱Fig.7 XRD pattern of reduced powder
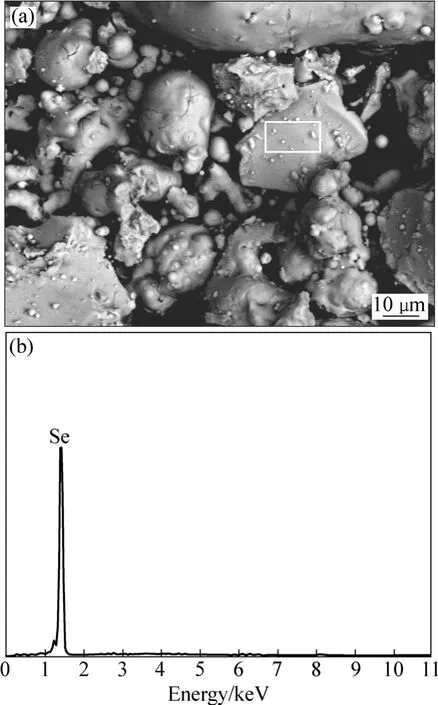
图8 还原硒粉的SEM像及所选择区域的EDX谱Fig.8 SEM image of reduced powder (a) and EDX pattern of selected zone (b)
4 结论
1) 分析了SO2在溶液中的存在形态,并对亚硫酸钠在强酸性水溶液中还原硒进行了热力学分析。热力学分析结果表明,在酸性介质中,采用亚硫酸钠能将溶液中的 H2SeO3基本上全部还原,而其它元素不被还原。
2) 通过实验研究验证热力学分析结果的正确性,并确定亚硫酸钠还原硒粉的较优技术条件:β10,还原温度80 ℃,还原酸度3.5 mol/L,搅拌速度400 r/min,还原时间120 min。
3) 通过实验研究,研制的硒粉品位为99.684%,硒的还原率为99.18%。
4) 研制的硒粉采用XRD和SEM−EDS分析结果表明,硒粉微观形态复杂,以不规则形状聚合体居多,球形体、棒状聚合体相对较少,其粒径在1~40 µm范围内;未见其它元素的特征谱线出现,表明还原所得硒粉品位较高。
REFERENCES
[1] 王志坚. 硫酸化焙烧处理镍钼矿的工艺研究[J]. 湖南有色金属, 2009, 25(2): 25−27.WANG Zhi-jian. Progress research on Ni-Mo ore by sulfate roasting[J]. Hunan Nonferrous Metals, 2009, 25(2): 25−27.
[2] 游先军, 戴塔根, 罗 卫, 彭学勤, 鲍振襄, 包觉敏. 湘西北黑色岩系中的镍钼矿床及其贵金属矿物特征[J]. 地质找矿论丛, 2009, 24(1): 15−22.YOU Xian-jun, DAI Ta-gen, LUO Wei, PENG Xue-qing, BAO Zhen-xiang, BAO Jue-min. Ni-Mo ore and mineral characteristics of its precious metals in the black rock series in the northwest of Hunan province[J]. Geological Prospecting Essays, 2009, 24(1): 15−22.
[3] 董允杰, 缪加坦. 我国镍钼矿及生产现状[J]. 中国钼业, 2008,32(2): 60−60.DONG Yun-jie, MIAO Jia-tuan. Ni-Mo ore and production status in China[J]. China Molybdenum Industry, 2008, 32(2):60−60.
[4] MALEKI N, SAFAVI A,DOROODMAND M M. Determination of selenium in water and soil by hydride generation atomic absorption spectrometry using solid reagents[J]. Talanta, 2005,66: 858−862.
[5] HUANG Shun-sheng, HUA Ming, FENG Jin-shun, ZHONG Xin-yong, JIN Yang, ZHU Bai-wan, LU Hua. Assessment of selenium pollution in agricultural soils in the Xuzhou District,Northwest Jiangsu, China[J]. Journal of Environmental Sciences,2009, 21: 481−487.
[6] OCHSENKUHN P M, MICHALKE B, KAVOURAS D,SCHRAMEL P. Selenium speciation analysis in a sediment using strong anion exchange and reversed phase chromatography coupled with inductively coupled plasma-mass spectrometry[J].Analytica Chimica Acta, 2003, 478: 219−227.
[7] MARIA M B, MARIA J D M, ELISA B G, ALFREDO S M.Evaluation of different sample extraction strategies for selenium determination in selenium-enriched plants (Allium sativum and Brassica juncea) and Se speciation by HPLC-ICP-MS[J].Talanta, 2006, 68: 1287−1293.
[8] ORSKOV L, FLYBJERG A. Selenium and human health[J].Lancet, 2000, 356: 942−943.
[9] 王大鹏. 硒与人体健康及其分析方法[J]. 世界元素医学, 2008,15(4): 44−46.WANG Da-peng. Selenium and human health and the analytical methods[J]. World Elemental Medicine, 2008, 15(4): 44−46.
[10] LEMLY A D. Environmental implications of excessive selenium:A review[J]. Biomedical and Environmental Sciences, 1997, 10:415−435.
[11] 周令治, 陈少纯. 稀散金属提取冶金[M]. 北京: 冶金工业出版社, 2008: 285−292.ZHOU Ling-zhi, CHEN Shao-chun. Scattered metal extraction metallurgy[M]. Beijing: Metallurgical Industry Press, 2008:285−292.
[12] 李洪桂. 湿法冶金学[M]. 长沙: 中南大学出版社, 2002:474−475.LI Hong-gui. Hydrometallurgical[M]. Changsha: Central South University Press, 2002: 474−475.
[13] 钟竹前, 梅光贵. 化学位图在湿法冶金和废水净化中的应用[M]. 长沙: 中南工业大学出版社, 1986.ZHONG Zhu-qian, MEI Guang-gui. Application of diagrams of chemical potential in hydrometallurgy and purification of waste water[M]. Changsha: Central South University of Technology Press, 1986.
[14] 周令治. 稀散金属手册[M]. 长沙: 中南工业大学出版社,1993: 372−374.ZHOU Ling-zhi. Handbook of scattered metals[M]. Changsha:Central South University of Technology Press, 1993: 372−374.
[15] KIRK R E, OTHMER D F. Encyclopedia of chemical technology[M]. 3rd ed. New York: John Wiley & Son, 1983:604−620.
Thermodynamics and application of selenium reduction from leaching solution of smelting dust of Ni-Mo ore
HOU Xiao-chuan1,2, XIAO Lian-sheng1, GAO Cong-jie1, ZHANG Qi-xiu1, ZHANG Gui-qing1, CAO Zuo-ying1, LI Qing-gang1
(1. School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China;2. Jinchuan Nonferrous Metals Corporation, Jinchang 737100, China)
The chemistry of sulphur dioxide in solution and the thermodynamics of selenium reduction using sodium sulphite from acidic solution were analyzed. The experiment results demonstrate the thermodynamic analysis. The optimum technological parameters were determined for reducing selenium by sodium sulfite. The reduction of selenium reaches 99.18%, and the grade of selenium powder reaches up 99.684% under the optimum conditions of acidity of 3.5 mol/L with stirring speed of 400 r/min at the reductive temperature of 80 ℃ for 120 min and the coefficient β (the mass ratio of sodium sulphite to selenium) of 10. The XRD and SEM-EDS analysis results show that the microcosmic morphology of powdered-selenium is complex, only the characteristic spectrum of elemental selenium is observed, which proves that the product of selenium powder is very pure.
selenium; sodium sulfite; reduction; thermodynamics; application
TF843.5
A
1004-0609(2010)12-2431-07
国家高技术研究发展计划资助项目(2007AA06Z129)
2009-12-17;
2010-03-11
肖连生,教授;电话:13975894859;E-mail:xls1211@sina.com
(编辑 李艳红)

