Taq Man探针荧光定量RT-PCR对牛精液中牛病毒性腹泻病毒检测方法的建立
季新成,段晓东,刘 菲,刘小兰,于学辉,曾新强
(新疆出入境检验检疫局,新疆乌鲁木齐830063)
牛病毒性腹泻(bovine viral diarrhea,BVD),又称黏膜病,是由牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)引起牛的一种病毒性传染病,该病世界范围内广泛分布,给养牛业造成了巨大的经济损失,牛精液中可携带BVD病毒,其在人工授精技术中的广泛应用是将该病毒传播给未感染牛群及地区的重要途径[1-2]。进口牛精液是国内引进优良品种的重要途径之一,随着国际贸易的频繁及人工繁殖技术的不断发展,我国进口牛精液的数量将不断增多,进一步加大了该病的传播风险,所以对牛精液中该病毒的检测对于防止该病的传播尤为重要。对于牛精液中BVDV的检测,RT-PCR方法具有快速、灵敏、特异性强等优点,但精液及其冻存液中抑制RT-PCR扩增成分的存在,导致检测灵敏度偏低,或操作程序复杂[3]。本研究对新鲜牛精液和牛精液冻存液中抑制 RT-PCR扩增的因素进行了分析,并对该成分的去除方法进行了研究,通过核酸提取和反应条件的优化建立了牛精液中BVDV荧光定量RT-PCR快速检测方法。
1 材料与方法
1.1 病毒、样品和菌种 BVDV C24V弱毒株购自中国兽医药品监察所,由新疆出入境检验检疫局技术中心传代保存,测得毒价为10-5.5TCID50/50μL,牛精液、全血、血清等样品采自新疆种牛场。
1.2 主要仪器与试剂 高速冷冻离心机、ABI7300荧光PCR仪;Trizol(invitrogen),M-MULV反转录酶、Taq DNA聚合酶、RNA酶抑制剂为 Promega(上海)产品,引物、Taq Man探针等均为宝生物工程(大连)有限公司产品。
1.3 引物、探针的设计与合成 利用Primer 2.0引物、探针设计软件,根据标准毒株NADL5′UTR保守区设计特异性引物Bp1和Br1,序列分别为:5′-GTGGTGAGTTCGTTGGATGG-3′和 5′-CCGCTCAGGTTAAGATGTG C-3′,探针 Bpro,序列为:5′-FAM-CGAACCACTGACGACTACCCTGTACTCA-TAMRA-3′。
1.4 病毒RNA的提取 细胞培养物、组织、血液等样品按Trizol试剂操作说明书进行。精液样品用Sephacryl S-400(Phamasia产品)凝胶过滤后提取(取600μL乙醇保存的Sephacryl S-400凝胶加入1 mL容积的凝胶过滤柱,用约3 mL p H值5.3的醋酸钠溶液洗涤后,加入200μL精液,1 000 r/min离心2 min,取100μL精液过滤液,加1 000μL Trizol提取核酸)。提取的核酸溶于40μL无RNA酶的去离子水中,置4℃2 h内使用。
1.5 荧光RT-PCR扩增条件的优化 采用矩阵法对反应体系中d NTP、Mg2+、引物、探针浓度和循环参数等进行优化。
1.6 方法的特异性、重复性检测 用该扩增体系分别对牛传染性鼻气管炎病毒(IBRV)、牛白血病病毒(BLV)、蓝舌病毒(BTV)、口蹄疫病毒(FMDV)、古典猪瘟病毒(CSFV)等核酸样品进行了扩增。对病毒含量为1 000 TCID50、100 TCID50和10TCID50的精液进行3次重复检测,对不同试验获得的Ct值标准差和变异系数进行分析。
1.7 方法的灵敏度检测
1.7.1 与病毒分离方法的比较 将病毒含量为105TCID50/50μL的BVD病毒液并分别用MEM、新鲜牛精液和牛冻存精液进行101~107系列稀释,取100μL用本研究建立的荧光定量RT-PCR方法检测。荧光 RT-PCR以出现S型扩增曲线,Ct<45,且阴性对照和空白对照均没有扩增曲线和Ct值作为阳性判定标准,将呈阳性反应的最高稀释度换算成TCID50单位,每个反应均做重复检测,计算Ct值的平均值。病毒分离用含2%胎牛血清的MEM将每一稀释度的精液再进行10倍系列稀释,同文献[4]进行检测,以出现细胞病变(CPE)的最高稀释倍数作为病毒分离检测的灵敏度。
1.7.2 与普通RT-PCR的比较 将上述系列稀释的病毒中提取的RNA用文献[5]的引物进行 MMULV一步法RT-PCR扩增,以呈阳性反应的最高稀释度作为检测灵敏度。
1.8 对临床样品的检测 对从同一牛场6个月内采集的120份牛新鲜精液和40份冻存牛精液(来源于85头公牛,部分为不同时间收集),用该方法进行病毒检测。并对上述精液按文献[4]用病毒分离法同步进行了病毒分离检测。
2 结果与分析
2.1 荧光 RT-PCR反应条件的优化 优化后的25μL反应体系中,Mg2+2.5 mmol/L,dNTP各0.2 mmol/L,上下游引物各 0.4 mmol/L,探针0.2 mmol/L,Taq酶1.25 U,M-MULV 100 U,RNAseinhibator 10 U,模板 10μL,扩增条件为 50℃,2 min;92℃,10 min;92℃10 s,60℃30 s,45个循环。
2.2 方法的特异性和重复性 用该扩增体系对IBRV、BLV、BTV、FMDV、CSFV 核酸样品检测均为阴性。对病毒含量为1 000 TCID50、100 TCID50和10TCID50的精液进行3次重复检测,不同试验获得的Ct值变异系数为1.63~2.24,表明该方法具有很好的特异性和重复性。
2.3 方法的检测灵敏度比较 对用不同成分系列稀释后的病毒进行检测,结果表明,该荧光RT-PCR方法可检测到新鲜精液和冻存精液中106稀释梯度的病毒,相当于 0.0125 TCID50的病毒,仅比用MEM稀释后的检测灵敏度低10倍。病毒分离对上述3种成分稀释后的病毒分别检测到105、103和104的稀释梯度,换算后分别相当于0.25 TCID50、25TCID50和2.5 TCID50的病毒,结果见表1。
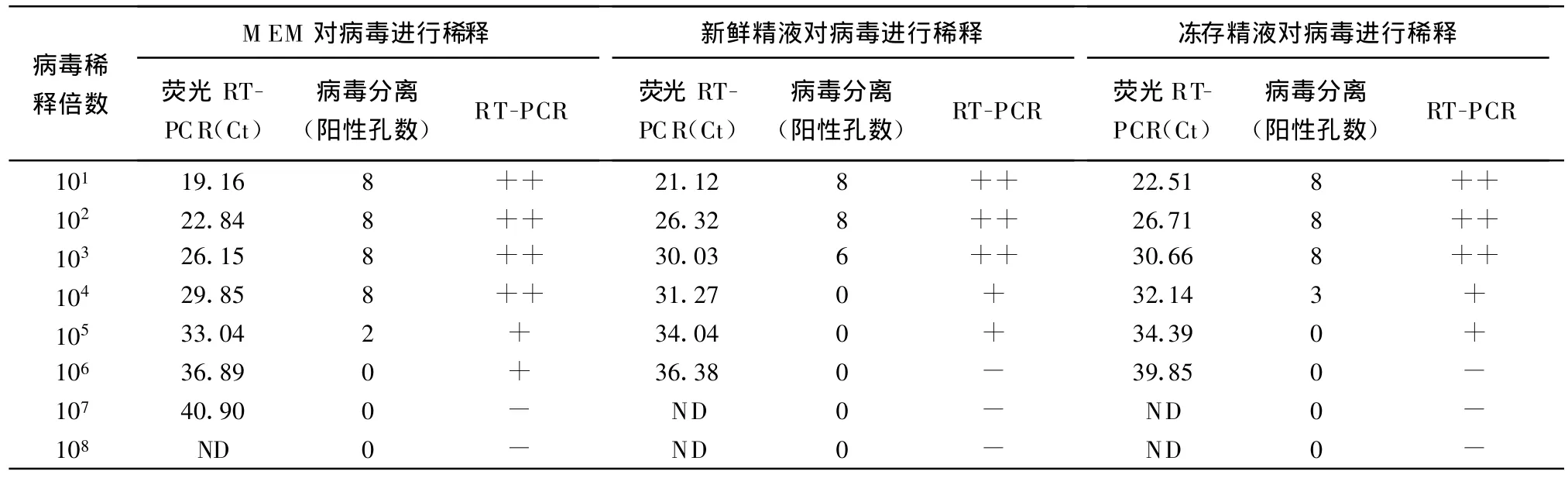
表1 荧光RT-PCR和病毒分离法对新鲜精液和冻存精液检测比较
2.4 对精液样品的检测 对120份牛新鲜精液和40份冻存牛精液用该荧光RT-PCR没有检测到阳性样品,用病毒分离法也没有检测到阳性样品。
3 讨论
关于采用荧光 RT-PCR方法对牛精液中BVDV的检测,国内外尚未见报道。鉴于牛精液及其冻存精液中抑制荧光RT-PCR扩增成分的存在,本研究在采集新鲜牛精液降温延伸后,向其中添加已知量的病毒,作为测试样品,用卵黄、甘油、果糖、青霉素/链霉素配制精液冻存液,用分别去除了上述成分之一的冻存精液和已知BVDV阴性的新鲜牛精液按1∶6对病毒进行稀释,用Trizol提取病毒核酸后进行扩增,发现新鲜牛精液本身对荧光 RTPCR扩增具有抑制性,冻存精液中的卵黄是抑制荧光RT-PCR扩增的主要成分,因卵黄中过多蛋白成分的存在,抑制了DNA聚合酶的活性,经Sephycral S-400凝胶对精液过滤处理,去除了卵黄中特异性抑制因子。经Sephycral S-400凝胶过滤处理后的精液用 TRIzol提取病毒核酸,针对BVDV 5′UTR保守区基因序列设计特异性引物和荧光探针,通过反应条件的优化,建立了从牛精液中直接检测BVDV的荧光RT-PCR方法。结果表明,该方法具有较好的敏感性、特异性和可重复性,且操作简单。Givens M D等[6]用RT-nPCR方法检测自然感染牛精液中的病毒,其结果与Da Silva N[7]等人工向精液中添加病毒的检测效果一致。向已知阴性的精液中添加已知量的病毒,可精确定量,便于检测灵敏度的确定。
据报道,有些持续性感染牛不产生血清抗体,但从公牛精液中可分离到病毒,病毒在公牛生殖道复制,污染精液但逃避抗体检测[1-2],有些牛血清病毒抗体呈现阳性后,中和了精液中的病毒,用病毒分离方法不能分离到病毒,但用RT-nPCR方法可检测到病毒核酸[8-9]。本研究用该荧光RT-PCR方法对120份新鲜牛精液和40份冻存牛精液检测,均没有检测到阳性样品,有报道表明,BVDV持续感染但非病毒血症牛或BVDV急性感染牛精液中可分泌病毒[1],但精液中能否检测到病毒还可能与病毒在睾丸中的特定循环路径、病毒暴露特性、初次感染病毒时牛的年龄、机体的免疫耐受以及稳定的血睾屏障等因素有关[6],我们对所检测的公牛同步进行了BVDV血清抗体检测,基本都呈现抗体阳性,是否也可以表明,BVDV血清抗体阳性牛精液中不携带病毒,该研究还有待于进一步确证。
[1] Houe H.Epidemiological features and economical importance of bovine virus diarrhoea virus(BVDV)infections[J].Vet Microbiol,1999,64:135-144.
[2] Kirkland P D,Richards SG,Rothwell J T,et al.Replication of bovine viral diarrhoea virus in the bovine rep roductive tract and excretion of virusin semen during acute and chronic infections[J].Vet Rec,1991,128:587-590.
[3] Reddy E S P,Das M R,Reddy E P,et al.Inhibition of reverse transcriptases(E.C.2.7.7.49)by seminal plasmin[J].Biochem J,1983,209:183-188.
[4] OIE.BOVINE VIRAL DIARRHOEA[M]//Manual of diagnostic tests and vaccines for terrestrial animal,2008:698-711.
[5] Weinstock D,Castro A E,Bhudevi B.Single-tube Single-Enzyme Reverse Transcrip tase PCR Assay for Detection of Bovine Viral Diarrhea Virus in Pooled Bovine Serum[J].J Clinical microbioloby,2001,343-346.
[6] Givens M D,Carson RL,Brock K V,et al.Analytical sensitivity of assays used for detection of bovine viral diarrhea virus in semen samples from the Southastern United States[J].Vet Microbiol,2003,96:145-155.
[7] Da Silva N,Zardoya R,Santurde G,et al.Rapid and sensitive detection of the bovine viral diarrhea virus genome in semen[J].J Virol Meth,1995,55:209-218.
[8] Kirkland P D,McGowan M R,Mackintosh S G,et al.Insemination of cattle with semen from a bull transiently infected with pestivirus[J].Vet Rec,1997,140:124-127.
[9] Givens M D,Heath A M,Brock K V,etal.Detection of bovine viral diarrhea virus in semen after infection of seronegative,postpubertal bulls[J].Am J Vet Res,2003,64:428-434.

