超声造影发现脂肪肝内肿瘤周围的相对正常肝区
刘利平,康春松,董宝玮,于晓玲 (山西医科大学第一临床医学院超声科,太原 03000;中国人民解放军总医院介入超声科)
脂肪肝内相对正常肝区(focal fatty sparing,FFS),有学者称之为“肝岛”、“假肿瘤”、“脂肪缺失区”,其形成可能与肝脏的“第三重血供有关”[1],一些变异的血管在生理和病理情况下可向肝内供血形成独特的血流动力学,常位于左叶内侧段和胆囊床旁,是FFS好发于左内叶及右前叶近胆囊床旁的原因[2,3]。脂肪肝内相对正常肝区的形成也可以由邻近肿瘤对血管的压迫及减少的门静脉血流等原因引起[4,5]。本文分析报道超声造影发现7个脂肪肝内肿瘤周围的相对正常肝区。
1 资料与方法
1.1 研究对象 收集2005-04~2009-10检查脂肪肝内相对正常肝区73例86个。其中5例7个为脂肪肝内肿瘤周围的相对正常肝区。患者均为男性,年龄范围34-57岁,平均(44±10)岁。右叶5个,左叶2个。常规超声肿瘤及其周围FFS的整体最大径2.6-6.0 cm,平均(3.7 ±1.3)cm。脂肪肝内肿瘤及其周围的FFS均经MRI化学位移成像(同-反相位)、平扫+增强MRI和/或CT检查并随访证实。
1.2 仪器与方法 Sequoia 512(Simence Acuson,美国),4V1探头,配有实时超声造影软件CPS(Contrast Pulse Sequences)。百胜Mylab90彩色超声诊断仪,CA431宽频凸阵探头。均为低机械指数连续实时超声造影成像,机械指数分别采用:1.3-1.4(Sequoia 512);0.7-0.8(Mylab90)。超声造影剂为Bracco生产的SonoVue。
造影前常规二维超声检查全肝,记录病灶的位置、形状、大小、边界及其结构特征。彩色及能量多普勒超声检查病灶及周边血流状态,然后将仪器条件换至造影条件,此时示波屏上不显示肝脏灰阶图像,只能接收来自造影剂微泡的二次谐波信号(即:使肝脏超声扫描区域在造影基础状态时回声一致)。为避免结节在造影过程中随呼吸而移动,采用双幅成像,一幅为造影成像,另一幅为灰阶成像。
迅速经肘前静脉团注造影剂2.4 ml/次,尾随5 ml生理盐水快速冲洗,推注造影剂同时启动造影成像时间记录器,进行低机械指数实时超声造影观察病灶增强特征,造影动态图像结果自动存储于仪器硬盘内,均可脱机或在机动态及逐帧回放并定量分析。
1.3 图像分析 由两位熟悉超声造影的超声医师仔细观察病灶与周围肝实质造影增强情况,记录其增强特点。
2 结果
7个病灶中5个为右前叶近肝表面,1个为左外叶下段近肝表面及边缘,1个为两个肿瘤之间。
2.1 脂肪肝内肿瘤及其周围FFS的常规超声特征只有1例血管瘤为偏高回声,其余肿瘤及周围FFSs均为低回声。6个肿瘤及其周围FFSs整体为楔形,另一个两肿瘤及其之间FFS整体为长形。常规超声4个血管瘤者均可见明确的动脉血流。1例3个转移癌为少血供肿瘤,因此常规超声未探测到动脉血流。
2.2 脂肪肝内肿瘤及其周围FFS的超声造影特征造影后病灶内部可见肿瘤回声,周边为FFS。4个为血管瘤伴FFSs,内部血管瘤为典型的超声造影表现,动脉早期11-14 s周边环状结节状增强逐渐向内填充,21-31 s后3个结节完全填充,延迟期均为高增强。另3个为转移癌伴FFS,肿瘤在动脉期21 s周边轻度环状增强,31 s周边增强部分低于周围肝实质,延迟期为“黑洞征”。超声造影后肿瘤大小远远小于常规超声发现的病灶大小。常规超声肿瘤及其周围FFSs的整体最大径为(3.7±1.3)cm;造影后肿瘤最大径为(2.1±0.8)cm。
2.3 常规超声及超声造影诊断情况 1个血管瘤为偏高回声者,常规超声可确定其内肿瘤伴前方的FFS可能;其余肿瘤及周围FFS均为低回声,只有2个转移癌者,常规超声认为其内伴肿瘤可能但并不能确定FFSs,其余不能区分病灶是否为占位性病变。超声造影均给予肿瘤类型及其周围FFS的诊断,见图1。
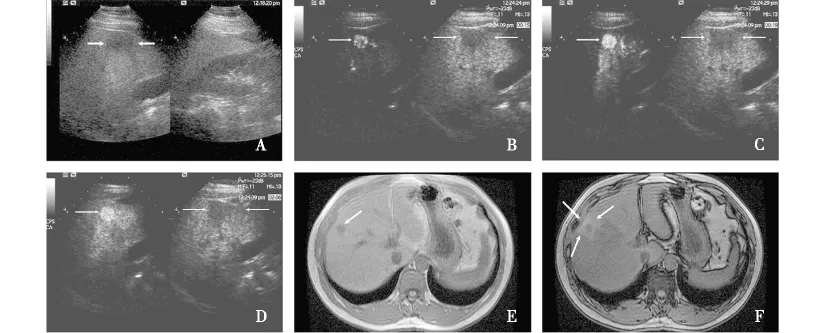
图1 超声造影发现脂肪肝内肿瘤周围的相对正常肝区Fig 1 Focal fatty sparings around tumor in fatty liver were found by contrast-enhanced ultrasound
3 讨论
肝脏血供75%来源于门静脉,大量脂肪或毒性物质流经门静脉可导致脂肪肝。有学者提出脂肪肝中FFS灶的形成,可能与肝脏的“第三重血供有关”。Yoshimitsu等[1]描述第三重血供是相对于肝脏的肝动脉和门静脉系统的双重血供而言,一些变异的血管在生理和病理情况下可向肝内供血而形成独特的血流动力学。腹部的一些不经门静脉系统而直接进入肝脏的静脉血管和肝周的动脉血管分支,其中变异的腹部静脉血管对肝脏的供血常位于左叶内侧段和胆囊床旁[2,3],是 FFS好发于左叶内侧段及胆囊床周边的原因,笔者前期应用彩色多普勒超声及超声造影微血管显像分析FFS的相关报道[6]。
脂肪肝肿瘤周围FFS,很可能是由于肿瘤压迫周围血管引起门静脉血流减少。结节周围的FFS可能是局灶性的、叶段性的,这依赖于肿瘤与周围门静脉的关系。Martí-Bonmatí等[4]应用 MRI 研究报道肿瘤周围的FFS较多见于转移癌(51.4%),很少见于原发性肝癌(1.9%),血管瘤周围也较多见(18.5%)。Unal等[7]报道超声及 MRI发现胰头癌肝转移在MRI增强时出现楔形增强。本组1例脂肪肝内多发转移癌,其中2处近肝表面的肿瘤周围及其与肝被膜之间的FFS,1处为肿瘤之间的FFS灶,另可见其他部位的肿瘤造影廓清的大小较常规超声所测的小,可能为肿瘤周围环绕的较小FFS。在本组转移癌中,常规超声并未探测到动脉血流,超声造影动脉期环状轻度增强,内部未见增强,并迅速廓清,为少血供肿瘤。转移癌周围FFS的形成,可能由于肿瘤的压迫、浸润或栓塞使邻近肿瘤的门静脉分支狭窄或闭塞;肿瘤的膨胀性生长,压迫肝实质结构,引起肝窦阻塞,减少肿瘤周围的门静脉血供。
本文报道7个肿瘤周围的FFS,其中4个为血管瘤周围的FFS,彩色超声探测到明显的动脉血管,超声造影动脉早期周边增强逐渐向内填充,3个于动脉期21-31 s迅速整体增强。在本组病例中血管瘤周围FFS的形成可能与肿瘤对肝实质的压迫以及该肿瘤有丰富动脉供血引起前方区域的门静脉血流相对减少有关。Kim等[5]报道在脂肪肝内各种肿瘤均可伴随肿瘤周边FFS的存在,但可能在常规超声为非典型的表现;他们比较MRI化学位移成像发现血管瘤周围的FFS,常规超声仅能发现其中的68%,MRI较常规超声更敏感。本文报道相对较大的FFS,更小的肿瘤周围的FFS可能超声不易觉察,需要精确测量常规超声及超声造影结节大小进行比较,并与MRI化学位移成像或CT密度值的对照研究。另外二维超声如发现脂肪肝内低回声区,尤其肝表面楔形低回声,常规超声容易误认为非占位性病变,要警惕低回声肿瘤伴周围相对正常肝区[8],因此有必要作进一步超声造影检查。
总之,脂肪肝内部分肿瘤周围的相对正常肝区(FFS),可以由邻近肿瘤对血管的压迫,恶性肿瘤的浸润或栓塞使邻近肿瘤的门静脉分支狭窄或闭塞,来自肠道的门静脉血供量相对减少;或本组血管瘤中局部动脉血供增多,门静脉血供相对减少,局部肝区的甘油三酯较少,因此形成脂肪肝内肿瘤周围的相对正常肝区(FFS)。
[1] Yoshimitsu K,Honda H,Kuroiwa T,et al.Unusual hemodynamics and pseudolesions of the noncirrhotic liver at CT[J].Radio Graphics,2001,21:S81-S96.
[2] Matsui O,Kadoya M,Takahash S,et al.Focal sparing of segmentⅣin fatty livers shown by sonography and CT:correlation with aberrant gastric venous drainage[J].Am J Roentgenol,1995,164(5):1137-1140.
[3] Tochio H,Kudo M,Okabe Y,et al.Association between a focal spared area in the fatty liver and intrahepatic efferent blood flow from the gallbladder wall:evaluation with color Doppler sonography[J].Am J Roentgenol,1999,172(5):1249-1253.
[4] Martí-Bonmatí L,Peñaloza F,Villarreal E,et al.Nonspecificity of the fat-sparing ring surrounding focal liver lesion at MR imaging[J].Acad Radiol,2005,12(12):1551-1556.
[5] Kim KW,Kim MJ,Lee SS,et al.Sparing of fatty infiltration around focal hepatic lesions in patients with hepatic steatosis:sonographic appearance with CT and MRI correlation[J].Am J Roentgenol,2008,190(4):1018-1027.
[6] Liu LP,Dong BW,Yu XL,et al.Analysis of focal spared areas in fatty liver using color Doppler imaging and contrast-enhanced microvessel display sonography[J].J Ultrasound Med,2008,27(3):387-394.
[7] Unal B,Bilgili Y,Kara S,et al.Transient arterial enhancement in a hepatic peritumoral fat-spared area[J].Diagn Interv Radiol,2005,11(3):159-162.
[8] Grossholz M,Terrier F,Rubbia L,et al.Focal sparing in the fatty liver as a sign of an adjacent pace-occupying[J].Am J Roentgenol,1998,171(5):1391-1395.

