幽门螺杆菌黏附素HpaA蛋白在大肠杆菌中表达及其免疫保护作用*
黄学勇,许汴利,段广才,范清堂,郗园林
2.郑州大学公共卫生学院流行病学教研室,郑州450001;
3.河南省分子医学重点学科开放实验室,郑州 450052
幽门螺杆菌(Helicobacter pylori,H.pylori)是上消化道疾病的主要致病菌,呈世界性流行危害严重〔1-2〕。发展疫苗是预防H.pylori感染最有效、最有前景的方法〔3〕。黏附素基因hpaA为H.pylori所特有,存在于所有菌株中,编码相对分子质量为30 000的蛋白质,是与宿主细胞特异性受体结合的亚单位,具有黏膜结合特性,并具有良好的抗原性和免疫原性〔4〕。本研究优化表达和纯化获得高纯度的HpaA重组蛋白,通过动物实验研究其抗原性和免疫保护效果,为研制H.pylori的疫苗提供材料。
1 材料与方法
1.1 菌种和实验动物 幽门螺杆菌黏附素hpaA基因表达工程菌 TB1(pMAL-c2X-hpaA)由本研究室构建并保种〔5〕,H.py lori标准株NCTC11637由中国疾病预防控制中心提供。实验动物:雄性昆明小鼠90只,8 w龄,体重16~20 g,由河南省实验动物中心提供,饲养控制条件为清洁级。UreB蛋白和佐剂mLT63本研究室制备保存。
1.2 HpaA重组蛋白诱导表达 取菌种TB1(pMAL-c2X-hpaA)划线涂布于含氨苄青霉素(100 μ g/mL)LB固体培养基上,37℃培养16 h。挑选单菌落,接种于5 mL含氨苄青霉素LB培养液试管中,37℃、200 r/min培养12 h,成为活化种子。以1%种量接种于200 mL LB培养液中,37℃、240 r/min摇床培养2 h(A600nmOD≈0.5),加入终浓度为0.3 mmol/L的诱导剂IPTG,继续培养诱导4 h。取1 mL菌液样品,8 000 g离心5 min,弃上清,加入 100μ L上样缓冲液,100℃水浴6 min,取10 μ L上清加样,进行凝胶电泳,考马斯亮蓝R250染色。
1.3 菌体的收获、超声破碎和蛋白纯化 将诱导 TB1(pMAL-c2X-hpaA)菌液200 mL分装,4℃,8 000 g离心20 min,弃上清,-20℃冻存过夜,PBS洗沉淀1次,收集菌液于1个离心管,重悬于 20 mL Coloun buffer中,冰水浴中超声破碎,500 Hz,超声10 s,间隔10 s,共30次,4℃8 000 g离心30 min,取超声上清通过Amyloss树脂预装柱纯化目的蛋白(按使用说明操作),紫外分光光度计和凝胶成像系统分析测定样品蛋白含量。
1.4 小鼠血清制备和ELISA检测重组蛋白免疫小鼠血清
纯化HpaA蛋白用生理盐水稀释成浓度为20 μ g/100 μ L,取1 mL稀释蛋白与 1mL弗氏完全佐剂混匀,进行超声乳化,制备初次免疫抗原;与1 mL弗氏不完全佐剂混匀制备加强免疫抗原。选择8 w龄的昆明小鼠10只,第1 w,每只小鼠背部皮下3点和腹腔1点注射初次免疫抗原200 μ L(约含融合蛋白20μ g),分别在第2~4 w以同样的免疫方式注射加强免疫抗原200 μ L各1次,末次免疫后1 w,摘眼球取血,分离血清,-20℃保存。同时各选择10只小鼠按上述免疫程序分别注射生理盐水和弗氏佐剂作为实验对照组。
包被缓冲液稀释纯化HpaA重组蛋白浓度约为0.5μ g/mL,包被96孔酶标板,4℃过夜,PBS洗涤 3次。每孔加封闭液200μ L,37℃封闭2 h,PBST洗涤3次。小鼠抗血清用封闭液1∶100稀释,PBS作为空白对照,每孔加100 μ L,37℃孵育2 h,洗涤3次。每孔加100μ L辣根过氧化物酶标记的羊抗鼠IgG(稀释度 1∶1 000)37℃孵育 1.5 h,洗涤3次。立即加入新鲜配制的底物液 200 μ L,室温反应15 min,加终止液50μL,酶标检测仪测定每孔的吸光度值(OD值)A450nm,空白孔调零。每个血清标本做2次,取平均值作为结果,同时检测生理盐水和弗氏佐剂实验对照。
1.5 重组蛋白Western blot鉴定 纯化样品进行SDSPAGE电泳后,凝胶和硝酸纤维素膜在转移缓冲液中浸泡15 min,于半干式电转印仪中20 V转印40 min。硝酸纤维素膜转入封闭液封闭后,与一抗(本研究制备小鼠HpaA免疫血清或H.pylori全菌免疫血清)反应2 h,洗膜后,与二抗(羊抗鼠抗体)反应1 h,DAB(二氨基联苯胺)显色,同时以正常小鼠血清为对照。
1.6 实验动物分组、免疫和攻击方案 60只实验小鼠,随机分成4组,每组 15只,A组(HpaA+mLT63组):经口灌胃 HpaA+mLT63 200 μL/只/次,含 HpaA 抗原 40 μ g,佐剂 10 μ g;B组(UreB+mLT63组):经口灌胃 UreB+mLT63 200 μ L/只/次,含 UreB 抗原 40μ g,佐剂 10 μ g;C 组(黏膜佐剂mLT63对照组):经口灌胃mLT63 200 μ L/只/次,含黏膜佐剂mLT63 10 μ g;D组(PBS对照组):经口灌胃 PBS 200 μ L/只/次。免疫接种前禁食12 h,禁水4 h,先用100 μ L/只3%NaHCO3灌胃中和胃酸,1 h后实验组和对照组分别按上述免疫方案,在实验开始的第0、7、14、21 d各灌胃免疫1次,灌胃后4 h解除禁食、禁水。在末次免疫后1 w,各组均用新鲜培养的H.py lori国际标准菌株NCTC11637进行攻击感染,每只小鼠经口灌胃H.pylori菌液200μ L,约含H.pylori菌体2×108CFU,间隔10 h,再攻击1次,末次攻击4 h后恢复食水。在攻击感染2 w后处死实验小鼠。
1.7 细菌的定植评价和统计学分析 在H.pylori攻击感染2 w后,处死小鼠,解剖取出胃体,沿胃大弯纵向切开,用生理盐水冲洗胃内容物,将胃组织沿胃小弯剪切成两份,一份放入10%福尔马林固定备组织学检查,另一份再分为3份,分别用于尿素酶试验、涂片Giemsa染色、H.pylori培养试验。应用SAS 9.13统计软件包对实验数据进行统计学分析。
2 结 果
2.1 HpaA重组蛋白的表达和纯化结果 将重组菌TB1(PMAL-c2X-hpaA)和对照菌TB1(PMAL-c2X)诱导后的粗提蛋白进行SDS-PAGE电泳,发现重组细菌在相对分子量71 500处出现一条特异蛋白带,正好是标签蛋白MBP(相对分子量42 500)与HpaA的相对分子量(29 000)的总和,与预期融合蛋白相对分子量相符。同时纯化样品10 μ L进行SDS-PAGE电泳,凝胶成像系统分析和紫外分光光度计测定样品蛋白浓度约为0.138 mg/mL,纯度大于90%,见图1。
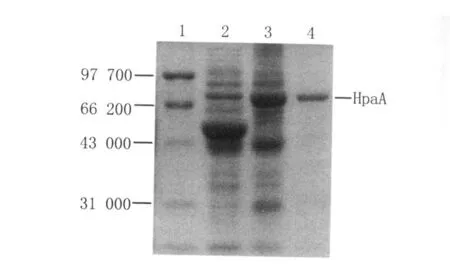
图1 TB1(pMAL-c2X-hpaA)诱导表达产物和纯化样品的SDS-PAGE分析1:低分子量蛋白标准;2:TB1(pMAL-c2X)表达产物;3:TB1(pMA L-c2X-hpaA)表达产物;4:纯化的 HpaA重组蛋白Fig.1 SDS-PAGE analysis of products of induced TB1(pMAL-c2X-hpaA) and identification of purified HpaA1:Lower protein molecular weight marker;2:TB1(pMAL-c2X)induced;3:TB1(pMAL-c2X-hpaA)induced;4:purified HpaA by amyloss pre-packed column.
2.2 ELISA法检测纯化重组蛋白免疫活性结果10只注射生理盐水小鼠血清OD值的平均值=0.2248)加3个标准差(s=0.0619)为判断临界值±3s=0.4105),即截断值(Cut-off值),高于此值为阳性,低于此值为阴性。生理盐水和弗氏佐剂作实验对照组中没有发现血清OD值大于0.4105实验小鼠,而HpaA纯化重组蛋白免疫组中10只实验小鼠血清OD值均大于0.4105,全部小鼠可以检测到免疫血清抗体,说明重组蛋白具有良好的免疫原性。
2.3 纯化目的蛋白Western blot结果 纯化目的蛋白样品进行SDS-PAGE电泳,半干式电转仪中将蛋白转移到NC膜上,以小鼠HpaA免疫血清(或H.pylori全菌免疫血清)为第一抗体(1∶50),羊抗鼠抗体为第二抗体(1∶2000),进行Western blot鉴定,结果显示:纯化蛋白在约71 500处产生特异杂交带,见图2。证实了纯化HpaA蛋白具有良好的免疫学活性。
2.4 病理组织学检查结果H.pylori攻击感染实验小鼠2 w后,病理组织学检查发现,在显微镜下,HE染色,对照组小鼠胃黏膜明显萎缩,黏膜上皮组织充血、水肿、连续性被破坏,黏膜上皮组织固有层及黏膜下层均有明显的炎性细胞浸润;Warthin-Starry硝酸银染色,对照组小鼠胃黏膜均有H.pylori定植,H.pylori菌体膨胀,着棕黑色,较容易发现。获得免疫保护小鼠胃黏膜的病理切片未见到炎症反应或炎症不明显和H.pylori定植,见图3。
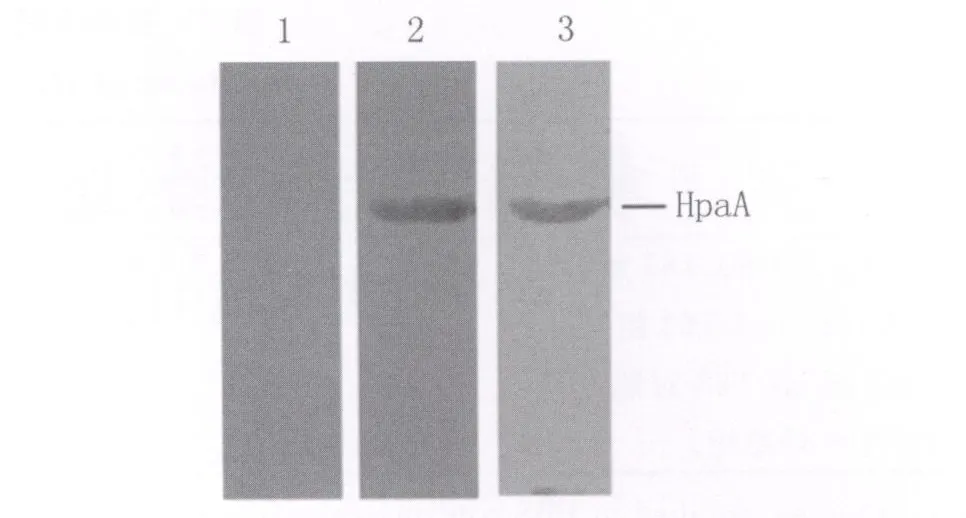
图2 HpaA与小鼠抗HpaA免疫血清、H.pylori全菌抗原免疫小鼠血清的Western blot反应1:纯化HpaA蛋白与正常小鼠血清;2:纯化 HpaA蛋白与HpaA免疫小鼠血清;3:纯化HpaA蛋白与 H.pylori全菌抗原免疫小鼠血清Fig.2 Western blot reaction of HpaA with sera of HpaA immunized mice and H.pylori whole-cell antigens immunized mice1:HpaA and sera of normal mice;2:HpaA and sera of HpaA immunized mice;3:HpaA and sera of H.pylori whole-cell antigens immunized mice.

图3 H.pylori攻击感染实验小鼠胃组织切片3.1:纯化 HpaA免疫小鼠胃黏膜切片HE染色(×200);3.2:PBS对照组小鼠胃黏膜切片HE染色(×200),黏膜上皮组织固有层及黏膜下层均有明显的炎性细胞浸润;3.3:纯化 HpaA免疫小鼠胃黏膜切片Warthin-Starry染色(×400);3.4:PBS对照组小鼠胃黏膜有明显炎性细胞浸润,胃粘膜胃小凹、黏膜上皮组织均可见 H.pylori定植(Warthin-Starry染色,×200)。Fig.3 Gastric histology in the mice post-challenge with H.pylori3.1:Gastric mucosa of mouse immunized with HpaA protein(HE stain,200);3.2:Gastric mucosa of PBS control mice after H.pylori infection,showing mild inflammation mainly in the deep mucosa and submucosal layer(HE stain,200);3.3:Gastric tissue of a mouse in HpaA+mLT63 immunized group(Warthin-Starry stain,400);3.4:One of the infected mice vaccinated with PBS showing mild inflammatory infiltration and H.pylori colonized within gastric crypts or on the epithelial surface(Warthin-Starry stain,400).
2.5 实验小鼠免疫保护结果 实验小鼠经免疫、攻击后,采用H.pylori培养、尿素酶试验、涂片Giemsa染色镜检、组织病理学鉴定4种方法检测小鼠胃组织内H.pylori定植情况。H.pylori定植阳性判定标准:4种检测方法中,有两种或两种以上阳性者即可判定为阳性感染,并以此来计算保护率〔6〕。Fisher's精确概率法分析显示:各组之间保护率差异有统计学意义(P<0.05),HpaA+mLT63抗原加佐剂组与mLT63佐剂组、PBS对照组间的差异有统计学意义(P<0.05),HpaA+mLT63抗原加佐剂组免疫保护率高于实验对照组,而与 UreB+mLT63实验组之间差异无统计学意义(P>0.05)。

表1 各组小鼠H.pylori的定植检测Table 1 Colonization of H.pylori in the mice of different groups
3 讨 论
H.pylori通常是胃黏膜组织的局部感染,其抗感染能力取决于粘膜免疫力,这决定了口服H.pylori疫苗是最有效的免疫途径。虽然单独口服保护性抗原也具有一定的免疫原性和免疫效应,但实验已证明辅以佐剂能增强免疫效果〔7〕。较理想的黏膜佐剂应该高效、安全,能激活黏膜免疫系统,在其存在的情况下抗原经黏膜供给可引发抗原特异性全身和黏膜的体液和细胞介导的免疫应答,同时能避免诱导黏膜耐受。目前,CT和LT两种肠毒素被认为是最有效的黏膜佐剂,但是它们的毒性限制了在人体的使用。利用基因工程构建的LT无毒衍生物突变体能够弥补这样的不足,LT第63位氨基酸突变,使丝氨酸改变为赖氨酸,使得 LTA失去NAD蛋白结合位点,经研究证实为无毒且具有较强的免疫原性和佐剂性。本研究免疫实验动物时,选用了在大肠杆菌中表达和纯化出大肠杆菌不耐热肠毒素无毒突变体mLT63融合蛋白作为免疫佐剂〔8〕。
国内外的一些研究表明,H.pylori黏附素中的一些蛋白成分具有良好的抗原活性,可诱导出很强的菌株特异性免疫反应,其中H.pylori黏附素A(H.pyloriadhesion A,HpaA)由hpaA基因编码,为细菌鞭毛鞘膜蛋白,几乎存在于所有临床分离H.pylori菌株的表面,是该菌的主要黏附因子,且氨基酸序列高度保守,动物实验已证明hpaA是H.pylori定植的必要因子〔9〕,基本符合理想保护性抗原的要求。用纯化的HpaA蛋白经背部皮下和腹腔注射免疫实验小鼠,ELISA、Westen blot方法检测和评价免疫小鼠血清中相应抗体,表明纯化蛋白具有良好的免疫原性和免疫反应性。采用纯化后的HpaA蛋白联合黏膜免疫佐剂mLT63灌胃免疫小鼠,H.py lori攻击感染后,评价免疫保护效果。研究结果发现抗原免疫实验组之间保护率差异不具有统计学意义,提示HpaA和传统的UreB抗原免疫保护效果相当,均高于实验对照组,差异具有统计学意义。HpaA蛋白能够显著减少H.pylori在小鼠胃内的定植,产生了一定的免疫保护性,为研究幽门螺杆菌疫苗筛选免疫保护性蛋白提供了有意义的依据。
〔1〕胡伏莲.中国幽门螺杆菌耐药研究现状〔J〕.胃肠病学和肝病学杂志,2008,17(7):517-518.
〔2〕Ohata H,Kitauchi S,Yoshimura N,et al.Progression of chronic atrophic gastritis associated withHelicobacter py loriinfection increases risk of gastric cancer〔J〕.Int J Cancer,2004,109(1):138-143.
〔3〕李晶,张建中.幽门螺杆菌黏附素及受体研究与疫苗发展〔J〕.中国人兽共患病学报,2006,22(6):580-582.
〔4〕Carlsonhn E,Ny strom J,Bolin I,et al.HpaA is essential forHelicobacter py loricolonization in mice〔J〕.Infect Immun,2006,74(2):920-926.
〔5〕黄学勇,段广才,范清堂,等.幽门螺杆菌基因hpaA克隆、融合表达和鉴定〔J〕.中国人兽共患病学报,2007,23(3):274-277.
〔6〕张荣光,段广才,范清堂,等.幽门螺杆菌感染的昆明小鼠模型的建立〔J〕.中华医学杂志,2006,86(12):857-859.
〔7〕Ghiara P,Rossi M,Marcheletti M,et al.Therapeutic intragastric vaccination againstHelicobacter py loriin mice eradicates anotherwise chronic infection and coinfers protection against reinfection〔J〕.Infect Immun,1997,65(12):4996-5002.
〔8〕白雪飞,郗园林,段广才,等.大肠杆菌不耐热肠毒素(LT)无毒突变体mLT 63在大肠杆菌中的融合表达及纯化〔J〕.中国人兽共患病学报,2006,22(9):821-824.
〔9〕Lundstrom AM,Blom K,Sundaeus V,et al.HpaA shows variable surface localization but the gene expression is similar differentHelicobacter pyloristrains〔J〕.Microb Pathog,2001,31(5):243-253.

