鸡朊蛋白序列分析及结构特征探究*
2.中国农业科学院兰州兽医研究所/家畜疫病病原生物学国家重点实验室,兰州 730046
朊蛋白(Prion protein,PrP)是由宿主常染色体上单拷贝基因的单个外显子编码的一种高度保守的细胞膜糖蛋白。“唯蛋白”假说(protein only)认为传染性海绵状脑病(TSE)的致病因子是由动物体PrP基因编码的细胞型朊蛋白(PrPC)凭借其部分α螺旋重新折叠成β-片层而转变成致病型的PrPSc组成的〔1〕。但至今关于PrP三级结构转换机理和构象病的产生机制仍不清楚。鸡是最早发现的含有PrP基因的鸟类〔2〕,然而关于鸡(Ch)PrP序列及结构的相关研究很少。因此,本研究通过对罗曼鸡PrP基因克隆测序,对所得的ChPrP基因序列和其它物种PrP基因比对分析,获得基于PrP基因的物种遗传信息,进而推导朊蛋白病种间屏障的形成机制。并参考已有的关于ChPrP高级结构的核磁共振(NMR)数据,利用生物信息学软件对ChPrP基因推导的氨基酸序列深入分析,获得ChPrP结构特征,推测可能参与构象转变的结构区域。进一步通过和哺乳动物(人)PrP高级结构相比较,分析其差异性,推测鸟类不感染朊蛋白病的结构基础。
1 材料与方法
1.1 血样 无菌采取8只健康罗曼鸡的新鲜血液,以抗凝剂抗凝。
1.2 试剂 基因组DNA提取试剂盒(Genome DNA Extraction Kit),EX Taq DNA聚合酶,DNA凝胶回收试剂盒(Agarose Gel DNA Purification Kit Ver.2.0),pMD18-T Vector。
1.3 引物的设计和合成 利用Primer Premier 5.0软件,根据已报道的鸡PrP基因cDNA及基因组序列,针对该基因开放阅读框(ORF)上游、下游保守序列设计两对特异引物。引物由Invitrogen公司合成。上游引物 F2 5′-CAAAAGCGAGGACAAGGAAC-3′下游引物 R2 5′-GCTGGGGTCAAGGCTACAAC-3′上游引物 F1 5′-GATGCT TGATTTCGGTGGAA-3′下游引物 R1 5′-CGTGCTTGAAGTTGGTTTTGT-3′
1.4 总DNA的提取 全血DNA提取按TIANGEN公司基因组提取试剂盒方法进行。
1.5 朊蛋白基因的PCR扩增 反应体系50μ L,其中总 DNA 4.0μ L 、EX TaqDNA 聚合酶 25μ L 、引物(10 pmol/L)各 2.4 μ L、加灭菌蒸馏水至 50μ L。反应条件,第一步,94℃5 min;第二步,94℃45 s,58℃/56℃45 s,72℃45 s,共进行35个循环;第三步,72℃8 min。
1.6 目的基因克隆 PCR产物的电泳检测和回收PCR产物经1.5%琼脂糖凝胶电泳后,参照标准DNA Marker进行扩增DNA片段大小判定,如与预计目的DNA片段大小一致,则以DNA凝胶回收试剂盒回收目的 DNA片段。按 TaKaRa公司的pMD18-T Vector和E.coliDH5αCompetent Cell使用说明进行目的DNA片段的连接和转化,划线接种在含有氨苄青霉素(Amp)的LB琼脂平板上培养后,挑选白色菌落并接种在 LB液体培养基中培养。
1.7 重组质粒的测序 由大连宝生物工程有限公司完成。
1.8 序列及结构分析利用各种生物信息学软件进行序列分析及结构预测。
2 结 果
2.1 PrP基因的PCR扩增 以8只罗曼鸡全血DNA为模板,设计两对特异性引物进行PCR扩增,经琼脂糖凝胶电泳检测获得两组分别约482bp和621bp的预期片段见图1。
图1 ChPrP基因的PCR扩增产物电泳1-8:PCR 产物 ;M :DNA marker DL2000Fig.1 Electrophoresis of PCR-amplified products1-8:PCR products;M :DNA marker DL2000
2.2 PrP基因测序结果及分析 通过对两组测序结果拼接获得1015 bp的片段,包含了ChPrP基因的完整编码区及部分内含子序列。序列分析表明8只罗曼鸡PrP基因ORF有两处发生碱基置换(243C→T,296A→G),其中243位点为同义码替换。通过在线 BLAST(NW_001471575)发现ChPrP基因位于鸡的第22号染色体。
2.3 鸡朊蛋白高级结构预测
2.3.1 一级结构和理化性质 应用ProtParam、TMpred、TMHMM等工具分析ChPrP基因推导氨基酸序列表明,ChPrP多肽由273个氨基酸组成,相对分子质量为29 948.7,理论 PI值为 9.05,正电荷占较高组分,总平均亲水性为-0.573。8只罗曼鸡PrP多肽N-端均有7个富含Pro的六肽重复PHNPGY/PQNPGY,并在99位点发现Q→R突变见图2。
2.3.2 鸡朊蛋白二级结构和三级结构特征 应用PredictProtein工具分析显示:ChPrP二级结构由34.1%的螺旋,8.8%的折叠及57.1%的无规卷曲组成。N-端约100个残基形成无规则区域,C-端形成保守的球状结构域。N-糖基化位点位于194,209和218位点。191,238位点的氨基酸残基可形成二硫键稳定构象。位于99位点的Q→R突变对ChPrP二级结构无明显影响见图3。

应用SWISS-MODEL/SWISS-PdbView等工具,按照同源建模法构建出ChPrP和人(Hu)PrP C-端约 100个残基的区域(图 4),如图显示ChPrPC-端是由3个α-螺旋(157-167,185-200,219-246)和2个短的反向平行β-折叠(142-144,174-176)组成的球状结构域;HuPrP C-端亦由3个α-螺旋(144-152,173-189,195-223)和2个短的反向平行β-折叠(129-131,161-163)组成,且二者二级结构组成元件相似。

图4 ChPrP和HuPrP三级结构模拟图Fig.4 The simulated three-dimensional structures of ChPrP and HuPrP
3 讨 论
3.1 PrP基因进化关系与朊蛋白病种间屏障的形成PrP基因作为一个古老而保守的基因广泛存在于各种生物体中。构建基于PrP基因的系统进化树见图5,分析显示ChPrP基因同其他禽类PrP基因进化关系较近,与两栖、爬行类位于同一进化分支,同源程度较高,而与哺乳动物处于不同的进化分支,进化关系较远,基于PrP基因的进化关系与物种亲缘关系相符。研究发现,朊蛋白病发生的一个重要表现是具有种间屏障现象,应用嵌合朊蛋白转基因老鼠实验证实,受体和供体物种同源程度高低决定着朊蛋白病的种间屏障〔3〕。但是朊蛋白病作为一种构象疾病,单纯的氨基酸序列同源程度高低并不能完全决定其种间屏障的产生,例如:人PrP基因同牛、羊PrP基因同源程度相近,已发现多例因食用患病牛而感染TSE的病例,而羊瘙痒病存在已久,却未发现一例因食用病羊而感染 TSE的病例。通过NM R分析发现,人PrP高级结构与朊蛋白病抗性羊(ARR)PrP构象相似〔4〕,据此认为 PrP构象同源性高低在一定程度上决定着该病种间屏障的产生。而PrP构象主要是由C-端保守的球状结构域决定的,位于球状结构域末端的高变区可能是“蛋白X”的特异性结合表位,“蛋白X”作为分子伴侣介导PrPC转变为 PrPSc,进而影响 PrP种间屏障的形成〔5〕。另外,PrP表面电荷分布的不同,可作为重要的构象特征影响种间屏障的产生〔6〕。总之,朊蛋白病种间屏障的产生不仅仅是由物种同源程度或PrP基因序列同源性高低来决定,其构象同源程度和稳定性,以及与构象形成相关的一些辅助因子起关键作用。
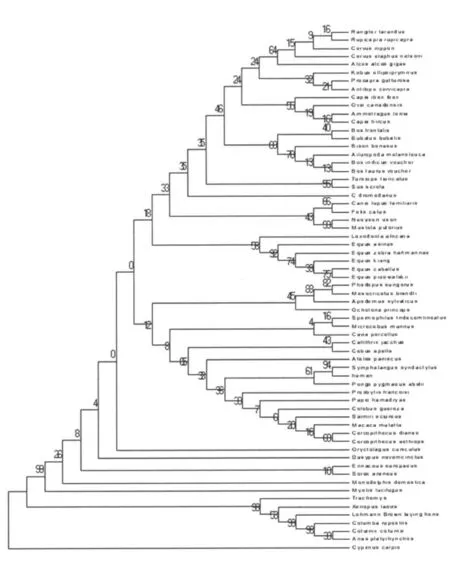
图5 68个物种的PrP基因推导氨基酸序列系统进化树Fig.5 Phylogenetic tree for PrP amimo acid sequence of 68 species of animal
3.2 ChPrP高级结构特征以及与构象转变的关系朊蛋白病作为一种致死性的构象疾病,确定其致病机理的关键在于了解PrP的构象转变机制。尽管已知的大多数脊椎动物都含有PrP基因,但是朊蛋白病仅见于哺乳动物,尚未发现非哺乳动物PrP出现致病型构象。分析显示,哺乳动物PrP基因间相似程度在90%以上,ChPrP基因同哺乳动物相比只有30%相同〔7〕,然而ChPrP N-端六肽重复元件PHNPGY和HuPrP N-端八肽重复元件PHGGGWGQ在氨基酸组成上十分相似,二者主要由非极性氨基酸组成,均含有一个芳香族氨基酸和一个极性氨基酸。分析ChPrP和HuPrP高级结构模型发现,二者C-端分子构象相似,均为由2个短的反向平行β-折叠和3个α-螺旋组成的结构域,且组成的二级结构元件长度及位置基本相同,ChPrP C-端192,237位点的半胱氨酸残基能够形成二硫键,连接α 2和α 3以稳定其球状结构域构象,与NMR结果相同〔8〕,而HuPrP模型C-端构象与NMR结果不同〔9〕,其179,214位点的半胱氨酸残基未形成二硫键,C-端结构域较为松散。据此推想至今未发现ChPrP致病型结构可能是由于ChPrP形成的构象更加稳定,不易发生变化。然而应用MD分析Hu-PrP和ChPrP结构稳定性发现,从整个分子来看,二者构象热稳定性并无显著差异〔10〕。显然PrP自身的稳定性并不能完全影响其构象变化,“蛋白X”、DNA、RNA、金属离子等辅助因子在PrP构象转变过程中发挥着重要作用〔11-12〕。通常“蛋白X”被认为是介导PrPC转变为PrPSc的分子伴侣,它能够结合PrP C-端高变区发挥作用〔13〕。而且与哺乳动物PrP构象不同,ChPrP N-端串联重复区形成稳定的环状构象,结合铜离子的能力明显弱于哺乳动物,甚至成熟的ChPrP不能结合铜离子,这一点有利于维持ChPrP构象稳定性〔14〕。除此之外,PrP构象还受到多种环境因素调控,研究发现温度、pH等的变化也会影响PrP构象的形成〔15〕,据此认为,PrP构象转变是由多种因素共同作用产生的,不同的环境可能造就不同构象的PrP,那么同一生物体内是否可能含有不同构象的PrP,有待进一步研究。
〔1〕Prusiner S B,Gabizon R,M cKinley M P.On the biology of prions〔J〕 .Acta Neuropathol(Berl),1987,72(4):299-314.
〔2〕Gabriel J M,Oesch B,Kretzschmar H,et al.Molecular cloning of a candidate chicken prion protein〔J〕.Proc Nati Acad Sci,1992,89(19):9097-9101.
〔3〕Scott M,Foster D,Mirenda C,et al.T ransgenic mice expressing hamster prion protein produce species-specific scrapie infectivity and amyloid plaques〔J〕.Cell,1989,59(5):847-857.
〔4〕Concepcion G P,David M P C,Padlan E A.Why don't humans get scrapie from eating sheep?A possible explanation based on secondary structure predictions〔 J〕.Medical Hy potheses,2005,64(5):919-924.
〔5〕Telling G C,Scott M,Mastrianni J,et al.Prion propagation in mice expressing human and chimeric PrP transgenes implicates the interaction of cellular PrP with another protein〔J〕.1995,Cell,83(1):79-90.
〔6〕Francisco L G,Zahn R,Riek R,et al.NMR structure of the bovine prion protein〔J〕.PNAS,2000,97(15):8334-39.
〔7〕 Wopfner F,WeidenhoG,Schneider R,et al.Analy sis of 27 Mammalian and 9 Avian PrPs Reveals High Conservation of Flexible Regions of the Prion Protein〔J〕.J Mol Biol,1999,289(5):1163-1178.
〔8〕Calzolai L,Dominikus A L,Daniel R,et al.Prion protein NMR structures of chickens,turtles,and frogs〔J〕.PNAS,2005,102(3):651-655.
〔9〕Zahn R,Liu A,Lu T,et al.NMR solution structure of the human prion protein〔J〕.PNAS,2000,97(1):145-150.
〔10〕Hong-Fang Ji,Hong-Yu Zhang.A comparative molecular dynamics study on thermostability of human and chicken prion proteins〔J〕.Biochemical and Biophysical Research Communications,2007,359(3):790-794.
〔11〕T elling GC,Scott M,Mastrianni J,et al.Prion propagation in mice expressing human and chimeric PrP transgenes implicates the interaction of cellular PrP with another protein〔J〕.Cell,1995,83(1):79-90.
〔12〕Deleault N,Lucassen R,Supattapone S.RNA molecules stimulate prion protein conversion〔J〕.Nature,2003,425(6959):717-720.
〔13〕Barnham K J,Cappai R,Beyreuther K,et al.Delineating common molecular mechanisms in Alzheimer's and prion diseases〔J〕.T rends Biochem Sci,2006,31(8):465-472.
〔14〕Edward M,Eisenberg D.Chicken prion tandem repeats form a stable,protease-resistant domain〔J〕.Biochemistry,1999,38(2):667-676.
〔15〕Ding F,Joshua J,LaRocque,et al.Direct observation of protein folding,aggregation,and a prion-like confo rmational conversion〔J〕.The journal of biological chemistry,2005,280:40235-40.

