呼吸道合胞病毒感染巨噬细胞活化Toll样受体3介导的抗病毒作用研究*
呼吸道合胞病毒(Respiratory syncytial virus,RSV)是单股负链RNA病毒,属副黏病毒科,肺炎病毒属,是世界范围内婴幼儿下呼吸道感染最常见的病原体〔1〕。自然感染率高,还可引起急性肺损伤和急性呼吸窘迫综合征。目前RSV感染的病理机制尚不明确,迄今无有效的治疗药物和理想的疫苗接种,抗病毒与抗炎症的联合治疗可能是临床治疗RSV感染有效的方案〔2〕。Toll样受体3(T oll-like receptor 3,TLR3)能特异性地识别病毒双股RNA而活化细胞,RSV在复制和转录过程中可产生大量双股RNA(double stranded RNA,dsRNA),因此能被TLR3识别而活化〔3〕。病毒感染时诱导产生的最重要抗炎细胞因子是干扰素(interferon,IFN),其重要性不但表现为抗病毒作用,还包括多种免疫调节作用,影响机体的天然免疫与获得性免疫。巨噬细胞是机体发挥抗病毒作用的重要免疫细胞,可通过分泌多种细胞因子,参与免疫调节。RSV融合蛋白(F蛋白)的抗原性比较稳定,很少变异,细胞免疫在对抗RSV感染中起主要作用,通过检测F蛋白含量,可反映 RSV的增殖状况〔4〕。本文探讨RSV 感染巨噬细胞时 TLR3活化介导的IFN产生机制及其抗病毒作用,为临床RSV感染的预防与治疗提供新的思路,目前在国内尚未见文献报道。
1 材料与方法
1.1 材料
1.1.1 病毒和细胞 呼吸道合胞病毒为国际标准株Long株,Hep-2细胞为人喉癌上皮细胞,均为安徽医科大学微生物学教研室保存;RAW264.7小鼠巨噬细胞由中国科学技术大学生命科学学院免疫学研究所魏海明教授惠赠。
1.1.2 主要试剂 DM EM培养基(美国Gibco公司产品),新生牛血清(杭州四季清公司产品),T rizol试剂(美国Invitrogen公司产品),逆转录试剂盒(美国 Fermentas公司产品),抗鼠T LR3抗体(美国Santa Cruz公司产品),其他试剂为市售分析纯。
1.2 方法
1.2.1 病毒感染量测定 将冻存的病毒株复苏后经Hep-2细胞增殖,按 Reed-Muench法计算病毒的半数感染量(TCID50)。
1.2.2细胞培养与实验分组 将RAW264.7细胞铺于24孔细胞培养板中,待细胞长至80%满时换细胞维持液,接种0.1mL病毒,置37℃、5%CO2培养箱中培养。实验分组为:感染组(RSV组);(TLR3抑制组(T LR3-+RSV组):参照文献〔5〕,并根据预实验的结果,置 37℃、5%CO2培养箱中,预先孵育于含浓度200 μ g/mL TLR3抗体的维持液中8 h后,以抑制T LR3受体,再行 RSV感染;(正常对照组。
每组设立4 h、8 h、12 h、16 h和24 h不同的感染时间点,每组重复4个复孔。以同等条件下培养的未感染病毒细胞为正常对照。
1.2.3 TLR3,IFN-α,IFN-β,RSV F的mRNA 水平检测以半定量 RT-PCR方法,检测各组 T LR3,IFN-α,IFN-β,RSV F的mRNA表达水平。小鼠各基因的引物序列和扩增片段长度见表1,各基因的PCR反应条件和循环次数见表2,以小鼠β-actin的 mRNA表达作为内参。用20g/L琼脂糖凝胶DNA电泳检测聚合酶链反应产物。凝胶成像分析仪扫描拍照,Labworks软件分析测定条带灰度值,用目的基因条带灰度值与β-actin条带灰度值的比值,作为目的基因相对表达量,进行统计学分析。

表1 小鼠各基因的引物序列和扩增片段大小Tab.1 The primer sequence and length for extended product of each mouse gene

表2 各基因PCR反应条件和循环次数Tab.2 The reaction conditions and cycle No.for polymerase chain reaction of each gene
2 结 果
2.1 病毒半数感染量滴定 病毒TCID50滴定结果为10-6.2/0.1mL。
2.2 T LR3 mRNA在各组不同时间点的表达:半定量RT-PCR测定结果显示,RAW264.7正常细胞T LR3表达基线很低,在 RSV组 TLR3 mRNA的表达上调且有时间依赖性。与正常对照组相比,RSV感染组 TLR3 mRNA的表达量逐渐增加,在感染4 h后T LR3 mRNA升高,升高有统计学差异,8 h显著升高,24 h达最高峰,是基础表达量的6倍多,升高均有有显著性差异,在T LR3-+RSV组,TLR3 mRNA的表达虽也上调,但较RSV感染组明显降低,都有显著性差异,见图1。

图1 RSV感染不同时间对RAW264.7细胞TLR3 mRNA表达的影响1:对照,2~ 6:分别为 4h,8h,12h,16h,24h.*:P<0.05,**:P<0.01 vs normal group;#:P<0.05,##:P<0.01 vs RSV group(n=4)Fig.1 The result of TLR3 mRNA expression in RAW264.7 macrophages infected with RSV by semiquantitative RT-PCR assay1 :control,2 :4h,3:8h,4 :12h,5 :16h,6:24h.

图2 RSV感染不同时间对RAW264.7细胞 IFN-αmRNA表达的RT-PCR结果1:对照,2~6:分别为 4h,8h,12h,16h,24h.*:P<0.05,**:P<0.01vs normal group;#:P<0.05 vs RSV group(n=4)Fig.2 The result of IFN-αmRNA expression in RAW264.7 macrophages infected with RSV at various time points by RT-PCR1:control,2 :4h,3 :8h,4:12h,5:16h,6:24h.
2.3 IFN-αmRNA在各组不同时间点的表达:RTPCR测定结果显示,正常组中IFN-αmRNA表达基线很低,在RSV组IFN-αmRNA的表达上调且有时间依赖性。与正常对照组相比,RSV组IFN-α mRNA的表达逐渐增加,在感染4 h后IFN-αmRNA升高,12 h后升高有显著性差异,24 h达最高峰,是基础表达量的4倍。在 TLR3-+RSV组,IFN-αmRNA的表达虽也上调,但较RSV感染组低,在感染16 h后IFN-αmRNA的降低有统计学差异,见图 2(IFN α/β-actin为各时间点相对应比值)。
2.4 IFN-β mRNA在各组不同时间点的表达RT-PCR测定结果显示,RAW264.7正常细胞组IFN-β mRNA的表达基线很低,在RSV组IFN-β mRNA的表达上调且有时间依赖性。与正常对照组相比,RSV组IFN-β mRNA的表达逐渐增加,在感染4 h后IFN-β mRNA升高,12 h显著升高,24 h达最高峰,是基础表达量的4倍多,升高有显著性差异。在TLR3-+RSV组,IFN-β mRNA的表达也上调,但较感染组低,在感染 12 h后 IFN-β mRNA的降低有统计学差异,24 h后降低有显著性差异,仅为RSV感染组表达量的一半,见图3(IFNβ/β-actin为各时间点相对应比值)。
2.5 RSV F基因mRNA在各组不同时间点的表达 RT-PCR结果显示,正常细胞无RSV F基因表达;RSV组F基因的mRNA表达上调且有时间依赖性,F基因的mRNA表达量逐渐增加;在TLR3-+RSV组,抑制T LR3的活化后,RSV F基因的mRNA表达明显升高,与相应时间点的 RSV感染组相比,12 h后升高有统计学差异,24 h升高有显著性差异,见图4。
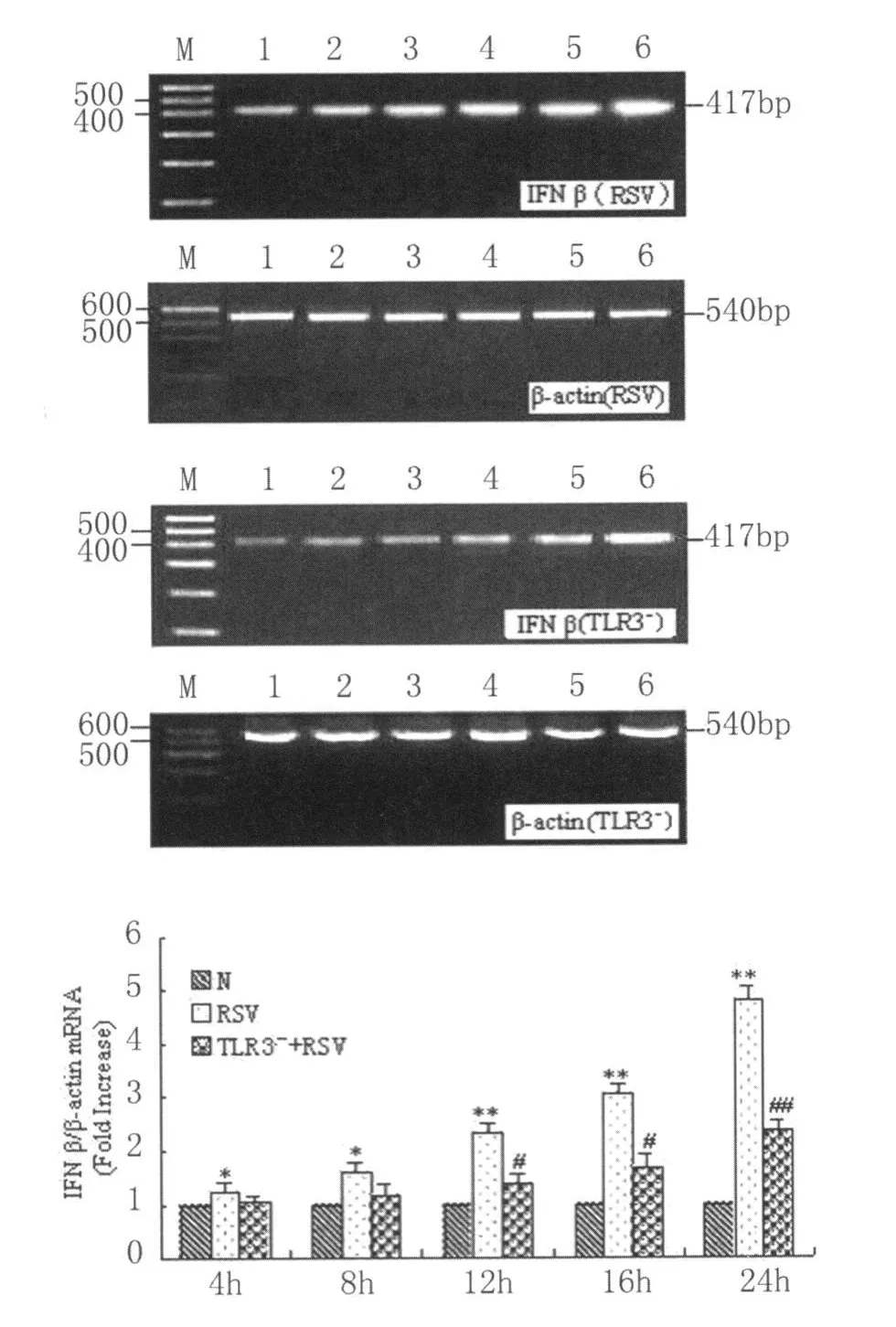
图3 RSV感染不同时间对RAW264.7细胞IFN-β mRNA表达的RT-PCR结果1.对照,2~6:分别为 4h,8h,12h,16h,24h.* :P<0.05,**:P<0.01vs normal group;#:P<0.05,##:P<0.01 vs RSV group(n=4)Fig.3 The result of IFN-β mRNA expression in RAW264.7 macrophages infected with RSV at various time point by RT-PCR1 :control,2 :4h,3:8h,4 :12h,5 :16h,6 :24h.

图4 RSV感染RAW264.7细胞不同时间对RSV F基因mRNA表达的RT-PCR结果1.对照,2~6:分别为 4h,8h,12h,16h,24h.*:P<0.05,**:P<0.01vs normal group(n=4)Fig.4 The result of RSV F gene mRNA expression in RAW264.7 macrophages infected with RSV at various time point by RT-PCR1:control,2 :4h,3:8h,4 :12h,5:16h,6:24h.
3 讨 论
呼吸道合胞病毒是婴幼儿下呼吸道感染最重要的病毒性病原体,病毒感染后可诱导宿主表达和产生大量的细胞因子、趋化因子、活性氧等生物活性递质〔6〕,使气道呈现高反应性,导致严重的细支气管炎、肺炎、哮喘等疾病。天然免疫系统的细胞可表达模式识别受体(patternrecognition receptors,PRR),Toll样受体即是一类PRR,是近年来发现的在抗病原微生物免疫防御反应中起重要作用的受体蛋白,能识别和启动不同病原体的相关模式分子(pathogen associated molecular patterns,PAMPs),介导先天性免疫和调节适应性免疫应答来抵御病毒的感染〔7〕。IFNα/β属Ⅰ型干扰素,是发挥早期抗病毒和免疫刺激活性的主要效应分子。RSV F蛋白是第一个被发现的为 TLR所识别的病毒性PAMP〔8〕,T LR3 是识别病毒 dsRNA 的受体 ,在抗病毒,阻止病毒复制,保护机体中起重要作用〔9〕。Levy等[〔10〕研究发现,机体对病毒感染的固有免疫应答至少有两条途径,第一条途径主要是病毒通过膜融合或胞吞等形式进入细胞,病毒核衣壳释放到被感染细胞的胞浆中,病毒在复制过程中产生dsRNA,最终激活NF-κ B和干扰素调节因子 3(IRF3),产生干扰素。第二个途径是被感染细胞释放出病毒dsRNA,与 TLR3结合激活NF-κ B 和IRF3,产生干扰素。RSV F蛋白为跨膜糖蛋白,参与病毒外膜与宿主细胞膜的融合及细胞培养过程中合胞体的形成,还具有促使RSV在感染细胞间传播及溶血的作用〔11〕。RSV在复制和转录过程中可产生大量的dsRNA,并且我们的实验已证实TLR3能识别RSV而被活化〔12〕。 Thompson 等〔13〕报道 T LR3能直接赋予机体天然抗病毒感染能力,MacDonald等〔14〕也报道TLR3能够诱导针对单纯性疱疹病毒的固有免疫应答。Hultcrantz等〔15〕证实了人类胰岛细胞通过T LR3识别柯萨奇病毒产生I型IFN,而在IFN的刺激之下,胰岛细胞可以产生大量抗病毒蛋白而进入抗病毒阶段,从而阻止病毒复制,保护机体。Hardarson〔16〕报道的 EMCV 感染的 TLR3基因敲除小鼠显示高的死亡率,间接表明T LR3可限制病毒的复制,从而延缓疾病恶化进程。另有报道T LR3在病毒感染中不但发挥保护作用,甚至有治疗作用,如TLR3激动剂对生殖道疱疹病毒感染有保护作用〔17〕。
我们的实验结果从转录水平显示,RSV感染RAW264.7细胞后,可显著上调TLR3和I型干扰素的表达,病毒F蛋白基因的表达增加,且上调作用和感染之间存在时间依赖性关系。在给予TLR3抗体以阻断TLR3活化后,I型干扰素的显著下降及RSV F蛋白基因的上调,说明TLR3的活化在一定程度上可抑制感染中的 RSV复制,其诱生IFN的抗病毒感染保护作用,与Hidaka报道的在流感病毒感染者中观察到的 T LR3作用一致〔18〕,但与Rudd等〔19〕用等量 RSV感染 TLR3转染的人胚肾293细胞时 TLR3在RSV复制中没有作用的结果不符,考虑是其所用细胞类型不同,因肺的巨噬细胞是RSV引起炎症反应的主要效应细胞及免疫细胞,我们选用的 RAW264.7为巨噬细胞,而 HEK293细胞则为人胚肾上皮细胞。此外,实验中我们发现,在封闭T LR3后 IFN-β较IFN-α显著下降,表明了IFN-β可能是由TLR3诱导产生的最主要I型干扰素,I型干扰素的表达至少是部分依赖TLR3活化,这与Matsumoto等报道的IFN-β是由TLR3诱导产生的最主要细胞因子的结果一致。
本研究表明,在RSV感染RAW264.7巨噬细胞后,被活化的T LR3具有诱导产生IFN的抗病毒感染保护作用,尤其是以IFN-β产生为主。T LR3作为其关键因素,进一步研究其在机体抗病毒感染中的作用,可为临床治疗RSV感染及研发抗RSV新药提供重要思路与理论基础。但实验中我们尚未能进行空斑形成试验来测定RSV病毒滴度,以判断其增殖水平,这将在以后的研究中加进一步证实。另外,以往人们普遍认为抗体发挥其生物学活性的区域仅限于细胞外介质,而细胞内介质是抗体的禁区,直至1977年Gilliam等首次发现,抗ENA抗体可穿透细胞膜进入上皮细胞内,并定位于上皮细胞核,从而证明抗体能穿透活细胞膜。近年来又有实验证实抗体穿透活细胞的现象存在,对于TLR3抗体进入活细胞的机制尚需进一步研究。
〔1〕Hall CB.Respiratory syncytial virus and parainfluenza virus〔J〕.N Engl J Med,2001,344(25):1917-1928.
〔2〕 Leclerc F,Scalfaro P,NoizetO,et al.Mechanical ventilatory support in infants with resp iratory syncytial virus infection〔J〕.Pediatr Crit CareMed,2001,2(3):197-204.
〔3〕Kariko K,Ni H,Capodici J,et al.mRNA is an endogenous ligand for toll-like receptor 3〔J〕.J Biol Chem,2004,279(13):12542-12550.
〔4〕Joann Y,Richardson JY,Ottolini MG,et al.Respiratory Syncytial virus(RSV)infection induces cyclooxygenase 2:a potential target for RSV therapy〔J〕.J Immunol,2005,174(7):4356-4364.
〔5〕武彩霞,李巍,刘玉峰,等.抗角蛋白抗体进入活细胞的共聚焦显微镜观察〔J〕.Chin J Cell Mol Immunol.2002,18(5):477-479.
〔6〕黄升海,刘伟,史晓佾,等.呼吸道合胞病毒感染巨噬细胞诱导炎性基因表达的部分机制研究〔J〕.中国人兽共患病学报,2009,25(10):948-952.
〔7〕Mey lan E,Tschopp J.Toll-like receptors and RNA helicases:two parallel ways to trigger antiviral responses〔J〕.Mol Cell,2006,22(5):561-569.
〔8〕Kurt Jones EA,Popova L,Kwinn L,et al.Pattern recog nition receptors TLR4 and CD14 mediate response to respiratory syncytial virus〔J〕.Nat Immunol,2000,1:398-401.
〔9〕M edzhitov R,Preston-Hurlburt P,Janeway CA Jr.A human homologue of the Drosophila Toll protein signals activation of adaptive immunity〔J〕.Nature,1997,388(6640):394-397.
〔10〕 Levy DE,Mari IJ.RIGging an antiviral defense-it's in the CARDs〔J〕.Nat Immunol,2004,5(7):699-701.
〔11〕Kumar M,Behera AK,Lockey RF,et al.Intranasal gene transfer by chitosan-DNA nanospheres protects BALB/c mice against acute respjratory syncytial virus infection〔J〕.Hum Gene Ther,2002,13(12):1415-1425.
〔12〕Huang SH,Wei W,Yun Y.U pregulation of T LR7 and T LR3 gene ex pression in the lung early after respitatory syncy tial virus infetion of mice〔J〕.Microbilogy Acta,2009,49(2):239-245.
〔13〕T hompson JM,IwasakiA.Toll-like receptors regulation of viral infection and disease〔J〕.Adv Drug Deliv Rev,2008,60(7):786-794.
〔14〕M acDonald EM,Savoy A,Gillg rass A,et al.Susceptibility of human female primary genital epithelial cells to herpes simplex virus,type-2 and the effect of T LR3 ligand and sexhormones on infection〔J〕.Biol Reprod,2007,77(6):1049-1059.
〔15〕Hultcrantz M,H hn M H,Wolf M,et al.Interferons induce an antiviral state in human pancreatic islet cells〔J〕.Virology,2007,367(1):92-101.
〔16〕Hardarson HS,Baker JS,Yang Z,et al.Toll-like receptor 3 is an essential component of the innate stress response in virus-induced cardiacinjury〔J〕.Am J Physiol Heart Circ Physiol,2007,292(1):251-258.
〔17〕Ashkar AA,Yao XD,Gill N,et al.T oll-like receptor TLR2,3,but not TLR4,agonist protects against genital herpes infection in the absence of inflammation seen with CpG DNA〔J〕.J Infect Dis,2004,190(10):1841-1849.
〔18〕Hidaka F,Matsuo S,Muta T,et al.Amissense mutation of the T oll-like receptor 3 gene in a patientwith influenza-associated encephalopathy〔J〕.Clin Immunol,2006,119(2):188-194.
〔19〕Rudd BD,Burstein E,Duckett CS,et al.Differential role for T LR3 in respiratory syncytial virus-induced chemokine ex pression〔J〕.J Virol,2005,79:3350-3357.

