芡实黄酮类物质的提取及抗氧化性研究
李成良 ,陈学好 ,李良俊 ,张奉民 ,齐斌 ,钱建亚
(1.扬州大学食品科学与工程学院,江苏扬州,225009;2.扬州大学园艺与植物保护学院;3.扬州大学测试中心;4.常熟理工学院食品与生物工程学院)
芡实(Euryale feroxSalisb),睡莲科芡属,一年生大型水生草本植物,原产中国和东南亚,广泛生长于我国南方湖泊、池塘和滩地,是一种新兴的特种水生植物[1,2]。
芡实主要以种仁(通称芡米)供食用,其营养成分以淀粉为主,另含有蛋白质、维生素、钙、磷、铁、硫胺素、核黄素、尼克酸、抗坏血酸、黄酮、氨基酸和葡糖基甾醇类化合物等[3,4]。芡实不仅具有较高的营养价值,还具有养血安神、益肾固精、去湿健脾、止泻止带等药用功效。《神农本草经》将芡实列为上品,记有“主治湿痹,腰脊酸痛,补中除暴疾,益精气,强志,令耳目聪明,久服轻身不饥”。芡实味甘性平,入脾、肾、胃经,既能益肾,又能健脾,先天、后天之本皆齐备,能提高人体的免疫力,从而祛病强身,延年益寿,是平补之佳品[5,6]。对芡实保健功效和药用价值的认识由来已久,但对其起作用的成分和机理的说明鲜见报道。本文以紫花苏芡和紫花刺芡种仁为原料,研究黄酮类物质的提取条件及提取物的抗氧化性质,以期为芡实的科学利用提供依据。
1 材料与方法
1.1 试验材料
试验材料为扬州大学水生蔬菜试验基地种植的“紫花苏芡”和“紫花刺芡”的成熟种仁。主要试剂芦丁、DPPH为Sigma公司产品。
1.2 试验方法
①水分测定 根据GB/T 12087-2008淀粉水分测定法进行。
②芡实总黄酮含量测定 采用NaNO2-Al(NO3)3-NaOH比色法[7~9]测定总黄酮含量。将去壳的芡实种子粉碎过孔径1 mm筛。取2 g粉,加入80 mL 95%(V/V,下同)乙醇,80℃水浴加热回流3 h,抽滤,所得滤液用95%乙醇定容至100 mL,根据标准曲线,结果以芦丁含量表示。试验重复3次,结果取平均值。
③直接加热浸提法 a.料液比对提取效果的影响。取15个锥形瓶,分成5组并标记,分别称取5.0 g芡实粉于 250 mL 锥形瓶中,加入 25,50,75,100,125 mL 95%乙醇,60℃浸泡2 h,过滤,清洗,然后用 95%乙醇定容至100 mL,测220 nm处的吸光度,根据标准曲线换算成黄酮量,除以总黄酮量得提取率。试验重复3次,结果取平均值。
b.温度对提取效果的影响。取15个锥形瓶,分成五组并标记,分别称取5.0 g芡实粉于250 mL锥形瓶中,加入50 mL 95%乙醇,分别于50℃,60℃,70℃,80℃和90℃保温2 h,过滤,清洗,然后用95%乙醇定容至100 mL,测220 nm处的吸光度,根据标准曲线换算成黄酮量,除以总黄酮量得提取率。试验重复3次,结果取平均值。
c.浸泡时间对提取效果的影响。取15个锥形瓶,分成5组并标记,分别称取5.0 g芡实粉于250 mL锥形瓶中,加入 50 mL 95%乙醇,60℃浸泡 1,2,3,4,5 h,过滤,清洗,然后用95%乙醇定容至100 mL,测220 nm处的吸光度,根据标准曲线换算成黄酮量,除以总黄酮量得提取率。试验重复3次,结果取平均值。
④黄酮超声波辅助浸提法 a.料液比对提取效果的影响。取15个锥形瓶,分成五组并标记,分别称取5.00 g芡实于250 mL锥形瓶中,再向其中加入5,25,50,75,100 mL 95%乙醇,用 400 W 超声波处理 10 min,过滤,清洗,然后用95%乙醇定容至100 mL,测220 nm处的吸光度,根据标准曲线换算成黄酮量,除以总黄酮量得提取率。试验重复3次,结果取平均值。
b.超声波功率对提取效果的影响。取15个锥形瓶,分成5组并标记,分别称取5.00 g芡实于250 mL锥形瓶中,再向其中加入50 mL 95%乙醇,分别用200,300,400,500,600 W 超声波处理 10 min,过滤,清洗,然后用95%乙醇定容至100 mL,测220 nm处的吸光度,根据标准曲线换算成黄酮量,除以总黄酮量得提取率[10~13]。试验重复3次,结果取平均值。
c.超声波处理时间对提取效果的影响。取15个锥形瓶,分成五组并标记,分别称取5.00 g芡实于250 mL锥形瓶中,再向其中加入50 mL 95%乙醇,分别在400 W 超声波处理 5,10,15,20,25 min,过滤,清洗,然后用95%乙醇定容至100 mL,测220 nm处的吸光度,根据标准曲线换算成黄酮量,除以总黄酮量得提取率。试验重复3次,结果取平均值。
⑤超声波辅助提取条件优化 根据提取时间、料液比和超声功率3个因素的单因素试验结果,采用正交试验进行提取条件优化。
⑥芡实黄酮提取液抗氧化性研究 a.清除DPPH能力的测定。对不同黄酮含量的受试物进行反应动力学测定,根据体系达到稳定时残留的DPPH百分数对黄酮(以芦丁为代表)与DPPH摩尔比作图,得到自由基的清除能力(EC50),定义为使起始DPPH浓度降低50% 所需黄酮的量,其倒数(1/EC50)为抗自由基能力(ARP)。使用 A-300 EPR 波谱仪(Bruker,德国),谐振腔为HSC(ER 4119),频率为X波段。将不同摩尔比的DPPH和提取物加入50 μL硼制毛细管,在谐振腔中用硅制吊环固定毛细管。操作温度为20℃。5 min起,每间隔5 min记录一次信号。DPPH的电子顺磁波谱图是五重峰,利用绝对值较大的第2个波峰为计算依据,以加入受试物前后波峰信号大小的比值衡量DPPH的清除能力[14,15]。

表1 超声辅助黄酮提取因素及水平
b.对羟自由基的清除作用。样品组试管中加入1 mL 2 mmol/L FeSO4、1 mL 6 mmol/L 水 杨 酸 、1.2 mL不同浓度的芡实提取溶液、1 mL 6 mmol/L H2O2或1.2 mL蒸馏水,37℃恒温水浴保温一定时间后,取出冷却,测定OD50,根据以下公式计算·OH的清除率[16,17]。
清除率(%)=1-(A1-A2)/A0
其中:A0为不含样品时的吸光值
A1为含有样品的吸光值
A2为含有样品,但不含水杨酸和H2O2的吸光值
2 结果与分析
2.1 芡实种仁中的黄酮类物质和水分含量
紫花苏芡的黄酮类物质含量为(1.864±0.029) mg/g,水分为(92.3±3.5)g/kg;紫花刺芡的黄酮类物质含量为(1.735±0.005) mg/g,水分为(77.3±1.7) g/kg。
2.2 芡实黄酮类物质的特征光谱
在200~780 nm的范围内,芡实提取液的最大吸收峰出现在219.9 nm处(图1,因可见光区无吸收,图中只标示出紫外光区部分吸收光谱),这是黄酮物质常见的光吸收特征。
2.3 芡实种仁黄酮类物质加热浸提效果
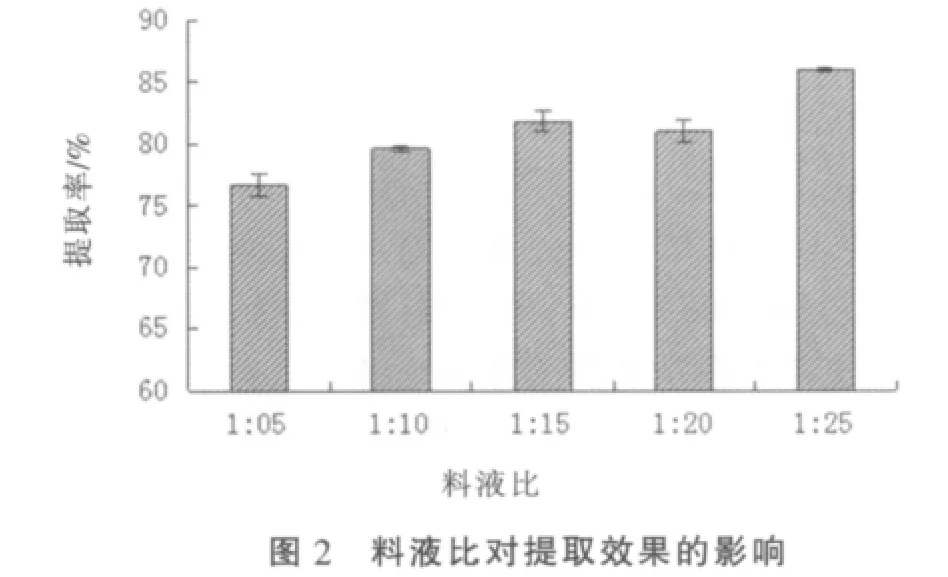
①料液比的影响 在其他条件一定的情况下,随着料液比增加,芡实中黄酮的提取率增加(图2)。在料液比为 1∶25(m/V)时,黄酮提取率最大,为 85.92%。
②提取温度的影响 在其他条件一定的情况下,随着温度增加,黄酮的提取率呈增加趋势(图3),在80℃时获得了最大提取率,提取率为82.29%。
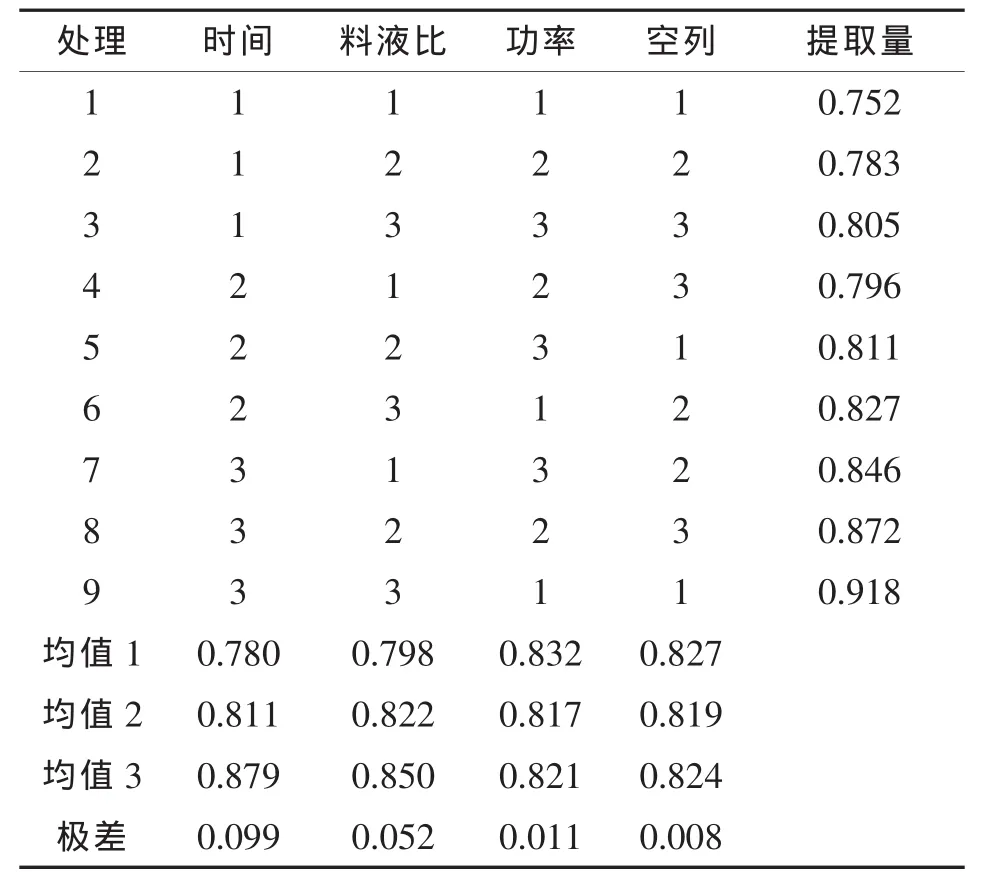
表2 超声辅助黄酮提取正交试验设计及结果



③提取时间的影响 在其他条件一定的情况下,随着提取时间增加,黄酮提取率总体呈上升趋势(图4),在4 h时获得最大提取率83.43%。
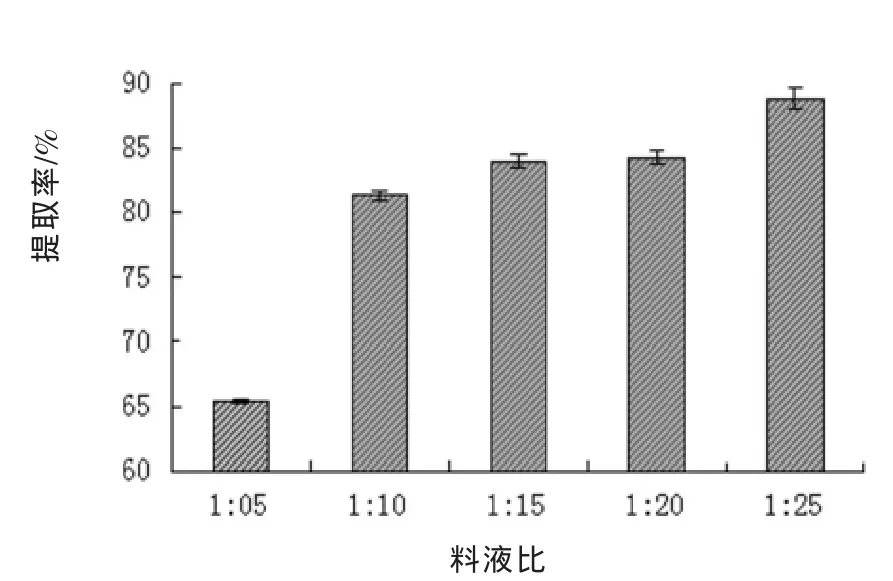
图5 料液比对提取效果的影响

图6 时间对提取效果的影响

图7 超声功率对提取效果的影响
2.4 芡实黄酮超声波辅助浸提效果
①料液比的影响 与上述纯粹的加热提取比较,超声辅助提取时,随着料液比增加,黄酮的提取率呈现增长趋势,在料液比为1∶25(m/V)时获得最大提取率88.86%(图5)。
②提取时间的影响 很明显,超声辅助提取可大大缩短提取时间,在20 min时获得最大提取率87.87%(图6)。
③超声功率的影响 在其他条件一定的情况下,超声功率对黄酮的提取有较大影响,在500 W时获得最大提取率(85.21%)(图7)。
2.5 超声波辅助浸提法的条件优化
在以上单因素试验的基础上,选择提取时间、料液比和超声功率3个因素,根据表1的试验方案,对所得结果(表2)进行方差分析,结果(未列出)表明各因素对芡实中黄酮提取效果的影响依次为:提取时间 >料液比 >超声功率,单个因素之间没有显著差异。最佳提取工艺为:提取时间20 min,功率:400 W,料液比:1∶20(m/v)。
2.6 芡实黄酮类物质的抗氧化作用
①清除DPPH的能力 以DPPH自由基剩余率为纵坐标,时间为横坐标作图,得到紫花苏芡和紫花刺芡类黄酮清除DPPH自由基动力学(图8),结果表明芡实类黄酮属于慢反应动力学类型[18]。由图9可见,芡实清除DPPH的能力与紫花刺芡相当,其EC50都约为0.075,故其 ARP 为 13.3。
②清除羟自由基的能力以羟自由基为纵坐标,时间为横坐标作图,得到紫花苏芡和紫花刺芡类黄酮清除-OH自由基动力学(图10)。图11可以看出,紫花苏芡对羟自由基的抑制能力明显好于紫花刺芡,其半抑制浓度 IC50约为 9.4 mg/L。
3 讨论
采用这2种提取方法的黄酮提取率没有显著差异,直接提取方法过程控制简单,容易实施,但时间和溶剂的消耗较多。超声辅助提取是越来越多使用的方法,省时快捷,但是否会破坏有效成分尚不清楚,工业化生产规模会受到设备大小制约。

图8 类黄酮清除DPPH动力学

图9 芡实提取液的EC50


DPPH是一种很稳定的氮中心的自由基。通过检测某物质对DPPH自由基的清除能力可以评价其抗氧化性的强弱。羟自由基是氧化性极强的氧化剂,其化学性质非常活泼,是对机体为害最大的自由基,可损伤蛋白质、核酸、脂质等多种生物大分子,尤其对脂过氧化的作用最强,不仅是膜脂质过氧化的主要原因,而且还一直被认为是引起DNA损伤的重要因素。紫花苏芡和紫花刺芡类黄酮提取物都具有清除DPPH和羟自由基的能力,但效果有差别。从DPPH的清除效果看,芡实黄酮具有很强的抗氧化功能。体外抗氧化试验有多种体系,其结果有不同的含义,要综合评价某种物质的抗氧化性能需经多种体系验证。此外,本文得到的是混合物,进一步的工作可以对提取物进行分离,研究黄酮类化合物的组成和结构,从而弄清差别产生的原因。
[1]赵有为.中国水生蔬菜[M].北京:中国农业出版社,1999,52.
[2]刑湘臣.芡实杂谈[J].烹调知识,2001,:(7):46-47.
[3]张名位,池建伟,孙玲,等.潮州芡实的营养学评价[J].广东农业科学,1999(2):27-29.
[4]李美红,杨雪琼,万直剑,等.芡实的化学成分[J].中国天然药物,2007,5(1):24-26.
[5]农训学.平补佳品芡实[J].东方药膳,2006(5):39-40.
[6]朱聪明,朱萍.芡实古今应用谈[J].河南中医,2004,24(4):65.
[7]闫红霞.苦丁茶叶中总黄酮的含量测定[J].石油化工应用,2006(4):27-28.
[8]闫斐艳,杨振煌,李玉英,等.苦荞种子总黄酮提取方法的比较研究[J].食品与药品,2010,12(13):93-95.
[9]张海悦,王黎兵,郭新力.狭叶荨麻总黄酮的测定[J].食品科技,2007(12):181-184.
[10]赵文红,赵翾,白卫东,等.柿叶黄酮化合物提取工艺研究[J].陕西科技大学学报,2007,25(5):54-57.
[11]赵琳,赵彩丹,赵焕君.槲树叶总黄酮提取工艺优选研究[J].亚太传统医药,2010,6(2):28-29.
[12]张晨,杨晓泉,唐传核.加热预处理对大豆异黄酮含量及组分的影响[J].粮食加工,2005(6):55-58.
[13]王昌禄,江慎华,陈志强,等.香椿老叶总黄酮提取工艺及其抗氧化活性的研究[J].北京林业大学学报,2008,30(4):28-33.
[14]刘栋,钱建亚,翁利珍.甘薯水溶性紫色素清除DPPH自由基活性研究[J].食品科技,2003(12):50-52,60.
[15]Qian J Y,Liu D,Huang A G.The efficiency of flavonoids in polar extracts ofLycium chinenseMill fruits as free radical scavenger[J].Food Chemistry,2004,87(2):283-288.
[16]Zhao F P,Strack D,Baumert A,et al.Antioxidant flavonoidsfrom leavesofPolygonumhydropiper[J].Phytochemistry,2003,62:219-228.
[17]丁利君,冼建毅.黄芪中黄酮类化合物提取及其对羟自由基清除作用[J].食品与机械,2002(3):20-21.
[18]Brand-Williams W,Cuvellier M E,Berset C.Use of a free radical to evaluate antioxidant activity[J].Lebensm-Wiss U-Technol,1995,28:25-30.

