萌发糙米中不溶性多酚提取工艺的研究
孙兆远,侯会绒
(江苏食品职业技术学院,江苏淮安223003)
萌发糙米中不溶性多酚提取工艺的研究
孙兆远,侯会绒
(江苏食品职业技术学院,江苏淮安223003)
以萌发糙米为原料提取不溶性多酚类化合物,探讨碱水解条件和乙酸乙酯萃取条件对不溶性多酚提取得率的影响。通过单因素实验和正交实验,确定碱水解最佳条件为:粉碎粒度40目、NaOH浓度1.5mol/L、水解时间2.5h、料液比1∶18;乙酸乙酯萃取最佳条件为:乙酸乙酯添加量40mL、萃取时间30min、振荡速度200r/min、pH2.0。在此条件下不溶性多酚提取得率为32.35mg/100g。
萌发糙米,不溶性多酚,提取
多酚类物质是广泛存在于自然界中的一类酚羟基结构的化合物[1],具有很强的抗氧化性和抗自由基能力[2],能阻碍氧化物破坏脂类和低密度脂蛋白[3]、抑制血小板凝聚[4]、降低冠心病和癌症的几率[5],还具有延缓组织和人体衰老等功效,是很好的抗氧化物质[6]。现代流行病学研究表明,食用全粒谷物或相关产品对降低心脑血管等慢性疾病具有很好的效果,主要是因为全粒谷物中的多酚类物质的作用。植物多酚是植物体内次生代谢的中间产物,以游离态、酯化态和结合态的形式存在于植物体中,游离态和酯化态被称为可溶性酚类[7],主要有阿魏酸、对香豆酸[8]、原儿茶酸、没食子酸、咖啡酸[9]、芥子酸[10]等;结合态被称为不溶性酚类,以酯键、糖苷键、醚苷键等形式与其他物质(包括蛋白质、单糖、有机酸等)相结合[7]。谷物中的多酚绝大多数以结合形式存在(玉米85%、燕麦75%、小麦75%)[11]。目前,相关的论文报道中对谷物中酚类物质均采用甲醇、乙醇、丙酮的水溶液进行提取,为了提高提取得率,多采用延长提取时间或者是对谷物进行粉碎处理。报道中没有对不溶性多酚进行水解,因此提取得率很低。谷物在萌发过程中,淀粉酶、纤维素酶、蛋白酶被激活,其质构有所改善且营养物质变得容易消化和吸收[12],同时苯丙烷代谢增强,使得多酚类物质含量增多,抗氧化能力增强[5]。本研究以萌发糙米为原料提取不溶性多酚,以提取得率为指标,探讨了碱水解条件和乙酸乙酯萃取条件对提取得率的影响,以得出不溶性多酚最佳提取方案。
1 材料与方法
1.1 材料与仪器
苏北大米 由淮安市清浦区苏鑫米厂提供;萌发糙米 自制;阿魏酸、Folin-Ciocalteu试剂 Sigma公司;其余试剂 均为国产分析纯。
HP250GS-C型智能人工气候箱 武汉瑞华;WF180万能粉碎机 上海光学仪器厂;RE-2000A旋转蒸发器 上海亚荣;BS-1E振荡培养箱 苏州威尔;TU-1900紫外可见分光光度计 北京普析;VF203真空抽滤装置 北京桑翌;JA1003A电子精密天平 上海伦捷;PHS-3C酸度计 上海雷磁。
1.2 实验方法
1.2.1 样品处理 糙米萌发条件:准确称量糙米400g,用水洗净,加水2000mL,于32℃条件下浸泡21h,选取芽长1mm的萌发糙米作为试样,低温冻干后,用万能粉碎机粉碎,过40目筛,然后于-20℃条件下冷冻储存。
1.2.2 不溶性多酚的提取 精确称取5.0g磨碎的萌发糙米样品,己烷(4×50mL,30min每次)脱脂,抽滤后放于烘箱中烘干,然后用70%乙醇去除游离酚酸。残渣浸入NaOH溶液中在充氮条件下水解。离心分离后,混合上清液,用HCl调至酸性,加入乙酸乙酯于恒温振荡箱中振荡萃取3次[11]。混合萃取液于35℃充氮旋转蒸干后用甲醇定容至50mL。
1.2.3 不溶性多酚含量的测定
1.2.3.1 标准曲线的绘制 分别吸取0、0.50、1.00、1.50、2.00、2.50、3.00mL 1.0mg/mL阿魏酸标准溶液于50mL容量瓶中,加入2mL 20%Folin-Ciocalteu试剂,混匀后静置5min,再加入5mL 7.5%Na2CO3溶液混匀,用去离子水定容至50mL,35℃下避光静置30min,以去离子水做空白,在768nm波长下测定吸光度值。以吸光度值为纵坐标,阿魏酸标准溶液浓度为横坐标,绘制标准曲线(图1)。
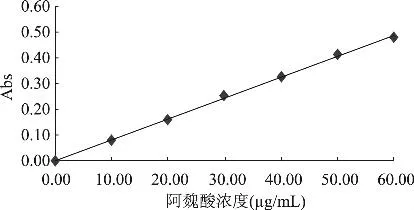
图1 阿魏酸标准曲线
由图1可知,阿魏酸在0~60μg/mL范围内线性回归方程为y=0.00809x+0.00071,相关系数R2= 0.9989,结果符合朗伯比尔定律,表面线性关系良好,可用于萌发糙米提取液多酚含量测定。
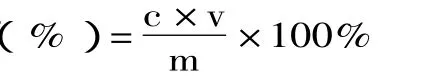
式中:c-提取液中多酚浓度;v-提取液体积;m-样品质量。
2 结果与分析
2.1 碱水解条件的确定
2.1.1 粉碎粒度对不溶性多酚提取得率的影响 精确称取目数分别为10、20、30、40、50、60目的6份样品各5.0g,按照操作步骤1.2.2进行不溶性多酚水解和提取,提取物按照1.2.3进行含量测定,结果见图2。
由图2可知,多酚提取得率随粉碎粒度的增大而迅速增加,主要因为糙米颗粒越小,比表面积越大,在单位时间内与碱液接触面积越大,分解速度增加,提取得率也就越大。但当糙米粒度小于30目时,提取得率开始下降,原因可能是糙米颗粒内部的淀粉等其它物质浸出速度加快,提取液黏度增大,将不溶性多酚包裹,阻碍了碱液与不溶性多酚的接触,使得分解速度减弱,水解液过滤困难,对乙酸乙酯萃取造成较大影响。由此可见,粉碎粒度以30目为宜。
2.1.2 NaOH浓度对不溶性多酚提取得率的影响分别量取浓度为0、0.5、1.0、1.5、2.0、2.5、3.0mol/L NaOH溶液各100mL,按照操作步骤1.2.2进行不溶性多酚水解和提取,提取物按照1.2.3进行含量测定,结果见图3。
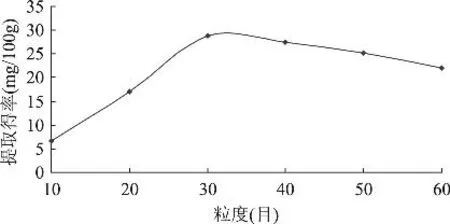
图2 粉碎粒度对多酚提取得率的影响
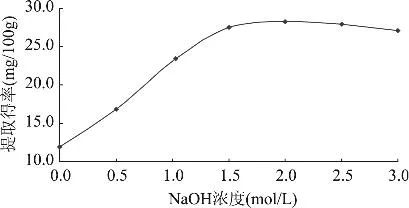
图3 NaOH浓度对多酚提取得率的影响
由图3可知,随着NaOH浓度的增大,不溶性多酚与蛋白质、单糖、有机酸等结合形成的酯键、糖苷键、醚苷键被破坏,酚酸由结合形式转为游离形式游离到碱液之中,使得提取得率增大。当NaOH浓度增加到1.5mol/L时,提取得率达到最大值,之后缓慢降低,这主要是因为在酸性条件下酚类物质比较稳定,而在强碱性条件下,其分子容易发生断裂而分解[13]。同时,在强碱条件下淀粉、纤维素发生水解,使得溶液黏度增加,一定程度上抑制了多酚物质的浸出。因此,NaOH浓度为1.5mol/L较好。
2.1.3 碱水解时间对不溶性多酚提取得率的影响
精确称取样品8份各5.0g,按照操作步骤1.2.2分别水解0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0h后进行提取,提取物按照1.2.3进行含量测定,实验结果见图4。
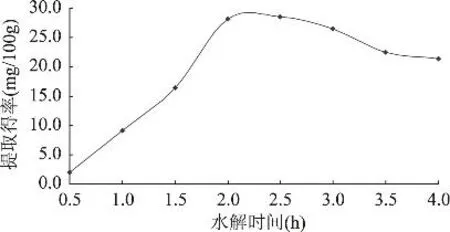
图4 水解时间对多酚提取得率的影响
由图4可知,多酚提取得率随水解时间的延长而增加,主要是因为水解反应开始时反应底物浓度较大,NaOH与不溶性多酚与其他物质结合的酯键、糖苷键、醚苷键接触的机会大,使得反应迅速进行。当水解时间到达2.0h时,多酚提取得率出现峰值,之后随时间延长而缓慢降低。这主要是因为强碱性条件下,多酚物质发生分解反应造成。因此选择水解时间为2.0h较好。
2.1.4 料液比对不溶性多酚提取得率的影响 分别量取50、60、70、80、90、100、110、120mL的NaOH溶液,按照操作步骤1.2.2进行不溶性多酚水解和提取,提取物按照1.2.3进行含量测定,结果见图5。
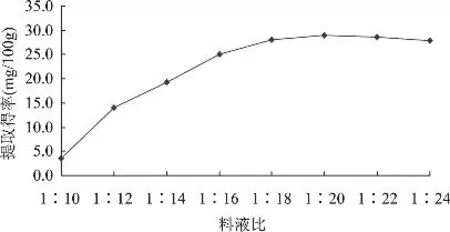
图5 料液比对多酚提取得率的影响
由图5可知,当料液比为1∶10时,不溶性多酚提取得率很低(3.50mg/100g),这主要是提取液呈黏稠状态,不利于NaOH水解和乙酸乙酯的萃取。当料液比逐渐增大时,碱水解速度增加,提取得率也增加,并在料液比为1∶18时出现峰值。之后随料液比的增大,提取得率缓慢降低,这可能是因为料液比增大使得提取液中多酚浓度降低,与乙酸乙酯中多酚浓度的差值降低,萃取不彻底,另外,碱水解液添加量增大,溶液pH上升,多酚稳定性变差。因此选择料液比1∶18为好,即NaOH的添加量为90mL。
2.1.5 碱水解最佳条件的确定 在单因素的基础上,以粉碎粒度、NaOH浓度、水解时间及料液比为考察因素,以不溶性多酚提取得率为指标,采用L9(34)正交实验确定碱水解最佳条件。因素水平见表1,正交实验结果见表2。
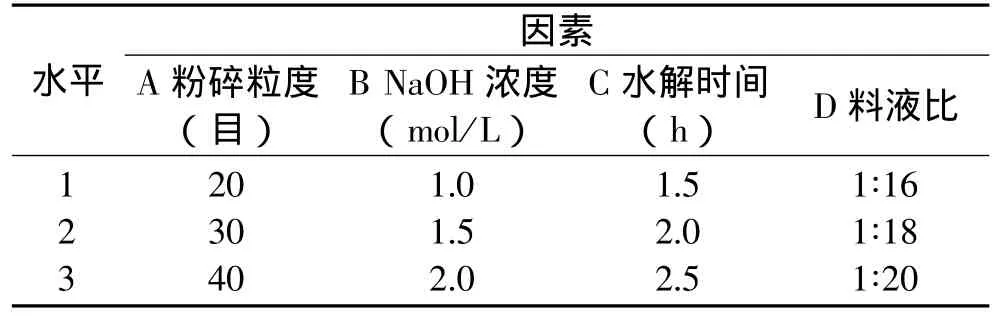
表1 碱水解因素水平表
由表2中R值可以看出,各因素对结果的影响次序为:C>B>D>A,即水解时间对提取得率的影响最大,NaOH浓度次之,粉碎粒度对提取得率的影响最小。
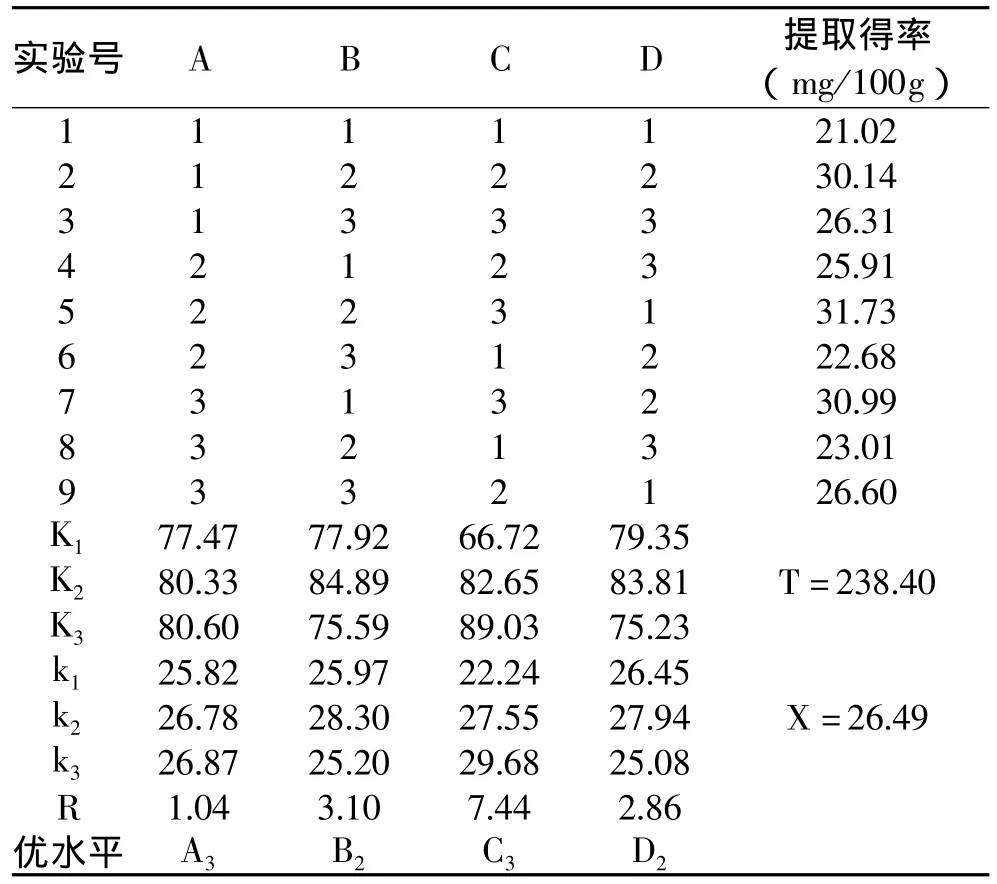
表2 碱水解正交实验结果
由表2中提取得率水平对应的k值可以看出,本实验的最佳组合A3B2C3D2,经验证实该条件下不溶性多酚提取得率高于正交实验中的最大值,因此确定最佳碱水解条件为:粉碎粒度40目、NaOH浓度1.5mol/L、水解时间2.5h、料液比1∶18。
2.2 乙酸乙酯萃取条件的确定
2.2.1 乙酸乙酯添加量对不溶性多酚提取得率的影响 分别量取10、20、30、40、50、60、70、80mL乙酸乙酯,按照操作步骤1.2.2进行不溶性多酚水解和提取,提取物按照1.2.3进行含量测定,结果见图6。
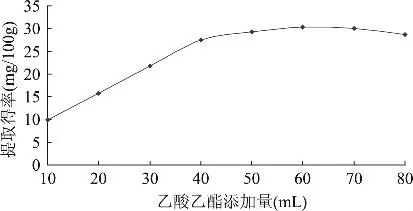
图6 乙酸乙酯添加量对多酚提取得率的影响
由图6可知,当乙酸乙酯添加量为10mL时,不溶性多酚提取得率处于较低水平(9.90mg/100g),这主要是因为水解液经 HCl调节 pH后体积可达250mL,10mL的乙酸乙酯不足以将所有多酚萃取出来,同时,乙酸乙酯微溶于水,致使体积降低。随着乙酸乙酯添加量的增大,提取得率逐渐增大,当添加量为40mL时接近最大值,再增加乙酸乙酯的量,提取得率略有上升,但给蒸发浓缩带来困难,当添加量大于60mL后,提取得率出现下降,这就是旋转蒸发过程中多酚氧化损失造成的。因此选择乙酸乙酯添加量40mL为好。
2.2.2 萃取时间对不溶性多酚提取得率的影响 精确称取样品8份各5.0g,按照操作步骤1.2.2分别萃取5、10、15、20、25、30、35、40min,提取物按照1.2.3进行含量测定,结果见图7。

图7 振荡时间对多酚提取得率的影响
由图7可知,多酚提取得率随振荡时间的延长而逐渐增加,其中前25min内增加速度较快,当振荡时间大于25min后,提取得率基本变化不大,为提高生产效率,减少多酚氧化,选择振荡时间为25min较好。
2.2.3 振荡速度对不溶性多酚提取得率的影响 精确称取5份样品各5.0g,按照操作步骤1.2.2在转速分别为50、100、150、200、250r/min的恒温振荡培养箱中振荡萃取,提取物按照1.2.3进行含量测定,结果见图8。
由图8可知,多酚提取得率随振荡速度的增加逐渐增大,当速度在200r/min时多酚提取得率接近最大值,随后缓慢增大,但当速度达到250r/min,由于振荡速度过大,三角瓶中溶液有溅出,因此选择振荡速度为200r/min较好。
2.2.4 pH对不溶性多酚提取得率的影响 精确称取5份样品各5.0g,按照操作步骤1.2.2用HCl分别调至pH为1、2、3、4、5、6,然后加入乙酸乙酯萃取,提取物按照1.2.3进行含量测定,结果见图9。
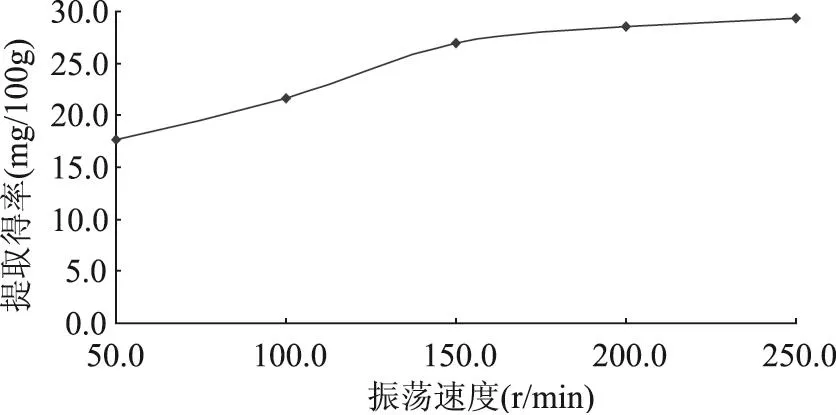
图8 振荡速度对多酚提取得率的影响

图9 pH对多酚提取得率的影响
由图9可知,多酚提取得率先随pH的增加而降低,这主要是因为多酚类物质在酸性条件下较稳定,而在碱性条件下,其分子容易发生断裂而分解。另外由于振荡时无法进行充氮处理,振荡过程中会带入氧气,使得多酚物质发生分解或生成其他物质,因此选择pH为2.0。
2.2.5 乙酸乙酯萃取最佳条件的确定 在单因素实验基础上,以乙酸乙酯添加量、萃取时间、振荡速度及pH为考察因素,以不溶性多酚提取得率为指标,采用L9(34)实验确定最佳萃取条件。因素水平见表
3,正交实验结果见表4。

表3 乙酸乙酯萃取因素水平表
由表4中R值可知,各因素对结果的影响次序为:C>D>B>A,即振荡速度对不溶性多酚提取得率的影响最大,pH次之,乙酸乙酯添加量对提取得率的影响最小。由表4中乙酸乙酯萃取实验水平对应的k值可知,本实验的最佳组合A2B3C2D2,即不溶性多酚提取得率最高时,最佳萃取条件为:乙酸乙酯添加量40mL、萃取时间30min、振荡速度200r/min、pH2.0。
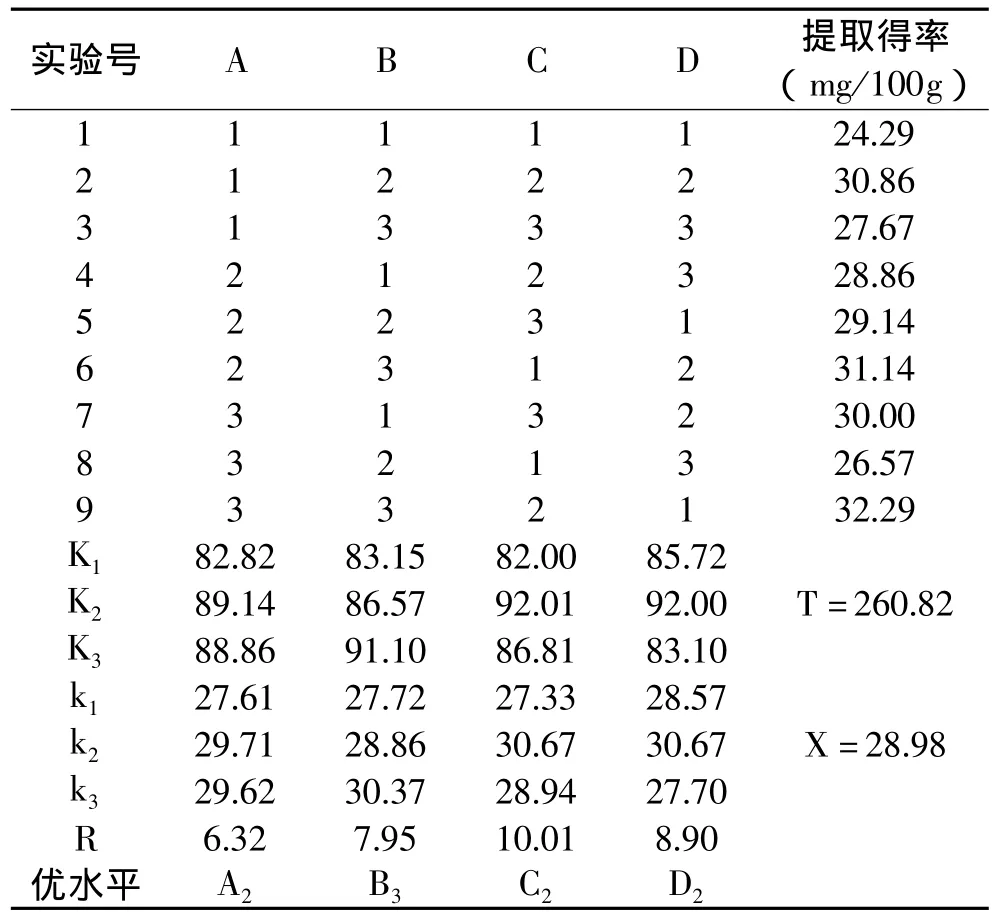
表4 乙酸乙酯萃取正交实验结果
2.3 验证实验
因为A2B3C2D2的提取条件不在正交实验表中,所以按此提取条件补做3次验证实验,结果见表5。

表5 验证实验结果
由表5可知,在设定的提取条件下,不溶性多酚的提取得率较高(32.35mg/100g)且稳定,平均得率超过正交实验最大值,具有可行性和实用价值。
3 结论
通过单因素实验和正交文验,确定萌发糙米中不溶性多酚物质的碱水解最佳参数为:粉碎粒度40目、NaOH浓度1.5mol/L、水解时间2.5h、料液比1∶18;乙酸乙酯萃取最佳条件为:乙酸乙酯添加量为40mL、萃取时间为30min、振荡速度200r/min、pH2.0。在此条件下不溶性多酚提取得率为32.35mg/100g。
[1]Shashidi F,Wanasundara PK.Phenolic antioxidants[J].Crit Rev Food Sci Nutr,1992,32:67-103.
[2]Morton LW,Abu-Amsha Caccetta R,Puddey IB,et al. Chemistry and biological effects of dietary phenolic compounds:relevance to cardiovascular disease[J].Clin Exp Pharmacol Physiol,2000,27:152-159.
[3]Daniel O,Meier MS,Schlatter J,et al.Selected phenolic compoundsin cultivated plants:Ecologic functions,health implications,and modulation by pesticides[J].Environ Health Perspect,1999,107:109-114.
[4]Newmark HL.Plant phenolics as potential cancer prevention agents[J].Adv Exp Med Biol,1996,401:25-34.
[5]Tian S,Nakamura K,Kayahara H.Analysis of Phenolic Compounds in White Rice,Brown Rice,and Germinated Brown Rice[J].J Agric Food Chem,2004,52:4808-4813.
[6]Scalbert A,Williamson G.Dietary intake and bioavailability of polyphenols[J].J Nutr,2000,130:2073S-85S.
[7]Jung MY,Jeon BS,Bock JY.Free,esterified,and insolublebound phenolic acids in white and red Korean ginsengs[J].Food Chemistry,2002,79(1):105-111.
[8]Ayumi H,Masatsune M,Seiichi H.Analysis of free and bound phenolics in rice[J].Food Science and Technology Research,1999(5):74-79.
[9]Rao MS,Muralikrishna G.Evaluation of the antioxidant properties of free and bound phenolic acids from native and malted finger millet[J].J Agric Food Chem,2001,50(4):889-892.
[10]Bunzel M,Allerdings E,Sinwell V,et al.Cell wall hydroxycinnamates in wild rice(Zizania aquatica L.)insoluble dietary fibre[J].European Food Research and Technology,2002,214(6):482-488.
[11]Adom KK,Liu RH.Antioxidant activity of grains[J].J Agric Food Chem,2002,50(21):6182-6187.
[12]Oste RE.Digestibility of processed food protein[J].Adv Exp Med Biol,1991,289:371-388.
[13]冯艳丽,员月明,夏艳.碱法水解大豆异黄酮工艺条件研究[J].中国油脂,2009,34(5):56-58.
Extraction technology of bound phenolics in pre-germinated brown rice
SUN Zhao-yuan,HOU Hui-rong
(Jiangsu Food Science College,Huai’an 223003,China)
The factors of alkaline hydrolysis and ethyl acetate extraction,which influence the extraction yield in the technology for extraction of bound phenolics from pre-germinated brown rice,were researched through single factor experiments and orthogonal experiment.The optimum technological parameters for extraction of bound phenolics were determined:particle size 40 mesh,NaOH concentration 1.5mol/L,alkaline hydrolysis 2.5h,solidliquid ratio 1∶18.The extraction parameters were addition of ethyl acetate 40mL,extraction time 30min,shake speed 200r/min,pH2.0.The yield of bound phenolics could reach 32.35mg/100g.
pre-germinated brown rice;bound phenolics;extraction technology
TS210.1
B
1002-0306(2010)12-0231-05
2010-07-07
孙兆远(1979-),男,讲师,主要从事天然产物活性成分的提取与应用研究。
淮安市2008年度科技支撑计划(工业)项目(HAG08056)。

