C2-C5直链烯烃在HY和H-ZSM-5分子筛上的吸附
郭玉华 蒲 敏 陈标华
(1湖州师范学院,浙江湖州 313000; 2北京化工大学化工资源有效利用国家重点实验室,北京 100029)
C2-C5直链烯烃在HY和H-ZSM-5分子筛上的吸附
郭玉华1,*蒲 敏2陈标华2
(1湖州师范学院,浙江湖州 313000;2北京化工大学化工资源有效利用国家重点实验室,北京 100029)
采用ONIOM(B3LYP/6-311++G(d,p):UFF)分层计算方法,研究了C2-C5直链烯烃在HY和H-ZSM-5分子筛上的吸附性质.理论计算结果表明:烯烃与分子筛的Brønsted酸性位相互作用形成π配位超分子复合物;随着碳链的增长,烯烃的吸附能增加,增加量近似为一个常数(HY分子筛:约12 kJ·mol-1;H-ZSM-5分子筛:约25 kJ·mol-1),与烷烃在分子筛上的吸附具有相同的规律.双键位置对烯烃的吸附能影响很大,2位烯烃的吸附能要远大于1位烯烃的吸附能.不同类型分子筛对烯烃的吸附性能也有很大差别,由于局域效应的影响,小孔径H-ZSM-5分子筛上的吸附能大于大孔径的HY分子筛,而且碳链越长,这种差别越大.从微观结构上看,吸附的烯烃与H-ZSM-5分子筛酸性位的距离要远大于它们与HY分子筛酸性位的距离,这是由于不同类型分子筛的微孔结构产生的范德华作用是不同的,这种作用随着孔径的减小而增强.前线轨道分析表明,对于小分子烯烃,大孔径HY分子筛对其催化活性相近,而小孔径H-ZSM-5分子筛随着烯烃碳原子数的增加催化活性有减弱的趋势.
吸附;烯烃;分子筛;ONIOM
分子筛因具有良好的催化活性、选择性及热稳定性而被广泛地用在石油化工、生物工程、环保工程等领域.分子筛催化活性的差别是由于酸性位的酸强度和局域效应(confinement effects)的不同,即吸附分子和分子筛孔结构之间的作用[1-2].Derouane等[3-4]发现局域效应是源于范德华作用.反应分子在分子筛骨架中的吸附是影响分子筛催化活性和选择性以及分离效率的重要步骤.烯烃的吸附是聚合、裂解等重要工业过程的基础,因而研究烯烃在分子筛上的吸附性能是非常有意义的.
关于乙烯在分子筛上吸附的红外及核磁检测给出了Brønsted酸(B酸)与乙烯作用强度的信息[5-7]. Cant等[8]报道了乙烯在Y型分子筛上的吸附,实验测得吸附热约为37.66 kJ·mol-1.由于烯烃吸附在分子筛酸性位时非常容易发生异构和聚合反应[9-11],因此C2以上烯烃的吸附热难于检测,关于它的实验研究也变得稀少.相反,人们对烷烃吸附性质的研究较多[12-15],结果发现,随着烷烃碳链的增长其吸附热增加,分子筛的孔径越小烷烃的吸附热越大.那么烯烃是否也具有像烷烃一样的吸附性质,目前还不能从实验上获得这些信息.而量子化学方法能够提供能量以及一些吸附物种的微观结构信息.Y型分子筛是石油催化裂化过程中主要的催化剂,而ZSM-5作为助剂加入催化裂化装置可大大增加炼油厂低碳烯烃的产率,提高汽油辛烷值.因此,本文从理论上研究C2-C5直链烯烃在HY和H-ZSM-5分子筛上的吸附性质.
由于分子筛的晶胞通常都含有成百上千个原子,目前的计算条件尚不能对分子筛单晶胞直接进行量子化学计算.考虑到分子筛上发生的吸附和反应主要是酸性位附近的原子,因此人们在处理分子筛体系时通常采用簇模型的方法,以分子筛活性位的结构代替分子筛[16-18].这种模型忽略了分子筛骨架结构对体系的能量和电子结构的影响,无法区分具有不同结构的分子筛对物种的作用,这样就会导致簇模型结果和实际分子筛情况的差异.近来发展的多种方法联用的策略,例如嵌入式方法、量子力学和分子力学结合(QM/MM)方法[19-21]、以及ONIOM方法[22-26],为大分子体系的精确计算提供了可能,同时大大节省了计算时间.其中ONIOM方法已成功用于分子筛体系结构特征及反应机理的研究[27-31].因此,本文采用ONIOM方法研究具有不同骨架结构的分子筛对烯烃吸附性能的影响,为实验研究提供理论依据.
1 计算模型与方法
为了考察不同结构的分子筛对烯烃吸附性能的影响,本文选取Y型分子筛(晶胞参数:a=b=c= 2.5028 nm[32])和ZSM-5分子筛(晶胞参数:a=2.0022 nm,b=1.9899 nm,c=1.3383 nm[33]).从HY型分子筛十二元环主孔道上截取144T簇模型来模拟Y型分子筛的结构,从ZSM-5分子筛十元环主孔道上选择88T簇模型来模拟ZSM-5分子筛的结构.这两个簇模型分别包含了一个完整的超笼作为纳米尺寸化学反应器,使反应物分子能充分地被包裹在其中.
计算采用ONIOM2方法,模型分为两层:内层活性区间以3T簇模型(HY:[═OSiO(H)Al(O)2OSiO═]; H-ZSM-5:[≡SiO(H)Al(O)2OSi≡])来代表分子筛的酸性位,3T模型和吸附物分子的相关计算均采用密度泛函理论(DFT)[34]B3LYP方法[35-36]在6-311++G (d,p)基组水平上完成,使参与作用的原子能够被精确计算;分子筛的外层骨架采用较低水平的UFF分子力场来处理,既减少了计算时间同时又可以考虑环境对吸附分子的影响.为避免边界效应,内层与外层之间采用氢原子连接,各层计算均为电中性.先前研究表明UFF能够较好地描述吸附分子与分子筛之间的范德华作用[22,37-38],同时一些文献也指出ONIOM方法采用B3LYP与UFF组合,计算的分子筛对有机分子的吸附能与实验值接近[22,39-40].因此,为获得不同骨架结构的分子筛对烯烃的吸附规律,本文采用B3LYP与UFF组合的方法在高精度基组6-311++G(d,p)基础上进行计算.
根据Morokuma等[41-44]提出的两层ONIOM方法,整个体系的总能量可以表达为:
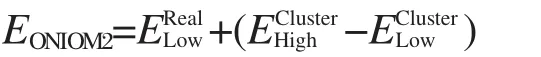
其中上标Real代表整个体系,Cluster代表内层活性区间,下标High和Low分别代表ONIOM计算方法中高级别B3LYP方法和低级别UFF力场.为了保持分子筛骨架结构不发生结构畸变,对模型结构的活性区间(3T簇和吸附物)进行全优化,将扩展的骨架原子固定在其晶体结构的位置上.所有计算工作利用Gaussian 03程序[45]完成.
2 结果与讨论
2.1 C2-C5烯烃在HY分子筛上的吸附
采用ONIOM(B3LYP/6-311++G(d,p):UFF)分层计算方法,优化得到了C2-C5烯烃在HY分子筛主孔道中的吸附态复合物稳定结构,C2-C5烯烃用C1-C2-R3-R(R3代表H或C3;R代表H、CH3、C2H5基团)通式来表示,其示意图见图1.表1给出了1位烯烃及2位烯烃与HY分子筛形成吸附复合物的主要结构参数(其中Et-HY表示乙烯复合物,Pr-HY表示丙烯复合物,Bu-HY表示1-丁烯复合物,Pe-HY表示1-戊烯复合物,2-Bu-HY表示2-丁烯复合物,2-Pe-HY表示2-戊烯复合物).为了与独立的吸附分子进行比较,表2列出了C2-C5烯烃的主要几何参数.六种复合物中,酸性位质子H1都恰好位于C═C双键的正下方,二者相互作用形成了π配位的超分子复合物.通过红外光谱已经观测到这种π吸附的作用[7,46].由表1和表2可见:对于乙烯来说,酸性质子H1与双键两端的碳原子距离相近(R(C1—H1)= 0.2281 nm;R(C2—H1)=0.2309 nm);而对于丙烯、1-丁烯和1-戊烯来说,H1质子与双键α位的C1原子的距离比与C2原子的距离小,而且这个距离差较大,约在0.02-0.03 nm范围内(R(C1—H1)≈0.21 nm; R(C2—H1)=0.23-0.25 nm);对于2-丁烯和2-戊烯来说,H1质子与双键两侧碳原子的距离差略小,约为0.01 nm.造成这种偏离的原因是当双键在端基时,电子云偏向双键端基上的碳原子,此时端基C1原子的负电性更强,从而造成π配位的质子H1偏向C1原子,意味着C1原子更容易被质子化;而当双键在分子的中间位置时由于双键两侧的甲基或乙基为给电子基团使得双键上的两个碳原子电子云分布均匀性增加,因此π配位质子H1与双键两侧的C原子距离差略小.2位烯烃与酸性位之间的距离要比1位烯烃与酸性位之间的距离远,意味着1位烯烃更易被质子化而发生反应.此外,超分子复合物的结构参数与独立的簇模型和烯烃的结构参数相比,相应的键长、键角值相差不大,这说明烯烃的π吸附是一种弱的作用,并没有严重地破坏各物种的几何构型.仅观察到C═C双键略微拉长了约0.0005 nm,R(H1—O1)键拉长了0.0013-0.0027 nm. R(H1—O1)键长的变化要比C═C双键变化的大,说明酸性质子易于发生移动.
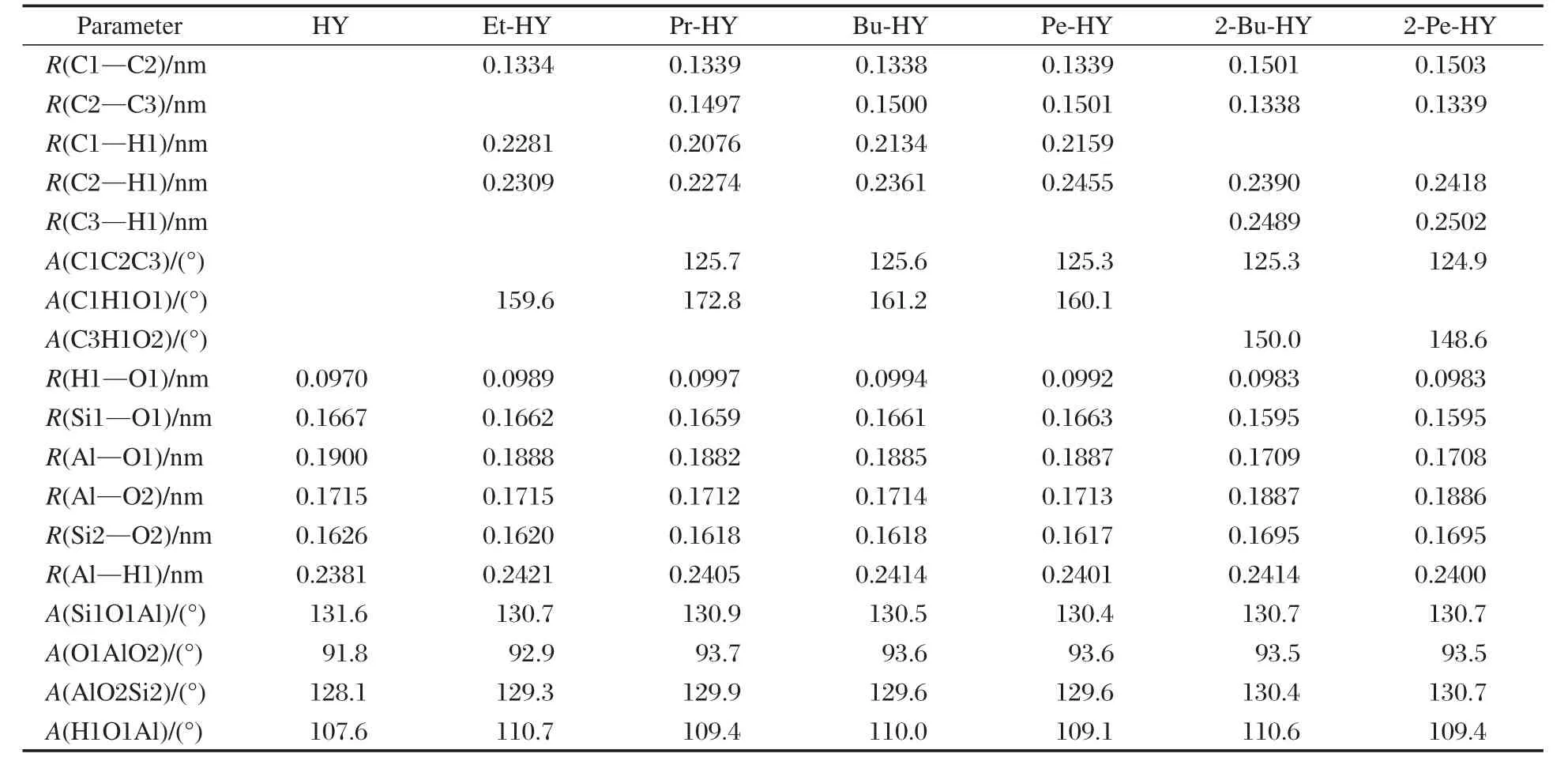
表1 C2-C5直链烯烃与HY分子筛形成吸附复合物的优化几何构型参数Table 1 Optimized geometric parameters of the adsorption complexes of linear C2-C5alkenes on HY zeolites
烯烃的吸附能是由两个因素控制:一是由分子筛的微孔结构引起的范德华作用[1];二是吸附物种与B酸位发生的共价或氢键作用[47-48].由于考虑了HY分子筛扩展的骨架结构对吸附烯烃的影响,因此所计算的吸附能包括了这两种作用.表3给出了C2-C5烯烃在HY分子筛上的吸附能.由表3可见,乙烯的吸附能为34.51 kJ·mol-1,文献报道采用相同方法在HY分子筛84T簇模型上计算的吸附能为36.61 kJ·mol-1[22],两个计算值相近,说明本文选取144T簇模型已经能够很好地反映分子筛骨架结构.而它们又接近实验测得的乙烯在HY分子筛上的吸附能(约为37.66 kJ·mol-1[8]).因此,ONIOM方法及所选簇模型能够很好地反映扩展的骨架结构影响,小的偏差也许源于DFT对范德华力作用的表达较弱,但并不影响烯烃在分子筛上吸附规律的研究.丙烯、1-丁烯和1-戊烯的吸附能分别为47.60、59.50和69.25 kJ·mol-1,可以看出,随着碳链的增长烯烃的吸附能增加,每增加一个CH2基团吸附能增加的量约为常数(约12 kJ·mol-1).2-丁烯和2-戊烯的吸附能分别为85.06和98.81 kJ·mol-1,2-戊烯的吸附能增加了13.75 kJ·mol-1.由于烯烃与分子筛催化剂接触时非常容易发生反应[9-11],C2以上烯烃的吸附热没有对应的实验值.但乙烯的理论计算值和实验值的对比,验证了本文计算结果能够反映烯烃在分子筛上的吸附规律.烷烃在分子筛上吸附性质的研究结果揭示出,随着烷烃碳链的增长吸附热增加,这个增加量也几乎是一个常数[12-14,49-50].这表明烯烃在分子筛上的吸附与烷烃的吸附具有相同的规律.此外,烯烃的双键位置对吸附能影响很大,2-丁烯和2-戊烯的吸附能比1-丁烯和1-戊烯的吸附能分别增加了25.56和29.56 kJ·mol-1,表现出双键在端基的烯烃远没有双键在内部的烯烃稳定.分析1位烯烃和2位烯烃的结构参数,这也许是由于2位烯烃中的双键与酸性位质子的π配位作用比较对称,有利于轨道的叠加所致.
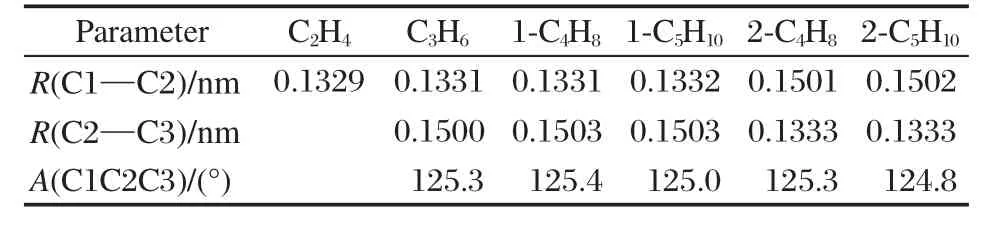
表2 C2-C5直链烯烃主要优化几何构型参数Table 2 Main optimized geometric parameters of linear C2-C5alkenes
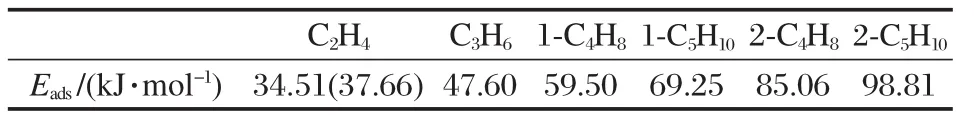
表3 C2-C5直链烯烃在HY分子筛上的吸附能Table 3 Adsorption energies of linear C2-C5alkenes on HY zeolites
2.2 C2-C5烯烃在H-ZSM-5分子筛上的吸附
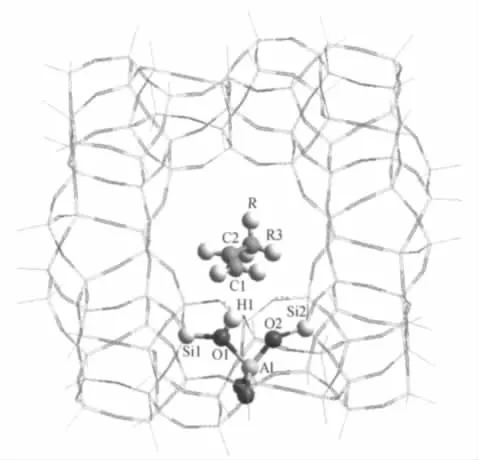
图2 直链烯烃与H-ZSM-5分子筛形成吸附复合物的结构Fig.2 Structures of the adsorption complexes of linear alkenes on H-ZSM-5 zeolitesR3=H or C3;R=H,CH3,C2H5
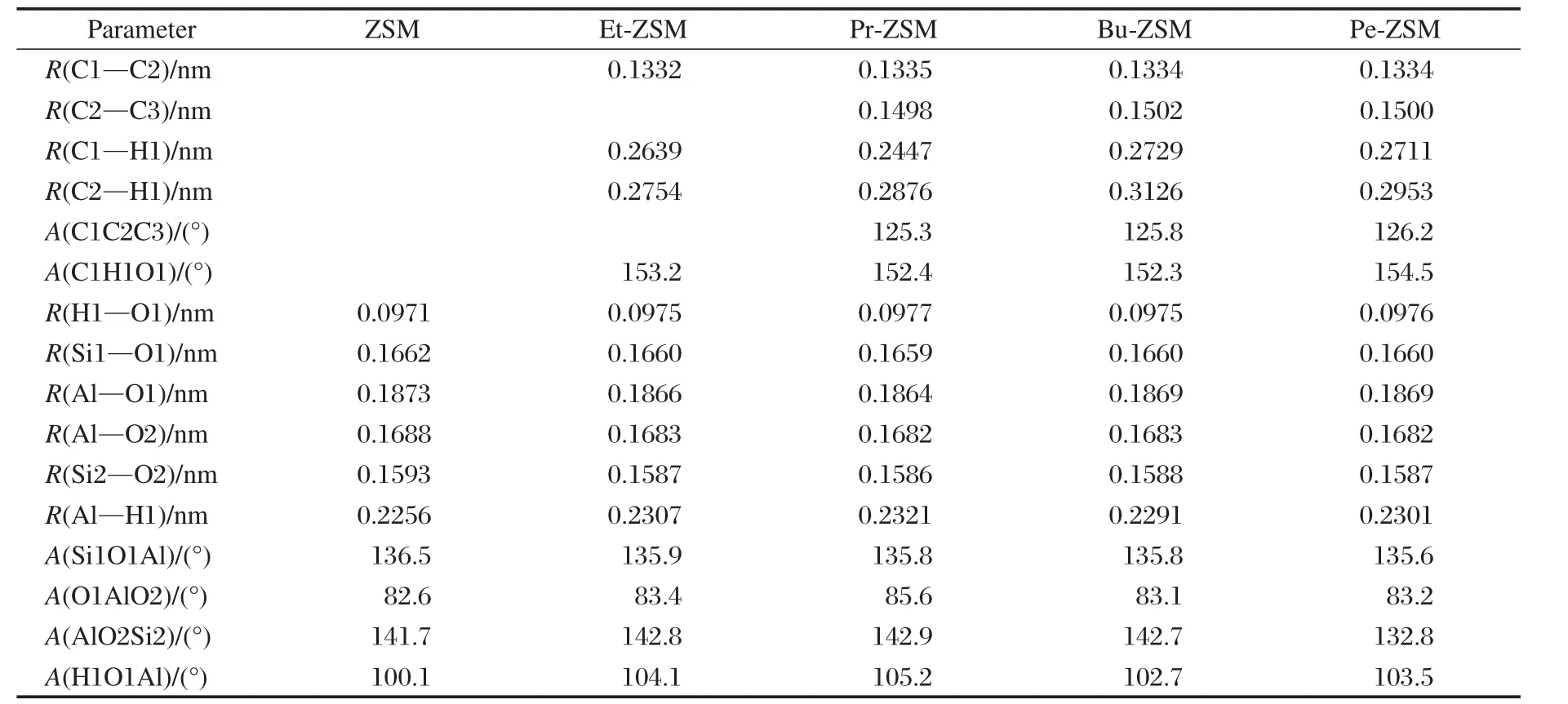
表4 C2-C5直链烯烃与H-ZSM-5分子筛形成吸附复合物的优化几何构型参数Table 4 Optimized geometric parameters of the adsorption complexes of linear C2-C5alkenes on H-ZSM-5 zeolites
采用ONIOM(B3LYP/6-311++G(d,p):UFF)分层计算方法,优化得到了C2-C5烯烃在H-ZSM-5分子筛主孔道上的吸附态复合物的稳定结构,C2-C5烯烃用C1-C2-R3-R(R3代表H或C3;R代表H、CH3、C2H5基团)通式来表示,其示意图见图2.对应的主要结构参数列于表4(其中Et-ZSM表示乙烯复合物、Pr-ZSM表示丙烯复合物、Bu-ZSM表示1-丁烯复合物、Pe-ZSM表示1-戊烯复合物).对于乙烯来说,酸性质子H1与双键两端的碳原子距离分别为R(C1—H1)=0.2639 nm和R(C2—H1)=0.2754 nm,二者差约为0.0115 nm;而对于丙烯、1-丁烯和1-戊烯来说,对应的R(C1—H1)与R(C2—H1)距离差增大,在0.0242-0.0429 nm范围内,表明碳链增长不对称作用更加明显.与HY分子筛比,吸附分子与酸性位的距离明显增大,例如,Et-ZSM中的R(C1—H1)比Et-HY中的R(C1—H1)增大了0.0358 nm,R(C2—H1)增大了0.0445 nm;Bu-ZSM中的R(C1—H1)比Bu-HY中的增大了0.0595 nm,R(C2—H1)增大了0.0765 nm,这与采用ONIOM方法研究的苯在HZSM-5和H-FAU分子筛上的吸附情况相同[39].主要是由于ZSM-5分子筛的孔径远小于HY分子筛,孔道空间立体结构和吸附分子的大小限制了吸附分子向酸性位的靠近.同时也说明小孔径ZSM分子筛孔道内具有更强的局域效应.ZSM分子筛形成的超分子复合物的结构参数也与独立的簇模型和烯烃的结构参数相似,表明烯烃在ZSM分子筛上的π吸附也是一种弱的作用.由于ZSM分子筛中的吸附分子与酸性位的距离比HY分子筛中的增大了很多,因此C═C和R(H1—O1)键拉长的幅度要小, C═C双键仅拉长了约0.0003 nm,R(H1—O1)键拉长了约0.0005 nm.这意味着随着分子筛孔径的减小,吸附分子的π配位作用减弱,而孔道的范德华作用增强.
表5给出了C2-C5烯烃在H-ZSM-5分子筛上的吸附能.乙烯、丙烯、1-丁烯和1-戊烯的吸附能分别为51.59、73.65、102.96和125.89 kJ·mol-1.文献报道的采用相同方法计算的乙烯、1-丁烯在H-ZSM-5的46T簇模型上吸附能分别为45.06和71.71 kJ· mol-1[40].而本文采用88T簇模型计算的吸附能均高于46T簇模型,也许小的簇模型仍然没有很好地反映范德华作用.由烯烃在H-ZSM-5分子筛上的吸附能的变化可以看出,随着碳链的增长烯烃的吸附能增加,每增加一个CH2基团吸附能增加的量约为常数(约25 kJ·mol-1),这个现象与HY分子筛的结果相似,但吸附能增加量要比HY分子筛(约12 kJ·mol-1)的大.烯烃在H-ZSM-5分子筛上的吸附能要比HY分子筛大:对于乙烯、丙烯、丁烯和戊烯来说,吸附能分别高出17.08、26.05、43.46和56.64 kJ·mol-1.这个现象与实验报道的己烷在H-ZSM-5分子筛上的吸附能((86±6)kJ·mol-1)大于在HY分子筛上的吸附能((50±3)kJ·mol-1)[51]的结果是一致的,也与采用ONIOM方法研究的苯在H-ZSM-5和H-FAU分子筛上的吸附能变化情况相同[39],表明分子筛的孔径越小其微孔作用越强.从吸附能的变化可知烯烃碳原子数越多,分子筛的骨架结构对它的吸附能影响越大,分子筛孔径减小,吸附能增加.进一步说明了分子筛的骨架结构对吸附物种有着重要的影响,从而影响反应分子的活性.这也在一定程度上反映了为什么不同种类的分子筛具有不同的活性和选择性.此外,可以看出乙烯在H-ZSM-5上的吸附能远大于在HY上的吸附能,这说明除了孔道大小对吸附能的影响外,因为H-ZSM-5分子筛的酸强度比HY分子筛大,进而导致在H-ZSM-5上的吸附能增加较大.理论研究也表明酸强度增大吸附能增加[31].因此,吸附能的变化一方面主要是由于不同类型的分子筛其微孔结构产生的范德华作用是不同的,这种作用随孔径减小而增强,另一方面分子筛的酸强度对吸附能的影响也许是不容忽视的.
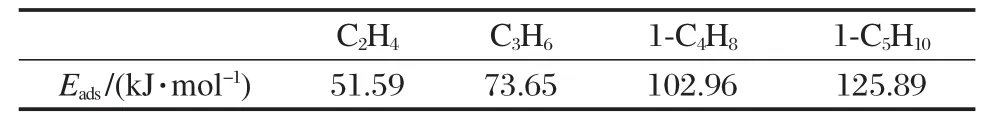
表5 C2-C5直链烯烃在H-ZSM-5分子筛上的吸附能Table 5 Adsorption energies of linear C2-C5alkenes on H-ZSM-5 zeolites
2.3 吸附复合物的前线轨道
复合物的分子轨道中与催化反应最有直接意义的是前线轨道,即最高占据轨道(HOMO)和最低未占据轨道(LUMO).表6给出了C2-C5烯烃吸附在HY和H-ZSM-5分子筛上的吸附复合物的前线轨道能量(EHOMO和ELUMO)及它们的能级差(Eg).HOMO与LUMO能级差的大小反映了电子从占据轨道向空轨道发生跃迁的能力,在一定程度上代表分子参与化学反应的能力.从HOMO到LUMO的电子激发需要较少能量的复合物在催化作用时要容易些.比较表6中的数据发现,对于HY分子筛,吸附复合物轨道能级差Eg相近,都约为0.234 a.u.;而对于HZSM-5分子筛,随着碳链的增长,吸附复合物轨道能级差Eg表现出小幅度的增加.上述现象表明分子筛孔道大小影响着烯烃的吸附性质.HY分子筛因其孔径较大,它的骨架结构也就是远程作用相对较弱,所以对短链烯烃分子的吸附影响较小,而HZSM-5分子筛孔径较小,它的远程作用相对较强,所以对短链烯烃分子的吸附影响明显些.此外,对于同种烯烃来说,H-ZSM-5分子筛复合物的轨道能级差略高于HY分子筛复合物(约为0.01 a.u.),从轨道的角度,这意味着烯烃在H-ZSM-5分子筛的活性略低于HY分子筛,这与前面的结构参数分析中HZSM-5分子筛的酸性位与吸附分子距离明显大于HY分子筛的结果是一致的,因距离增大电子跃迁阻力势必加大.但实际上针对不同的催化反应H-ZSM-5和HY分子筛表现的活性并不一定是符合轨道分析结果,因为不同的反应过程还受到吸附能的大小、电荷变化等因素的影响,需计算具体的反应机理才能确定不同种类分子筛催化活性的大小.
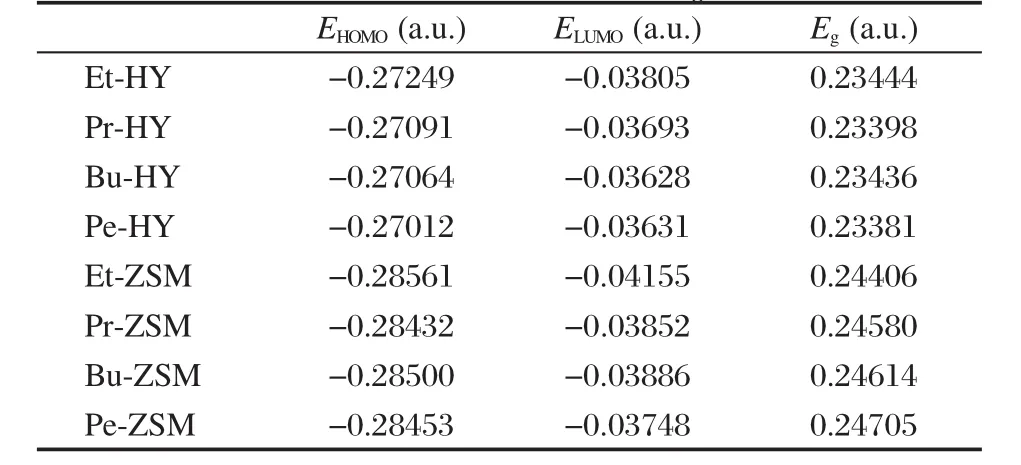
表6 分子筛吸附复合物前线轨道能量(EHOMO和ELUMO)及HOMO-LUMO能级差(Eg)Table 6 Frontier orbital energies(EHOMOand ELUMO)of the adsorption complexes on zeolites and HOMOLUMO energy gaps(Eg)
3 结 论
采用ONIOM分层计算方法,研究了C2-C5烯烃在孔道结构不同的HY和H-ZSM-5分子筛上的吸附性质.计算结果表明:烯烃分子在同一类型分子筛上的吸附能随着碳链的增长而增加,这个增加量近似为一个常数,与烷烃在分子筛上的吸附表现出相似的规律.不同类型的分子筛因其微孔结构不同,从而产生的范德华作用是不同的,影响了吸附复合物的微观结构以及吸附能,表现出吸附分子与小孔径H-ZSM-5分子筛酸性位的距离要远大于吸附分子与大孔径的HY分子筛酸性位的距离,H-ZSM-5分子筛上的吸附能比HY分子筛的大,而且碳原子数越多,这种影响越大.前线轨道分析表明,随着烯烃碳原子数的增加,小孔径H-ZSM-5分子筛的吸附复合物轨道能级差小幅度增加,而大孔径HY分子筛的吸附复合物轨道能级差都接近0.234 a.u..这意味着随着碳链增长H-ZSM-5分子筛对其催化活性有减弱的趋势,而HY分子筛对其催化活性影响不大.
1 Derouane,E.G.;Andre,J.M.;Lucas,A.A.J.Catal.,1988,110: 58
2 Madeira,F.F.;Gnep,N.S.;Magnoux,P.;Maury,S.;Cadran,N. Appl.Catal.A,2009,367:39
3 Derouane,E.G.;Chang,C.D.Microporous Mesoporous Mat., 2000,35-36:425
4 Derouane,E.G.J.Mol.Catal.A,1998,134:29
5 Kontnik-Matecka,B.;Górska,M.;Eysymontt,J.;Sałek,A.J.Mol. Struct.,1982,80:199
6 White,J.L.;Beck,L.W.;Haw,J.F.J.Am.Chem.Soc.,1992, 114:6182
7 Kondo,J.N.;Domen,K.J.Mol.Catal.A,2003,199:27
8 Cant,N.W.;Hall,W.K.J.Catal.,1972,25:161
9 Yoda,E.;Kondo,J.N.;Domen,K.J.Phys.Chem.B,2005,109: 1464
10 Gee,J.C.;Prampin,D.S.Appl.Catal.A,2009,360:71
11 Spoto,G.;Bordiga,S.;Ricchiardi,G.;Scarano,D.;Zecchina,A.; Borello,E.J.Chem.Soc.Faraday Trans.,1994,90:2827
12 Barrer,R.M.J.Colloid Interface Sci.,1966,21:415
13 Maesen,T.L.M.;Beerdsen,E.;Calero,S.;Dubbeldam,D.;Smit,B.J.Catal.,2006,237:278
14 Webster,C.E.;Cottone III,A.;Drago,R.S.J.Am.Chem.Soc., 1999,121:12127
15 Möller,A.;Guimaraes,A.P.;Gläser,R.;Staudt,R.Microporous Mesoporous Mat.,2009,125:23
16 Frash,M.V.;Kazansky,V.B.;Rigby,A.M.;van Santen,R.A. J.Phys.Chem.B,1998,102:2232
17 Rigby,A.M.;Frash,M.V.J.Mol.Catal.A,1997,126:61
18 Zheng,X.;Blowers,P.J.Mol.Catal.A,2006,246:1
19 Nieminen,V.;Sierka,M.;Murzin,D.Y.;Sauer J.J.Catal.,2005, 231:393
20 Khaliullin,R.Z.;Bell,A.T.;Kazansky,V.B.J.Phys.Chem.A, 2001,105:10454
21 Banach,E.;Kozyra,P.;Rejmak,P.;Brocławik,E.;Datka,J.Catal. Today,2008,137:493
22 Kasuriya,S.;Namuangruk,S.;Treesukol,P.,Tirtowidjojo,M.; Limtrakul,J.J.Catal.,2003,219:320
23 Maihom,T.;Boekfa,B.;Sirijaraensre,J.;Nanok,T.;Probst,M.; Limtrakul,J.J.Phys.Chem.C,2009,113:6654
24 Kalita,B.;Deka,R.C.J.Phys.Chem.C,2009,113:16070
25 Namuangruk,S.;Khongpracha,P.;Pantu,P.;Limtrakul,J.J.Phys. Chem.B,2006,110:25950
26 Clark,L.A.;Sierka,M.;Sauer,J.J.Am.Chem.Soc.,2003,125: 2136
27 Boronat,M.;Viruela,P.M.;Corma,A.J.Am.Chem.Soc.,2004, 126:3300
28 Zheng,A.M.;Chen,L.;Yang,J.;Zhang,M.J.;Su,Y.C.;Yue,Y.; Ye,C.H.;Deng,F.J.Phys.Chem.B,2005,109:24273
29 Zheng,A.M.;Chen,L.;Yang,J.;Yue,Y.;Ye,C.H.;Lu,X.;Deng, F.Chem.Commun.,2005:2474
30 Zheng,A.M.;Wang,L.;Chen,L.;Yue,Y.;Ye,C.H.;Lu,X.; Deng,F.ChemPhysChem,2007,8:231
31 Wang,S.P.;Wang,Y.L.;Cao,L.;Xing,S.Y.;Zhou,D.H.Chin. J.Catal.,2009,30:305 [王善鹏,王伊蕾,曹 亮,邢双英,周丹红.催化学报,2009,30:305]
32 Olson,D.H.;Dempsey,E.J.Catal.,1969,13:221
33 van Koningsveld,H.;van Bekkum,H.;Jansen,J.C.Acta Crystallogr.B,1987,43:127
34 Parr,R.G.;Yang,W.Density-functional theory of atoms and molecules.Oxford:Oxford University Press,1989:1-325
35 Becke,A.D.Phys.Rev.A,1988,38:3098
36 Lee,C.;Yang,W.;Parr,R.G.Phys.Rev.B,1988,37:785
37 Pantu,P.;Boekfa,B.;Limtrakul,J.J.Mol.Catal.A,2007,277: 171
38 Bobuatong,K.;Limtrakul,J.Appl.Catal.A,2003,253:49
39 Rungsirisakun,R.;Jansang,B.;Pantu,P.;Limtrakul,J.J.Mol. Struct.,2005,733:239
40 Namuangruk,S.;Tantanak,D.;Limtrakul,J.J.Mol.Catal.,2006, 256:113
41 Froese,R.D.J.;Morokuma,K.Chem.Phys.Lett.,1999,305:419
42 Froese,R.D.J.;Morokuma,K.J.Phys.Chem.A,1999,103:4580
43 Vreven,T.;Morokuma,K.J.Chem.Phys.,1999,111:8799
44 Vreven,T.;Morokuma,K.J.Phys.Chem.A,2002,106:6167
45 Frisch,M.J.;Trucks,G.W.;Schlegel,H.B.;et al.Gaussian 03. Revision B.04.Pittsburgh,PA:Gaussian Inc.,2003
46 Kondo,J.N.;Domen,K.;Wakabayashi,F.Microporous Mesoporous Mat.,1998,21:429
47 Mortier,W.J.Stud.Surf.Sci.Catal.,1988,37:253
48 Datka,J.;Boczar,M.React.Kinet.Catal.Lett.,1993,51:161
49 Benco,L.;Hafner,J.;Hutschka,F.;Toulhoat,H.J.Phys.Chem.B, 2003,107:9756
50 van Bokhoven,J.A.;Williams,B.A.;Ji,W.;Koningsberger,D.C.; Kung,H.H.;Miller,J.T.J.Catal.,2004,224:50
51 Babitz,S.M.;Williams,B.A.;Miller,J.T.;Snurr,R.Q.;Haag,W. O.;Kung,H.H.Appl.Catal.A,1999,179:71
Adsorption of Linear C2-C5Olefins on HY and H-ZSM-5 Zeolites
GUO Yu-Hua1,*PU Min2CHEN Biao-Hua2
(1Huzhou Teachers College,Huzhou 313000,Zhejiang Province,P.R.China;2State Key Laboratory of Chemical Resource Engineering,Beijing University of Chemical Technology,Beijing 100029,P.R.China)
The adsorption properties of linear C2-C5olefins on HY and H-ZSM-5 zeolites were studied by the ONIOM(B3LYP/6-311++G(d,p):UFF)method.The results indicate that microcosmic interactions of the olefin molecules with the Brønsted acid sites of the zeolites lead to the formation of π-complexes.The adsorption energies of olefins on zeolites increase with an increase in the number of carbon atoms,and the amount of increase is approximately constant (HY zeolites:ca 12 kJ·mol-1;H-ZSM-5 zeolites:ca 25 kJ·mol-1),which agrees well with the adsorption properties of alkanes on zeolites.The position of the double bond has a fairly large effect on the adsorption energies of olefins.The adsorption energies of 2-olefins are much higher than those of 1-olefins.The adsorption energies of olefins on the different types of zeolites also show a significant difference.The adsorption energies of olefins on small pore H-ZSM-5 zeolites are much larger than those on large pore HY zeolites.Furthermore,the confinement effect in the different types of zeolites is more obvious when the number of carbon atoms increase.From the microstructure,the distance between the adsorbent molecule and the acidic proton in the H-ZSM-5 zeolite is much bigger than that between the adsorbent molecule and the acidic proton in the HY zeolite.These are mainly attributed to differences in the van der Waals interactions for the different types of zeolites,and the small pore zeolites have much stronger van der Waals interactions.Frontier orbital calculations indicate that the catalytic activity of the large pore HY zeolite is similar for small olefins while the catalytic activity of the small pore H-ZSM-5 zeolite decreases slightly with increasing carbon number.
Adsorption;Olefin;Zeolite;ONIOM
O641
Received:February 2,2010;Revised:May 9,2010;Published on Web:July 2,2010.
*Corresponding author.Email:guoyuhua@hutc.zj.cn;Tel:+86-572-2321166.
The project was supported by the National Key Basic Research Program of China(973)(2004CB217804).
国家重点基础研究发展规划项目(973)(2004CB217804)资助
ⒸEditorial office of Acta Physico-Chimica Sinica