高效毛细管电泳同时分离多种酚类物质
周胜男檀华蓉李 慧陆 宁
(安徽农业大学茶与食品科技学院1,合肥 230036)
(安徽农业大学生物技术中心2,合肥 230036)
(安徽农业大学动物科技学院3,合肥 230036)
高效毛细管电泳同时分离多种酚类物质
周胜男1檀华蓉2李 慧3陆 宁1
(安徽农业大学茶与食品科技学院1,合肥 230036)
(安徽农业大学生物技术中心2,合肥 230036)
(安徽农业大学动物科技学院3,合肥 230036)
建立了高效毛细管电泳同时分离测定芦丁、槲皮素、绿原酸、咖啡酸、没食子酸和原儿茶酸 6种酚类物质的分析方法。考察了缓冲液种类、离子浓度和 pH、分离电压、运行温度等电泳参数,确立了最佳的电泳条件:缓冲液为 20 mmol/L磷酸二氢钠 -20 mmol/L硼砂,pH7.5,分离电压为 20 kV,运行温度为 30℃,紫外检测波长 214 nm。结果表明,6种物质在 12 min内得到完全分离,且各组分质量浓度与峰面积呈良好的线性关系,R2为 0.998 7~0.987 4。方法精密度试验中,迁移时间的 RSD为 0.280%~0.425%,峰面积的 RDS为 5.228%~8.506%,回收率为 85.11%~101.98%。该法快速、简便、准确,具有较高的灵敏度。
高效毛细管电泳 同时分离 酚酸类
酚类化合物属于植物次生代谢产物,是多羟基酚类化合物的总称。它存在于包括马铃薯等许多植物组织中[1]。按结构可分为酚酸类、类黄酮类及 1,2-二苯乙烯和木酚素类[2]。多酚类物质参与植物生长繁殖过程,协助植物防御病原、天敌等侵害。在防病保健方面,多酚化合物尤其是以绿原酸为主的酚酸类物质具有利胆保肝、抗病毒、抑制突变、抗肿瘤、抗氧化、抗动脉硬化、防治冠心病与中风等心脑血管疾病以及抗菌等多种生理功能[3]。随着天然产物开发的逐渐兴起,植物多酚以其在植物界分布的广泛性、生理功能的多样性以及来源丰富性等特点,逐渐成为当前研究的热点,被形象地称为“一座有待开发的金矿”[4]。
目前,在酚类物质的分离测定方面,国内外主要是经薄层分离后用紫外进行检测的方法[5-7]。此方法涂层工序繁琐,分离效果欠佳,且不利于大量样品的检测和自动化连续检测。随着科技的进步,也逐步采用高效液相色谱[8-9],GC-MS等方法,虽然自动化程度高,但仪器昂贵,测试成本高,分析时间相对较长。毛细管电泳是上世纪 80年代发展起来的分离分析技术[10-11],是一类以毛细管为分离通道、以高压直流电场为驱动力的新型色谱分离技术。该方法具有分离效率高,分离速度快,分析化合物种类广泛,重现性好、样品和试剂用量少等优点[12],是一种高效的分离分析技术,相对成本较低,且是一种绿色环保的检测方法,在分析领域引起极大关注,发展迅猛。国内外运用毛细管电泳对芦丁,槲皮素,绿原酸等的分析较多[13-14],但对黄酮和多种酚、酸类的同时分离未见报道。本研究采用毛细管胶束电泳方法同时对芦丁、槲皮素、绿原酸、咖啡酸、没食子酸和原儿茶酸 6种酚类物质进行分离,主要研究缓冲液种类、离子浓度和 pH、分离电压、运行温度等电泳参数对分离效果的影响。
1 材料与方法
1.1 仪器
P/ACET MMDQ毛细管电泳仪 (配有二极管阵列PDA检测器和色谱工作站):美国 Beckman公司;75 μm×65 cm未涂层熔融石英毛细管:河北永年与锐伴色谱器件有限公司;KQ-250DE数控超声波清洗器:上海昆山市超声仪器有限公司;0.45μm微孔滤膜:上海半岛实业有限公司净化器材厂。
1.2 药品与试剂
芦丁、槲皮素、绿原酸、原儿茶酸、没食子酸、咖啡酸:中国药品生物制品检定所;四硼酸钠 (硼砂)、磷酸二氢钠、甲醇等分析纯试剂。
1.3 溶液的配制
1.3.1 缓冲液的配制
准确称取硼砂0.762 7 g,超纯水定容至100 mL,制成 20 mmol/mL硼砂缓冲液;准确称取磷酸二氢钠0.312 0 g,超纯水定容至 100 mL,制成 20 mmol/mL磷酸二氢钠缓冲液;取两种溶液混合,摇匀,pH计测定 pH值,分别制备 pH 7.0、7.5、8.0、8.5的缓冲溶液,用直径 0.45μm滤膜过滤后,备 1用。
1.3.2 标样的制备
准确配制各标准溶液:绿原酸0.5 mg/mL,咖啡酸1.25 mg/mL,芦丁、槲皮素、没食子酸和原儿茶酸各1.0 mg/mL。取上述质量浓度的绿原酸 0.7 mL,咖啡酸0.28 mL,芦丁、槲皮素、没食子酸和原儿茶酸各0.35 mL,混合配置成混合液 (各标品质量浓度为 147 μg/mL)。再将混合液用 80%甲醇倍倍稀释(依次吸取前一混合液 100μL,加入100μL 80%甲醇),得到6个质量浓度梯度 (73.5、36.75、18.375、9.187 5、4.593、2.297μg/mL)的混合液,存放于冰箱中备用。
1.3.3 样液的制备
市售马铃薯洗净晾干,切块于 55℃热风干燥至干,粉碎过 60目筛,取适量马铃薯干粉加入 70%乙醇水溶剂,料液比为 1︰ 12,超声提取 3次,每次 40 min。合并提取液浓缩,用直径 0.45μm滤膜过滤,冰箱保存备用。
1.4 电泳条件
毛细管柱在每次使用前依次用 0.1 mol/L氢氧化钠溶液、超纯水和电泳缓冲液各冲洗 10 min,两次进样间用 0.1 mol/L NaOH、超纯水和缓冲液分别冲洗毛细管 3、3、4 min,以保证其重现性。缓冲体系为20 mmol/L磷酸氢二钠 -硼砂缓冲液,pH 7.5, 3447.5 Pa,压力进样 5 s,在电压 20 kV、柱温 30℃下分离,于 214 nm波长处检测。
2 结果与讨论
2.1 检测波长的确定
如图 1所示,经紫外检测器在 190~400 nm波长范围内扫描,绿原酸和咖啡酸的特征吸收峰为 300~360 nm,芦丁、槲皮素、没食子酸和原儿茶酸的特征吸收峰为 200~220 nm,6种物质在 214 nm处都有较强吸收,所以选定 214 nm为最佳检测波长。
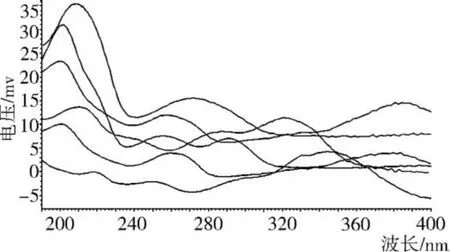
图1 混合标样的紫外特征吸收峰图
2.2 缓冲体系的选择
由于毛细管电泳的驱动力实际上是管内的电渗流[15],即毛细管中的溶剂因轴向直流电场作用而发生的定向流动。电渗流过大将引起样品区带变宽,降低分离效果。缓冲溶液的种类、浓度及体系 pH值对电渗流有直接影响,在同一缓冲体系中,电渗流将随浓度的增加而降低。
2.2.1 电泳缓冲液种类的选择
缓冲溶液背景电解质的选择对毛细管区带电泳分离效果有十分明显的影响。如图 2所示,本试验在同一离子浓度 (20 mmol/L)和 pH(8.0)等条件下考察了 4种不同的缓冲体系:硼砂 -磷酸二氢钠、硼砂 -硼酸、磷酸氢二钠 -磷酸二氢钠、磷酸氢二钠 -硼酸缓冲体系。
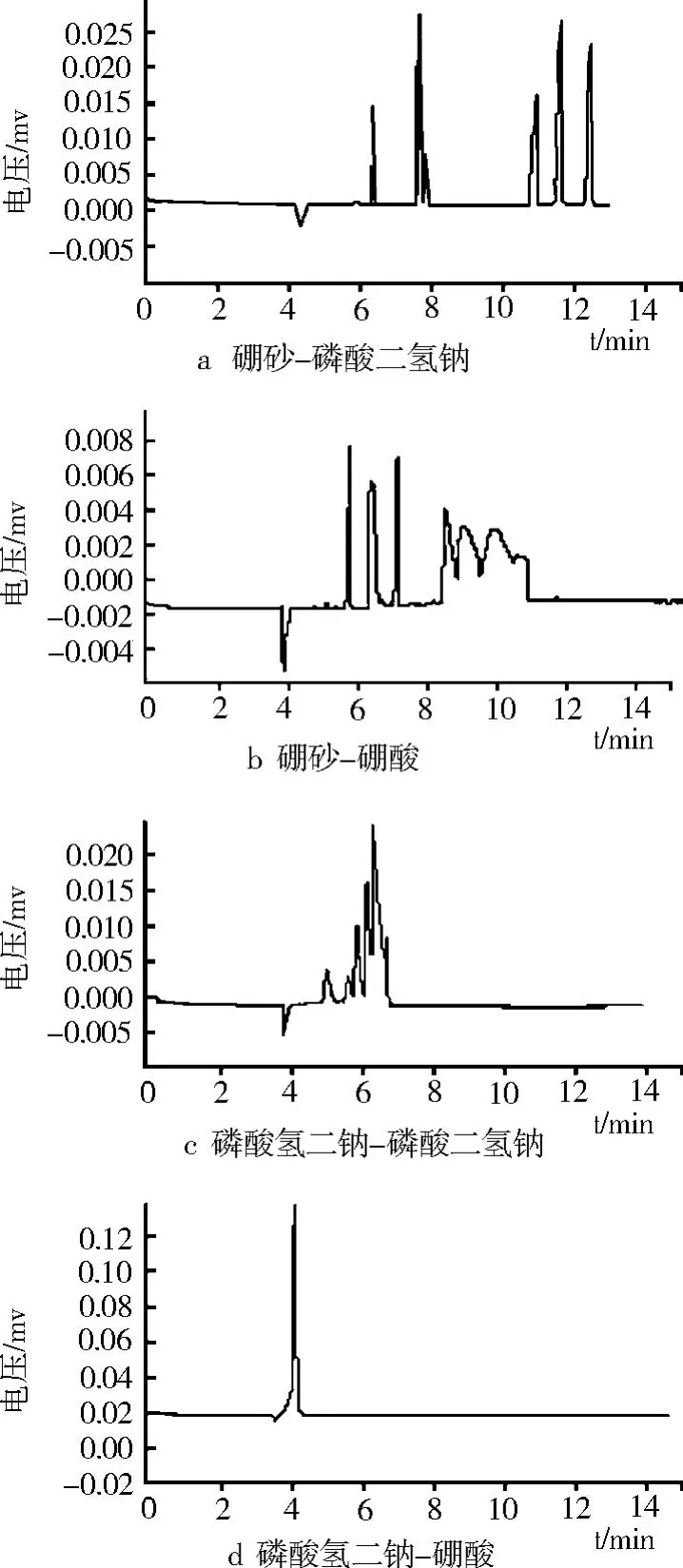
图2 不同缓冲液类型的毛细管电泳图谱
研究结果表明,硼砂 -磷酸二氢钠缓冲液分离效果较好,峰形较佳;硼砂 -硼酸缓冲液体系前 3峰分离效果较好,但后 3峰峰形较差且峰拖尾明显;磷酸氢二钠 -磷酸二氢钠缓冲体系分离效果较差,峰拖尾较严重;磷酸氢二钠 -硼酸缓冲体系完全无法分离各组分。综合考虑迁移时间与分离度的影响,硼砂 -磷酸二氢钠缓冲液有较好的分离趋势。因此,选择硼砂 -磷酸二氢钠作为试验的运行缓冲液。
2.2.2 电泳缓冲液离子浓度的选择
如图 3所示,试验过程中选择了 20、30、40 mmol/L三个离子浓度的硼砂 -磷酸二氢钠缓冲体系。试验结果表明,缓冲液离子浓度对峰形和迁移时间有一定的影响,随着离子浓度的增大,各组分的迁移时间延长,色谱峰变宽。当离子浓度为 20 mmol/L时,最后一个组分原儿茶酸的出峰时间 11. 988 min;而当离子浓度增大为 40 mmol/L时,最后一个组分原儿茶酸的出峰时间为 13.989 min。这可能由于缓冲液离子浓度增大导致溶液黏度增大,同时也引起毛细管内壁与溶液间的双电层厚度减小,使电渗流减小,从而使各组分的迁移时间延长。综合考虑迁移时间和峰形等因素,选择 20 mmol/L作为分离的最佳离子浓度。
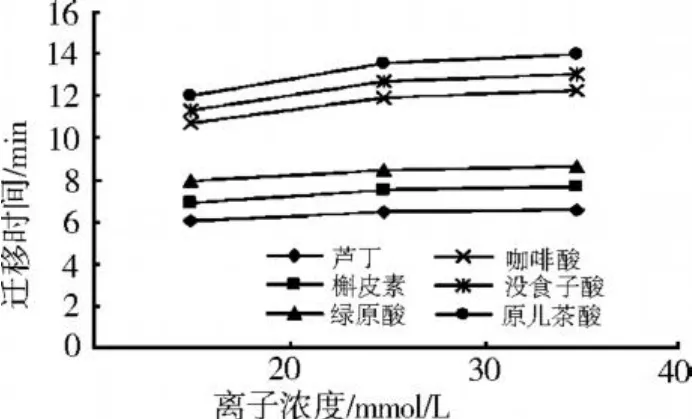
图3 缓冲液离子浓度对迁移时间的影响
2.2.3 电泳缓冲液 pH的选择
用毛细管电泳方法对物质的分离是因组分的离子淌度[16](所谓离子淌度,即指溶质离子在单位时间间隔内和单位电场下移动的距离)不同所致,离子的淌度与其有效电荷成正比,而离子的有效电荷易受操作缓冲溶液 pH值的影响。因而,缓冲溶液 pH值的调节与控制是优化分离的重要因素。
如图 4所示,在 20 mmol/L硼砂 -20 mmol/L Na2HPO4缓冲液条件下,分别调至 pH7.0、7.5、8.0、8.5。研究结果表明,随 pH的升高,毛细管内层表面的负电荷减少,电渗流减小,迁移时间相应延长。当pH 7.0时,后 3峰分离度较低,分离效果不好;当 pH 8.0时,槲皮素和绿原酸的分离效果较差;而当 pH 8.5时,虽然分离度较好,但迁移时间较长。综合考虑迁移时间和各组分的分离度,选定 pH值为 7.5时分离效果较好。
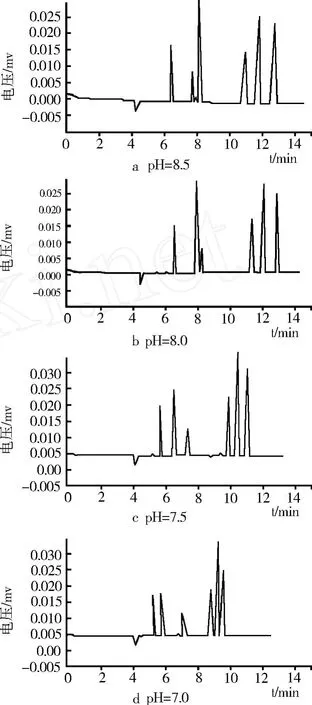
图4 缓冲液pH对各组分分离度的影响
2.3 正交试验
为了进一步优化最佳分离分析条件,在前面试验的基础上采用正交试验设计,将缓冲体系的 pH、电泳的电压和温度作为3个因素,每个因素选取3个数量位级(水平),即三因素三水平试验确定缓冲体系(如表1所示)。

表1 正交试验因素水平表
由于毛细管电泳具有能在较短时间内达到最佳分离效果的优点,根据正交设计表L9(34)的各因素水平配置的方案(见表 2),本试验分析了各组试验条件下,完成分离的迁移时间及两个色谱峰之间的最低分离度。
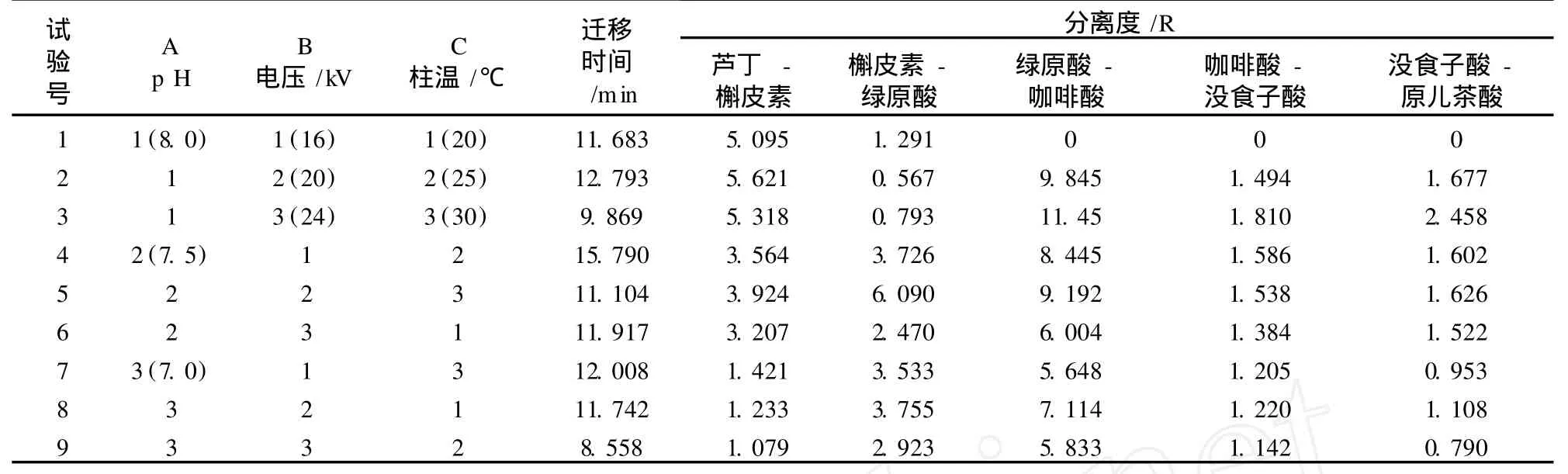
表 2 正交试验表(L934)
高效毛细管电泳测定多种物质的关键性分离指标是分离度 R。通常情况下,认为 R>1.5即完全分离。若所有分离度 R均大于 1.5,则迁移时间越短越好。标准混合液的毛细管电泳图如图 5所示,由分析结果可知,只有第 4组和第 5组试验的分离度 R> 1.5,但第 4组的迁移时间较长。综合考虑分离度、迁移时间的因素,选择第 5组即 pH 7.5,电压 20 kV,运行温度 30℃作为最佳电泳分离条件。
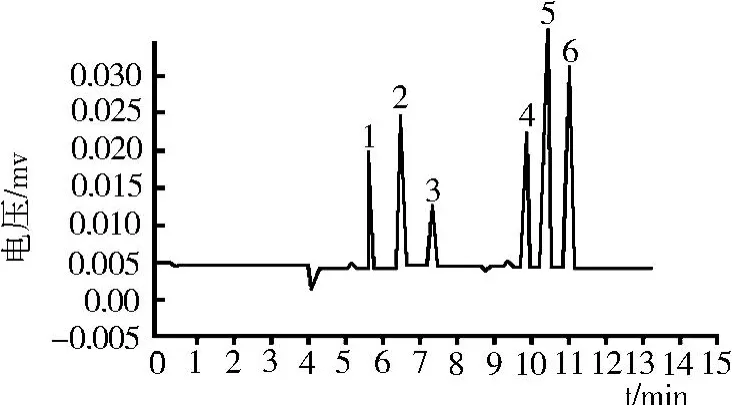
图5 标准混合液的毛细管电泳图
2.4 研究方法的评估
2.4.1 标准曲线及线性范围确定
如表 3所示,在选定的条件下,以质量浓度由小到大的次序分别进样 2.297、4.594、9.187 5、18.375、36.75、73.5μg/mL的标准工作液,按上述电泳条件进行分析,得到待测离子的峰面积,以质量浓度为横坐标,以相应峰面积为纵坐标做回归分析,得到标准曲线和回归方程。分析结果表明,6组分线性关系良好,相关系数为 0.998 7~0.987 4。
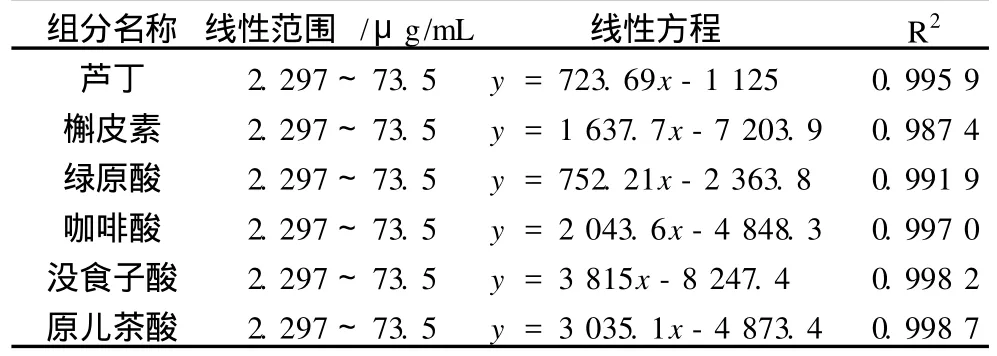
表 3 线性范围和回归方程
2.4.2 方法精密度研究
分析方法的重复性是评价其保持不受参数微小偏差影响的能力,可作为正常使用的一个可靠性指标。如表 4所示,在上述优化条件下 (即:缓冲液为20 mmol/L磷酸二氢钠 -20 mmol/L硼砂,pH 7.5,分离电压为 20 kV,运行温度为 30℃,紫外检测波长214 nm),取 36.75μg/mL混合标准溶液连续进样 6次,考察各组分的迁移时间和校正峰面积的重复性。峰面积和迁移时间的相对标准偏差分别小于8.506%和 0.425%。
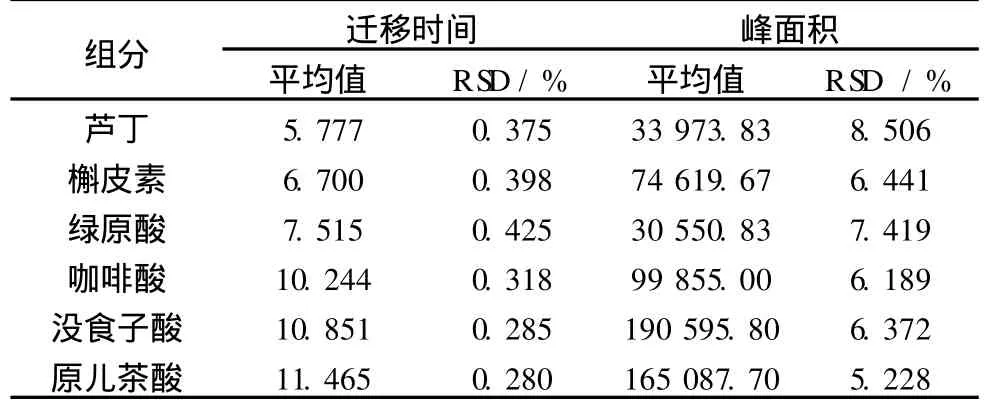
表 4 分析组分迁移时间和峰面积的精密度(n=6)
2.4.3 方法回收率研究
准确度验证采用添加回收率法进行试验。取100μL已知浓度的样品三份,分别于其中加入 73.5、36.75、18.375μg/mL标准品混合溶液各 100μL,测定样品。加标样品的含量减去未加标样品的含量即为实测添加量。实测添加量与标准添加量之比为回收率。通过试验,测得芦丁、槲皮素、绿原酸、咖啡酸、没食子酸和原儿茶酸 6种酚类的回收率分别为97.73%、90.57%、93.60%、85.11%、100.17%、101.98%,RDS分别为 0.24%、0.11%、0.40%、0.19%、0.17%、0.16%,结果令人满意。
2.5 样品的测定
在最佳分离条件下,分离检测样品,计算酚酸类物质的含量(见图 6)。从图 6中可以很明显的看出,马铃薯酚类物质主要为绿原酸和咖啡酸两种。
马铃薯中酚类物质含量如表 5所示,其中绿原酸含量为 330.18μg/g,咖啡酸含量为 89.33μg/g,马铃薯中酚类物质总含量为 419.51μg/g。
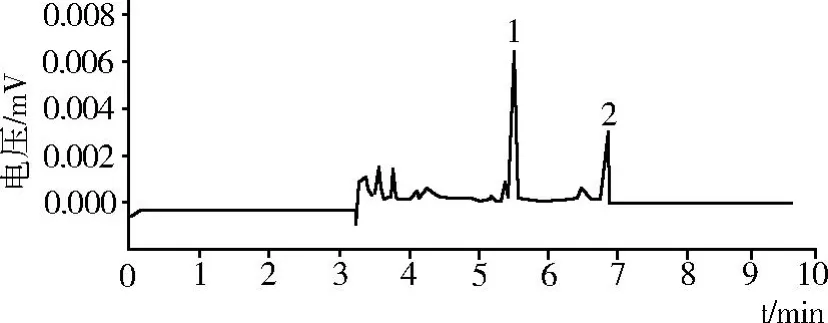
图6 样品液的毛细管电泳图

表5 酚类物质含量
3 结论
3.1 通过对电泳缓冲液类型、离子浓度和 pH值、分离电压、分离温度等电泳条件进行比较研究,确立了同时分离测定芦丁、槲皮素、绿原酸、咖啡酸、没食子酸和原儿茶酸 6种酚类物质的高效毛细管电泳方法,6种物质可在 12 min内得到完全分离。
3.2 研究并确立了最佳的电泳条件:缓冲液采用20 mmol/L磷酸二氢钠 -20 mmol/L硼砂,pH 7.5,分离电压 20 kV,运行温度 30℃,紫外检测波长214 nm。
3.3 本方法工作曲线线性关系良好、结果的准确度和精密度高,样品用量少,分析时间短,与其他分析方法相比较,高效毛细管电泳法操作更简便、快速,可在 12 min内同时分离 6种物质,大大减少了分析成本,为同时分离检定多种酚类物质提供了一个良好的方法。
[1]Deshpande S S,Sathe S K,Salunkhe D K.Chemistry and Safety of plant Polyphenols[J].In Nutritional and Toxico2 logicalAspects of Food Safety.Friedman M,Ed,plenum: NewYork,1984:457-495
[2]郭长江,韦京豫.食材新宠儿多酚类物质 [J].中国食品报,2004,3:40-41
[3]冯丽,宋曙辉.植物多酚种类及其生理功能的研究进展[J].江西农业学报,2007,10:105-107
[4]韩丙军,彭黎旭.植物多酚提取技术及开发现状[J].华南热带农业大学学报,2005,1:21-24
[5]吴文标.马铃薯块茎的 6-羟基 -7-甲氧基香豆素的分离和鉴定[J].马铃薯杂志,1999,4:79-80
[6]刘艳芳,马歌丽.薄层色谱—分光光度法测定葵花籽中的绿原酸[J].现代食品科技,2007,11:80-82
[7]HE Zhao-fan,ZHANG Di-qing.Health food chemisty and detection technology[M].Beijing:Chinese Light Industry Press,1998:124-125
[8]刘丽梅,李曼玲.HPLC法测定秦皮中香豆素类成分的含量[J].中草药,2004,7:819-822
[9]SylvesterN.Onyeneho andNavam S.Hettiarachchy.Antiox2 idant activityof durum wheat bran[J].JournalofAgricultur2 al and Food Chemistry 1992,40:1496-1500
[10]魏伟,王义明,罗国安.中成药成分的高效毛细管电泳分析[J].药学学报,1997,6:476-480
[11]王德先,赵敬湘,杨更亮等.毛细管区带电泳法测定中药金银花中绿原酸的含量[J].中草药,2000,6:432-433
[12]ZhimingLiu,Tao Li,Jie Li,et al.Detection ofmenadione sodium bisulfite(vitam in K3)by reversed-phase high perfor mance liquid chromatography with series dual-elec2 trode amperometric detector[J].Analytica Chi mica Acta, 1997,338:57-62
[13]VaherM,KoelM.Separation of polyhenolic compounds ex2 tracted from plant matrices using capillary electrophoresis [J].Journal of ChromatographyA,2003,990(1-2):225 -230
[14]Wang DX,Yang GL,Engelhardt H,et a1.Separation by capillary zone electrophoresis of the active anthraquinone components of the Chinese herb Polygonum multiflorum Thunb[J].Chromatographia,2001,53:185-186
[15]陈义.毛细管电泳技术及应用[M].北京:化学工业出版社,2000:14-15
[16]沈晓春,陈平,郭伟强,等.用毛细管电泳方法分离有机酸的研究[J].浙江大学学报:理学版,2002,29(6):679 -684.
Simultaneous Separation of Polyphenols by High Perfor mance Capillary Electrophoresis
Zhou Shengnan1Tan Huarong2Li Hui3Lu Ning1
(College of Tea and Food Seience and Techaology,AnhuiAgriculturalUniversity1,Hefei 230036)
(Biotechnology Center,AnhuiAgriculturalUniversity2,Hefei 230036)
(College ofAnimal Science,AnhuiAgriculturalUniversity3,Hefei 230036)
A high perfor mance capillary electrophoresismethod has been developed for the simultaneous sepa2 ration and deter mination of six phenolics of rutin、quercetin、chlorogenic acid、caffeic acid、gallic acid and protocate2 chuic acid.The effects of several factors such as the pH and concentration of running buffer,the separation voltage and the runnion tamperation on HPCE were investigated.Under optimum condition,the running buffer consisted of 20 mmol/LNaH2PO4-20 mmol/L sodium borate,pH 7.5,separation voltageat 20 kV,running temperation at 30℃, the UV detection wavelength was 214 nm.The results showed that the six analytes can be well separated within 12. 0 min,each one had a good linear relationship(R2=0.998 7~0.987 4).The RSD ofmigration time was 0.280%~0.425%and of the peak area was 5.228%~8.506%.The average recovery percentage was 85.11%~101.98%. The method is rapid,simple and accurate.
high herfor mance capillary electrophoresis,simultaneous separation,phenolic acids
O657.8;TS215 文献标识码:A 文章编号:1003-0174(2010)06-0114-06
2009-07-28
周胜男,女,1985年出生,硕士,农产品加工与贮藏
陆宁,女,1964年出生,教授,硕士生导师,食品及农产品贮藏与加工

