脂肪干细胞向软骨细胞诱导分化能力的研究
李宝军 ,邓展生 ,高嵩涛 ,郭晓柠 ,张胜利 ,沈民仁
(1.湖南省第二人民医院 骨关节外科,湖南 长沙 410007;2.中南大学湘雅医院 脊柱外科,湖南 长沙410008;3.河南省肿瘤医院 骨科,河南 郑州 450008)
关节软骨的自我修复能力十分有限,临床上由于创伤、肿瘤、感染以及退行性变等原因导致的关节软骨损伤和缺损尚无理想的修复方法[1],为矫形关节外科亟需解决的难题。组织工程学的兴起和不断发展,为利用组织工程化软骨进行软骨缺损修复带来了希望。目前,有关软骨组织工程种子细胞的研究以软骨细胞和骨髓间充质干细胞为主,随着组织工程学研究的不断深入,发现脂肪组织也是多能干细胞的来源之一,而脂肪干细胞(ADSC)和骨髓干细胞(BMSC)一样,具有多向分化潜能[2],且相对于骨髓基质干细胞具有来源广泛、易于获得、对机体影响小、并且可获得大量细胞等优点[3]。本实验以大鼠作为研究对象,探讨了脂肪干细胞体外提取并定向分化为软骨细胞的能力。
1 材料与方法
1.1 实验材料
正常成年健康SD大鼠,雌雄不限,质量80~120 g(由中南大学动物试验部提供,许可证号:沪SCXK2003-0003)。新生牛血清、低糖DMEM、高糖DMEM(Gibco,American);TGF-β1(Cellcience,Australia);胰岛素,转铁蛋白,地塞米松和维生素C、胰酶、胶原酶 I型(Sigma,American);抗 II型胶原多克隆山羊抗体(Cellcience,Australia),生物素化抗山羊IGg和DAB显色试剂盒(北京中山金桥公司);aggrecan兔抗大鼠多克隆抗体(Santa Cruz,Australia),辣根酶标记抗兔IGg和FITC标记抗兔IGg(北京中山金桥公司);组织细胞总RNA提取试剂Trizol(MRC,American)、RT反应试剂盒、PCR 反应试剂盒(MBI,American)。
1.2 方法
1.2.1 ADSC的分离、培养 SD大鼠(80~120 g),断颈处死;75%的酒精浸泡5min;无菌条件下取双侧腹股沟脂肪,PBS充分冲洗,剪碎至1mm3大小碎块;予0.075%I型胶原酶在37℃振荡消化40~50 min;等量的含10%新生牛血清的低糖DMEM培养基终止消化,于200目滤网过滤以去除大块未消化脂肪组织,1 300 r/min离心10min,去上清;PBS重悬细胞洗涤,200目滤网再过滤,1 300 r/min离心10 min,去上清;含10%新生牛血清的DMEM培养基(含青霉素100μ/mL,链霉素100μg/mL)重悬细胞,取样行台盼蓝染色拒染,计算细胞数量和活力,以106/100mm2培养板底面积种植活力细胞,在37℃、5%二氧化碳、饱和湿度条件下培养。经2~3d换液1次,细胞增殖、铺满至培养瓶底约80%,接近融合状态时,予0.25%胰酶消化传代。
1.2.2 ADSC的成软骨诱导 收集传5代ADSC,含10%新生牛血清的低糖DMEM培养基重悬细胞,调整密度为1.5×107/mL,予10μL/滴在24孔培养板内。进行“微团”培养后1 d,换用含1%新生牛血清、10 ng/mL的 TGF-β1、6.25μg/mL的胰岛素、6.25μg/mL的转铁蛋白、10-7M的地塞米松、50 μg/mL的维生素C的高糖DMEM作为特定培养基进行诱导培养。
1.2.3 免疫组化染色和免疫荧光 在诱导7、14 d后,取细胞玻片经4%多聚甲醛固定,应用II型胶原蛋白免疫组化染色和aggrecan免疫荧光检测。①II型胶原蛋白免疫细胞化学染色:细胞玻片依次经3%H2O2灭活内源性过氧化氢酶15 min,PBS冲洗,10%正常兔血清封闭非特异性结合30 min,滴加1∶100的抗II型胶原多克隆山羊抗体湿盒内4℃过夜,PBS冲洗,滴加1∶100生物素标记的抗山羊IGg孵育15min,PBS冲洗,辣根酶标记链霉卵白素孵育15min,PBS冲洗,DAB显色,苏木素复染,中性树胶封片,光学显微镜下观察。②Aggrecan细胞免疫荧光:细胞玻片依次经3%H2O2灭活内源性过氧化氢酶15min,PBS冲洗,10%正常山羊血清封闭,室温孵育10~15min,倾去血清,勿洗,滴加1∶100稀释的aggrecan兔抗大鼠多克隆一抗,4℃孵育过夜,PBS冲洗,滴加1:100稀释的FITC标记抗兔Ig G二抗,37℃孵育30~60min,PBS冲洗,荧光显微镜下观察、拍照记录,50%甘油封片保存。
1.2.4 RT-PCR检测 在诱导 0、2和 4周后,RT-PCR检测ADSC前II型胶原蛋白、aggrecan和Sox9的mRNA基因表达情况。分别采用Trizol试剂盒提取细胞总RNA,RT试剂盒合成cDNA。采用Primer Premier 5.0设计引物,并经GeneBank验证。引物序列为:β-actin(上游5'-CGTTGACATCCGTAAAGAC-3',下游 5'-TGGAAGGTGGACAGTGAG-3’;201 bp);Col2a1(上游 5'-CAAGTCGCTGAACAACCAGA-3',下游 5'-GCCCTCATCTCCACATCATT-3’;320 bp);Agc1(上游 5'-TAGAGAAGAAGAGGGGTTAGG-3',下游 5'-AGCAGTAGGAGCCAGGGTTAT-3';322 bp);Sox9(上游 5'-CGGAACAGACTCACATCTCTCCTAATGC-3’,下游 5’-CGAAGGTCTCAATGTTGGAGATGACGTC-3’;292 bp)。根据设计引物进行PCR扩增合成DNA,反应条件:Col2a1(预变性 94℃5s;变性 94℃ 45 s,退火56℃ 45 s,延伸72℃ 50 s,循环30次;再延伸72℃7 min);Agc1(预变性 94℃5min;变性 94℃ 45 s,退火 54℃ 45 s,延伸72℃ 1min,循环 28次;再延伸 72℃ 7min);Sox9(预变性 94℃5min;变性94℃ 45 s,退火 54℃ 45 s,延伸 72℃1min,循环32次;再延伸72℃ 7min)。PCR产物在1.5%的琼脂糖凝胶电泳中进行鉴定。
2 结果
2.1 ADSC诱导后形态特征
5代ADSC形态均一,呈长梭形,接近融合状态时可呈漩涡样生长,细胞之间可见零星脂滴存在(图1)。诱导2 d后,细胞形态由梭型渐变为三角形、多角形、短梭形,细胞增殖明显减缓,呈聚集生长,基质分泌,形成有结节(图2)。10 d左右结节呈类软骨样外观,不再增大。

图1 第5代ADSC(×100)

图2 第5代ADSC(×100)诱导后48 h
2.2 ADSC诱导后免疫组化染色和免疫荧光
ADSC诱导7 d后,聚集结节Ⅱ型胶原免疫组化染色见胞膜、胞外基质呈棕黄色异染阳性(图3);14d后聚集形成的结节呈强阳性表达,可在小结节看到均匀密布的胞膜胞外基质阳性表达(图4);未诱导组细胞Ⅱ型胶原免疫细胞化学染色阴性。
ADSC诱导后7 d的aggrecan细胞免疫荧光检测,可见其胞浆、胞膜和胞外基质有绿色荧光表达,尤以聚集结节表达明显(图5);14 d后可见高密度细胞层面和周边的网状物呈绿色荧光表达(图6);未诱导组细胞则未见明确绿色荧光表达。

图3 ADSC诱导7 dⅡ型胶原染色(×600)
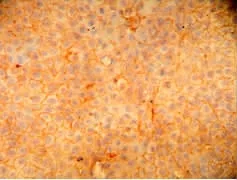
图4 ADSC诱导14 dⅡ型胶原染色(×600)
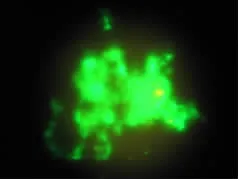
图5 ADSC诱导7daggrecan荧光(×600)

图6 ADSC诱导14 d aggrecan荧光(×600)
2.3 RT-PCR检测ADSC诱导后Col2al、Agc1和Sox9的m RNA的表达情况
对微团培养的ADSC在诱导0周(即未诱导)、2周和4周,采用RT-PCR从基因水平检测其Col2al、Agc1和Sox9的mRNA表达情况,可见总RNA表达完整(图7),内参照β-actin均在201 bp条带表达;在未诱导组,未见 Col2al、Agc1和Sox9的mRNA表达条带出现。在诱导2、4周组均可见:Col2al的mRNA在320 bp条带表达;Agc1的mRNA在322 bp条带表达;Sox9的mRNA在292 bp条带表达(图 8,9,10)。比较诱导后 2,4周2组目的条带和内参灰度值之比,应用两样本t检验统计学方法比较,显示诱导后 2,4周时间点 Col2al、Agc1和Sox9的mRNA表达水平,P值均>0.05,无显著统计学差异(附表)。
附表脂肪间充质干细胞诱导后2,4周Col2al、Agc1和Sox9的mRNA表达水平(±s)

附表脂肪间充质干细胞诱导后2,4周Col2al、Agc1和Sox9的mRNA表达水平(±s)
诱导后时间点样本数n Sox9/β-actin mRNA灰度值比2周5 0.737±0.033 0.766±0.027 0.781±0.022 4周5 0.745±0.037 0.788±0.015 0.796±0.021 Col2al/β-actin mRNA灰度值比Agc1/β-actin mRNA灰度值比

图7 高密度ADSC诱导后总RNA表达
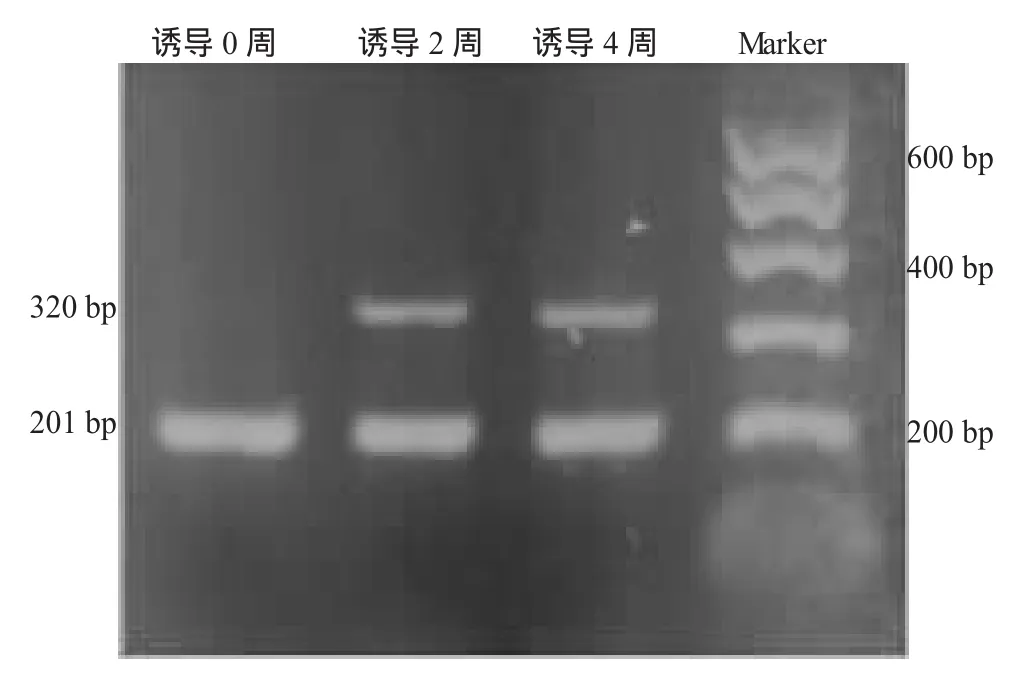
图8 高密度ADSC诱导后Col2al的mRNA表达电泳
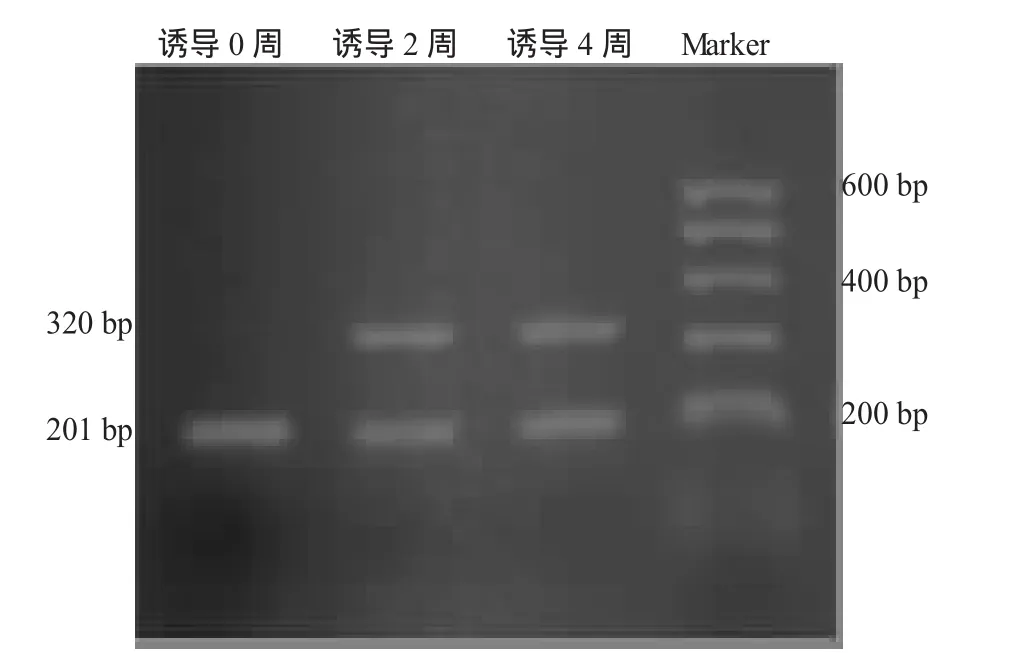
图9 高密度ADSC诱导后Acg1的mRNA的表达电泳

图10 高密度ADSC诱导后Sox9的m RNA的表达电泳
3 讨论
关节软骨损伤和退行性疾病依然是全球范围内威胁健康的主要问题之一。尽管在手术或非手术措施进行干预治疗方面进展很快,但软骨损伤的修复仍然是十分棘手的问题[4]。软骨组织工程结合细胞生物学、工程学、材料科学和外科学,旨在重建新的有功能组织,为关节软骨的修复奠定基础,以期能够获得最终长期的功能恢复,成为解决软骨修复难题最有前景的一种途径[5]。有关软骨组织工程种子细胞的研究多数集中于软骨细胞和骨髓间充质干细胞,而有关ADSC作为软骨组织工程种子细胞的研究相对少见[3]。既往研究表明,在体外特定的培养基条件下,ADSC可以表达成骨细胞、神经细胞、肌细胞、脂肪细胞和软骨细胞表型,因而可能会成为稳定可靠的种子细胞[6]。
胚胎时期,软骨的形成是通过中胚层间充质细胞之间以及细胞基质之间的相互作用的调节而形成的细胞浓缩相来完成的[7]。本试验采取微团培养的方式进行成软骨细胞诱导,这种高密度的接种近似于三维培养,有利于细胞之间的相互黏附和信号传递[7],部分地模拟了胚胎时期的高密度细胞聚集生成软骨的现象[8]。BARRY[9]等认为,间充质干细胞分化为软骨的条件包括:①三维培养方式;②无血清诱导剂;③加入TGF-β超家族生长因子。血清中包含有许多不确定的生长因子和分化因子,进而可能激发干细胞的自发多向分化潜能,而不是向软骨方向的单向分化。因此,促进干细胞向软骨分化的理想培养环境,应该限定于化学组成和无血清或合成血清代用品,如果有必要,可以配备特定的重组细胞因子和生长因子[10]。然而,目前尚无十分理想的无血清培养基或诱导剂能够同时促进细胞的分化和增殖,而且对配备的细胞生长因子要求高,费用昂贵。参考国外ZUK[6]等有关脂肪间充质干细胞向软骨细胞分化的培养基条件,本实验中采用含1%新生牛血清诱导剂。
在软骨形成过程中,TGF-β1是调节细胞增殖和分化的关键因子。高密度的间充质干细胞的聚集是使其定向软骨细胞分化的始动步骤,而TGF-β1则起着关键的启动作用[11]。这种始动作用有可能是其通过促使软骨细胞转录因子Sox9的表达,进而促进细胞聚集的发生[11]。胰岛素在体外细胞培养体系中,对于维持细胞的活力,促进有丝分裂、糖原和脂肪酸的合成起着十分重要的作用。有研究表明,胰岛素-转铁蛋白-硒能够促进人的软骨细胞增殖,并减少软骨细胞的去分化[12]。地塞米松可以激活间充质干细胞上的糖皮质激素受体,促进间充质干细胞向软骨细胞分化,并抑制其向脂肪细胞的分化。维生素C作为一种辅助的培养基试剂,对于脂肪间充质干细胞成软骨分化过程中胶原蛋白和蛋白聚糖的合成也有着一定的促进作用。在本实验特定的诱导培养基条件下,ADSC逐渐由长梭形变化为三角形,多角形和短梭形,表现为软骨细胞形态特征。诱导后ADSC增殖迟缓,分析原因可能是:首先,细胞的增殖能力和分化程度是一对矛盾,增殖能力高的细胞必然分化程度低,而分化程度高的细胞必然增殖能力低。在脂肪间充质干细胞向软骨细胞分化的过程中,实际是向一种高度分化的细胞类型的转变,其间必然也伴有增殖能力的降低;其次,并非所有的脂肪间充质干细胞在这种特定的培养诱导剂都能够向软骨方向分化,不能适合这种诱导环境的细胞就可能出现凋亡。Ⅱ型胶原蛋白和aggrecan是软骨细胞最特异的表面标志,因而是检测软骨细胞分化形成的最重要指标。通过比较ADSC组和诱导组的不同时间点的Ⅱ型胶原蛋白免疫组化染色和aggrecan荧光检测,发现ADSC的表型确实发生着明显的变化,表现有软骨细胞的明显特征。诱导后的ADSC聚集成结节的同时,免疫细胞化学和免疫荧光检测发现,在高密度的ADSC之间有Ⅱ型胶原蛋白和aggrecan表达,随后的1周和2周后,这种表达缓慢增强,在胞膜、胞浆和细胞之间强阳性表达。应用RT-PCR技术,本文进一步从基因水平探讨了体外ADSC诱导成软骨过程中Sox9、Agc1和Col2al的mRNA表达,发现在诱导后2周、4周,Sox9、Agc1和Col2al的mRNA均有稳定地高表达,而在未诱导组(即诱导0周时)并没有Sox9、Agc1和Col2al mRNA的表达。该项实验表明,在特定培养基条件下,高密度微团培养的ADSC可以定向软骨细胞方向分化,并能够稳定表达软骨细胞特异表型,为进一步构建组织工程化软骨奠定了基础。不断优化诱导培养基条件,解决ADSC分化和增殖受限的矛盾,仍然是以后研究的重点。
[1]KRAME R J,BOHRNSEN F,SCHLENKE P,et al.Stem Cell-Derived Chondrocytes for Regenerative Medicine[J].Transplant Proc,2006,38(3):762-765.
[2]FU Q,YU DD,WANG Y,et al.Differentiation of rat’s ADSCs loaded by TGF-β1 Gene to chondrocytes[J].China Journal of Modern Medicine,2008,18(12):1717-1721.Chinese
[3]RODRIGUEZ AM,ELABD C,AMRI EZ,et al.The human adipose tissue is a source of multipotent stem cells[J].Biochimie,2005,87:125-128.
[4]HORWITZ EM,GORDON PL,KOO WK,et al.Isolated allogeneic bone marrow-derived mesenchymal cells engraft and stimulate growth in children with osteogenesis imperfecta:Implications for cell therapy of bone[J].Proc Natl Acad Sci USA,2002,99:8932-8937.
[5]INDRAWATTANA N,CHEN G,TADOKORO M,et al.Growth factor combination for chondrogenic induction from human mesenchymal stem cell[J].Biochem Biophys Res Commun,2004,320(3):914-919.
[6]ZUK PA,ZHU M,ASHJIAN P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13:4279-4295.
[7]LEE JW,KIM YH,KIM SH.Chondrogenic differentiation of mesenchymal stem cells and its clinical applications[J].Yonsei Med J,2004,45 Suppl:41-47.
[8]LIWJ,TULI R,OKAFOR C,et al.A three-dimensional nanofibrous scaffold for cartilage tissue engineering using human mesenchymal stem cells[J].Biomaterials,2005,26(6):599-609.
[9]BARRY FP,MURPHY JM.Mesenchymal stem cells:clinical applications and biological characterization[J].Int J Biochem Cell Biol,2004,36(4):568-584.
[10]GOLDSBOROUGH MD,TILKINS ML,PRICE PJ,et al.Serum-free culture of murine embryonic stem(ES)cells[J].Focus,1998,20:8-12.
[11]JOYCE ME,ROBERTS AB,SPORN MB,et al.Transforming growth factor-beta and the initiation of chondrogenesis and osteogenesis in the rat femur[J].J Cell Biol,1990,110(6):2195-2207.
[12]CHUA KH,AMINUDDIN BS,FUZINA NH,et al.Insulin-transferrin-selenium prevent human chondrocyte dedifferentiation and promote the formation of high quality tissue engineered human hyaline cartilage[J].Eur Cell Mater,2005,9:58-67.

