壳聚糖镧配合物的制备、表征及其抑菌性能
冯小强,李小芳,杨 声,*,伏国庆,王廷璞,苏中兴
(1.天水师范学院生化学院,甘肃天水 741001; 2.天水市中医医院,甘肃天水 741001;3.兰州大学化学化工学院,甘肃兰州 730000)
壳聚糖镧配合物的制备、表征及其抑菌性能
冯小强1,李小芳1,杨 声1,*,伏国庆2,王廷璞1,苏中兴3
(1.天水师范学院生化学院,甘肃天水 741001; 2.天水市中医医院,甘肃天水 741001;3.兰州大学化学化工学院,甘肃兰州 730000)
合成了不同配比的壳聚糖镧配合物,运用 FT-I R、UV、TG-DTA和循环伏安法进行了表征。测试了壳聚糖及其镧配合物对埃希氏大肠杆菌和金黄色葡萄球菌的抑菌性能。结果表明,壳聚糖镧配合物的抑菌性能较壳聚糖有明显提高,抑菌性能随镧与壳聚糖配比的增大而增强。壳聚糖镧配合物处理后的 E.coli和 St.aureus的细胞壁、膜被损坏,外部有内容物溢出,表明壳聚糖镧配合物首先作用于细菌细胞壁膜,进而进入菌体内部而起到抑菌作用。
壳聚糖,壳聚糖镧配合物,制备,表征,抑菌性能
1 材料与方法
1.1 材料与仪器
壳聚糖 相对分子量 14万,DD>95%,浙江金壳生物化学有限公司;La2O3纯度 99.95%,上海化学试剂公司;硝酸、NH3·H2O、NaOH、无水乙醇、乙醚、醋酸 均为分析纯;实验用水 二次蒸馏水;大肠埃希氏菌 (E.coli,ATCC 35218),金黄色葡萄球菌(S t.aureus,ATCC 26113),牛肉膏蛋白胨培养基,琼脂培养基。
紫外可见分光光度计 UV-9200型,北京瑞利分析仪器公司;TG-DT A分析仪 Pyris Diamond Analyzer;Spectrum One傅立叶红外光谱仪 Perkin E lmere;LK98A微电极电化学分析系统 天津兰力科,修饰玻碳电极为工作电极,饱和甘汞电极做参比电极(vs.SCE.),Pt柱为对电极;JEM-1230透射电子显微镜 Hitachi,Tokyo,Japan。
1.2 壳聚糖镧配合物的制备
称取0.5g CTS溶解于50mL 1%HAc溶液中。按壳聚糖 (糖单元)与 La(Ⅲ)摩尔比为 4∶1、2∶1、1∶1、0.5∶1、0.25∶1加入不同质量的 La(NO3)3搅拌,编号1~5。用 1%的氨水调节 pH至 5.0,室温下搅拌反应12h。将其混合液浓缩后冷却至室温,加入到 200mL丙酮溶液中沉淀。依次用蒸馏水、无水乙醇、乙醚洗涤,得到壳聚糖镧配合物。
1.3 壳聚糖镧配合物抑菌活性的测定
1.3.1 菌悬液的制备 受试菌种(标准菌株)接种于固体琼脂培养基,37℃活化 24h。将活化后的受试菌种用接种环挑取菌苔于生理盐水中,制成 OD610nm= 0.7的菌悬液备用。
1.3.2 牛肉膏蛋白胨培养基、固体琼脂培养基的制备 参见文献[11]。
1.3.3 样品溶液的配制 壳聚糖及壳聚糖镧配合物用 0.3%HCl溶解,分别配制 10mL 15mg/mL的样品溶液。
1.3.4 抑菌性能测试 (OD) 受试菌种 (标准菌株)接种于固体琼脂培养基,37℃活化 24h。活化后的受试菌种用接种环挑取菌苔于生理盐水中,制成OD630nm=0.7的菌悬液备用。将 13.9mL的液体培养基与1mL的药物溶液混合,加入 100μL菌悬液,使壳聚糖及其配合物的最终浓度为 1mg/mL,恒温振荡培养。测定不同时间内的 OD610nm值,光密度越小,抑菌性能越强。恒温培养 48h后采用菌落平板记数法测定壳聚糖的最小抑菌浓度 (M I C),使壳聚糖的最终浓度分别 为 0.05%、0.025%、0.0125%、0.00625%、0.00313%、0.00156%(w/v)。最小抑菌浓度定义为与对照相比,以肉眼观察不到菌落对应的壳聚糖与其配合物的浓度[12]。
1.4 壳聚糖镧配合物的表征
1.4.1 红外光谱(FT-I R) 采用 KBr压片法测定壳聚糖及其镧配合物的红外吸收光谱,测量波长数为400~4000cm-1。
1.4.2 紫外光谱(UV) 以 0.3%HCl壳聚糖溶液为空白,于 200~600nm波长范围内测定壳聚糖与壳聚糖镧配合物的紫外吸收光谱。
1.4.3 差热-热重分析 (TG-DTA) 以α-Al2O3为参比,升温速率 10℃/min,对壳聚糖及壳聚糖镧配合物进行热力学分析。
1.4.4 壳聚糖镧配合物的循环伏安行为 玻碳电极用三氧化二铝抛光粉抛光处理后,依次用 1∶1的硝酸溶液、无水乙醇、去离子水超声 5min,将电极置于红外灯下烘烤至干,待电极冷却后,用微型注射器取10mg/mL的壳聚糖镧配合物溶液 10μL,均匀涂在电极表面,自然晾干,便得到壳聚糖镧配合物化学修饰电极,在 1mol/L的 KNO3缓冲液中测定其循环伏安行为。
2 结果与讨论
2.1 红外光谱分析
对比图 1中 a和 b可看出,壳聚糖中在 I R谱图高波数区 3436cm-1处-OH与-NH2的缔合伸缩振动吸收峰在配位后峰形变宽,说明壳聚糖中的-NH2、-OH可能参与了配位反应。壳聚糖在 1649cm-1处有较强的酰胺吸收峰,配位后位移至 1635cm-1处, 1711cm-1处为壳聚糖中酰胺键中的-C=O吸收峰,在配合物中消失,证明壳聚糖中的酰胺键参与了配位;壳聚糖中 1590cm-1左右的-NH2伸缩振动吸收峰配位后消失,1383cm-1附近处出现 C-H弯曲振动和C-N的伸缩振动叠加吸收在配合物中发生了微小位移并有所减弱,说明氨基参与了配位;壳聚糖中位于1155cm-1处仲羟基的 C-O伸缩振动吸收峰在配合物中消失,位于 1091.73cm-1处的伯羟基的 C-O伸缩振动吸收峰移至 1089.12cm-1处且峰形变宽, 1421.21cm-1的-OH收缩峰在配合物中几乎消失,表明-OH参与了配位[1]。以上结果说明壳聚糖中的-OH与-NH2都参与了配位反应。
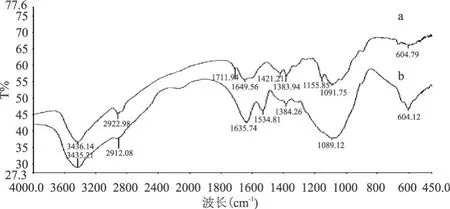
图 1 壳聚糖(a)及其镧配合物(b)的红外光谱
2.2 紫外光谱分析
由图 2可知,壳聚糖在 257.00nm和 326.00nm处有 2个强吸收峰,且峰形较宽,而 CTS-La(Ⅲ)吸收在259.00nm和 331.50nm处,发生了较大的位移且吸收强度发生了变化,这可能是配合物中氮、氧的孤对电子发生 n→σ*跃迁,导致电子光谱发生变化。由此可证明La(Ⅲ)与 CTS发生了配位反应,且 C-N键由于-NH2与La(Ⅲ)的结合,在一定程度上使该键有所削弱,从而可推断-NH2是CTS分子中主要吸附部位。
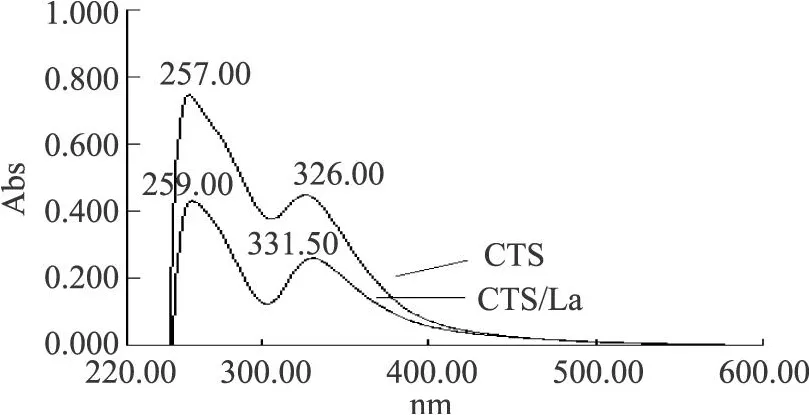
图2 壳聚糖及其镧配合物的紫外光谱
2.3 差热-热重分析
由壳聚糖及壳聚糖 La(Ⅲ)配合物的 TG-DTA曲线(图 3)可知,壳聚糖及壳聚糖 La(Ⅲ)配合物的失重都分为三个阶段:第一阶段,壳聚糖为20~150℃,壳聚糖La(Ⅲ)配合物为 20~180℃,在这一阶段两者分别失重 11.3%和 13.4%;第二阶段,壳聚糖为 150~310℃,壳聚糖 La(Ⅲ)配合物为180~380℃,在这一阶段壳聚糖和壳聚糖 La(Ⅲ)配合物分别失重 56.5%和 29.8%;第三阶段,壳聚糖为310~630℃,壳聚糖 La(Ⅲ)配合物为 380~560℃,在这一阶段壳聚糖和壳聚糖 La(Ⅲ)配合物分别失重28.8%和 32.0%。分析可知,壳聚糖 150℃以前和壳聚糖La(Ⅲ)配合物 180℃以前的失重都是由失水所致;壳聚糖 150~310℃和壳聚糖 La(Ⅲ)配合物在180~380℃出现的失重,是由于壳聚糖和壳聚糖La(Ⅲ)配合物的降解;第三阶段的失重,可能是由于壳聚糖与镧配位后,其分子内的氢键结合被破坏,结晶度发生改变,热稳定性减小的原因。
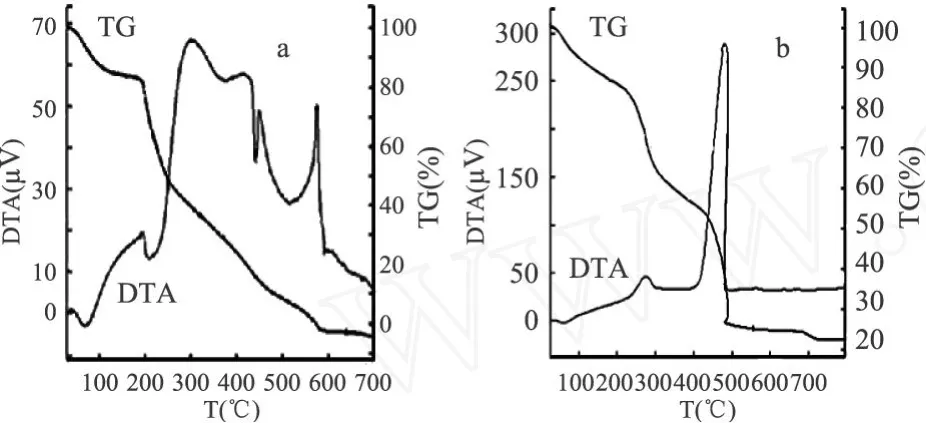
图 3 壳聚糖(a)及其镧配合物(b)的差热-热重分析
2.4 壳聚糖镧配合物修饰电极的循环伏安行为
图 4为壳聚糖和壳聚糖镧配合物修饰玻碳电极在 1mol/L KNO3缓冲液中扫速为 100mV/s时的循环伏安曲线。可以看出,壳聚糖修饰电极在 KNO3缓冲液中无氧化-还原峰出现,而壳聚糖镧配合物修饰电极在约-0.245V处出现一还原峰,在 0.536V左右出现一氧化峰,说明非电活性的壳聚糖与镧离子发生了配位,生成了具有电活性的壳聚糖镧配合物。
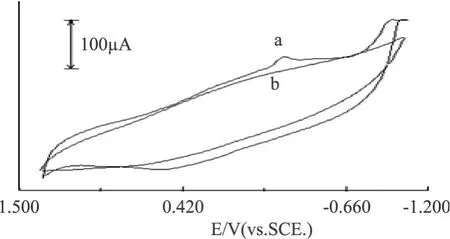
图4 壳聚糖镧配合物的循环伏安曲线注:a.CTS-La(Ⅲ)修饰玻碳电极; b.壳聚糖修饰玻碳电极 KNO3缓冲液中。
2.5 抑菌性能研究
图 5为壳聚糖及其镧配合物分别作用于 E.coli和 S t.aureus在不同时间的 OD610nm曲线图。E.coli和S t.aureus经壳聚糖和壳聚糖镧配合物作用后,对应的光密度值均小于壳聚糖,说明壳聚糖在发生配位反应以后抑菌性能有所增强。另外,随着 La(Ⅲ)与壳聚糖配比的增加,其对 E.coli和 S t.aureus的抑制作用逐渐增强。表 1为壳聚糖及其镧配合物对 E.coli和 S t.aureus的最小抑菌浓度,可以看出,随着配合物中La(Ⅲ)浓度的增大,其抑菌性能增强,最小抑菌浓度依次降低,说明配合物的抑菌性能是壳聚糖与 La (Ⅲ)的协同作用。
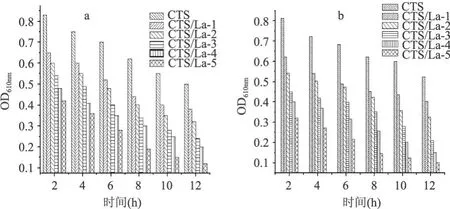
图 5 壳聚糖镧配合物对 E.coli(a)和 St.aureus(b)的抑菌性能
研究认为[13],壳聚糖的抑菌作用与其氨基的质子化有关,在酸性条件下,壳聚糖分子链上的-NH2与 H+结合形成-NH+3正离子,与细菌表面的负电荷发生静电作用,使细菌被絮凝,聚沉,生长繁殖也随之减弱。另外,在酸性环境下,质子化氨中的 H+可能与营养物质结合,并能交换细胞表面的某些微生物生长所需要的阳离子如Mn2+、Ca2+、Mo2+等,从而影响细胞结构的稳定性,对机体产生不利的影响。CTS-La(Ⅲ)能显示出较壳聚糖强的抑菌活性,是由于壳聚糖和La(Ⅲ)两者抑菌活性的协同作用,壳聚糖与La(Ⅲ)配位后,所带正电荷较壳聚糖增多,更易与细菌结合,故抑菌活性高于壳聚糖。
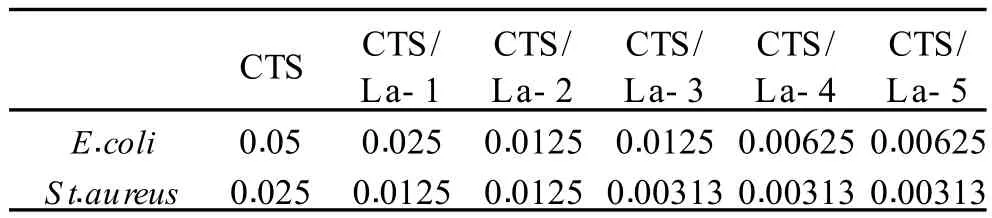
表 1 壳聚糖镧配合物的最小抑菌浓度(%、w/v)
2.6 壳聚糖镧配合物处理前后大肠杆菌及金黄色葡萄球菌的形貌变化
大肠杆菌(图6a、图6b):对照组(图6a):细菌切面多呈杆状,细胞壁、细胞膜完整,胞质均匀。药物组(图6b):细菌形态呈现球形体,菌体细胞壁部分或全部脱落消失,细菌轮廓模糊,外观呈毛刺状,结构不清且发生不同程度的凹陷变形,甚至穿孔和破碎;胞浆内容物稀疏,空隙明显扩大,细胞外有溶出物出现。细菌内部结构消失或分布异常。

图 6 壳聚糖镧配合物处理前(a、c)后 (b、d)E.coli和 St.aureus的形貌
金黄色葡萄球菌(图 6c、图 6d):对照组(图 6c):细菌切面多呈葡萄球状,细胞壁、细胞膜完整,胞质均匀。药物组(图6d):细菌形态发生变化,细菌内部分布异常,菌体轮廓模糊,外围有液体溢出的痕迹,并有空腔出现。
3 结论
3.1 合成了几种不同配比的 CTS-La(Ⅲ)配合物。FT-I R、UV、TG-DT A、循环伏安分析结果表明,壳聚糖与La(Ⅲ)之间发生了配位反应,形成了配合物CTS-La(Ⅲ)。
3.2 配合物 CTS-La(Ⅲ)的抑菌性明显强于壳聚糖,其抑菌性能与La(Ⅲ)与壳聚糖的摩尔配比有关,随着配合物中La(Ⅲ)含量的增加,最小抑菌浓度减小,抑菌性能逐渐增强。
3.3 CTS-La(Ⅲ)配合物处理后的 E.coli和 S t.aureus的细胞壁、膜被损坏,外部有内容物溢出,表明 CTSLa(Ⅲ)首先作用于细菌细胞壁膜,进而进入内部。
[1]XiaohuiWang,Yumin Du,Lihong Fan,et al.Chitosan-metal complexes as antimicrobial agent:synthesis,characterization and structure activity study[J].PolymerBulletin,2005,55:105-113.
[2]孙昌梅,曲荣君,王春华,等 .基于壳聚糖及其衍生物的金属离子吸附剂的研究进展[J].离子交换与吸附,2004,20(2):184-192.
[3]相波,刘亚菲,李义久,等 .壳聚糖及其衍生物对重金属吸附性能的研究[J].工业水处理,2004,24(5):10-14.
[4]曹佐英,赖声礼,曹珍年 .微波辐射下壳聚糖 Zn配合物的合成[J].现代化工,1999,19(11):24-27.
[5]况伟 .低聚水溶性壳聚糖与锌的络合 [J].食品与机械, 2006,22(1):15-17.
[6]刘振南 .壳聚糖对重金属离子吸附的研究[J].广西化工, 1996,25(2):9-12.
[7]Park J H,Cha B J,Lee Y N.Antibacterial activity of chitosan acetateon food-borne enter opathogenic bacteria[J].Food Science and Biotechnology,2003,12(1):100-103.
[8]Jeon YJ,Park PJ,Kim SK.Ant imicrobialeffectof chitooligosaccharides produced by bioreactor[J].Carbohydrate Polymers,2001,44:71-76.
[9]Liu XF,Guan YL,Yang DZ,et al.Antibacterial action of chitosan and carboxy methylated chitosan[J].Appl Polym Sci, 2000,79(7):1324-1335.
[10]Issam S T,AdeleM G,Adele C P,et al.Chitosan polyer as bioactive coating and film againstAspergillus nigercontamination [J].Journal of Food Science,2005,70(2):100-104.
[11]沈萍,等 .微生物学实验[M].高等教育出版社,2003:53.
[12]Speciale A,Musumeci R,Blandino MG,et al.Int J Antimicrob Ag[J],2002,19:111.
[13]杨声,冯小强,王廷璞,等 .壳聚糖对大肠杆菌的抑制作用规律及抗菌机理初探[J].天然产物研究与开发,2007,19:39-43.
Synthesis,characterization and antibacterial activity of chitosan-La(Ⅲ)complexes
FENG Xiao-qiang1,L I Xiao-fang1,YANG Sheng1,*,FU Guo-qing2,WANG T ing-pu1,SU Zhong-xing3
(1.College ofBiology and Chemistry,TianshuiNormalUniverity,Tianshui 741001,China; 2.Tianshui Traditional ChineseMedical Hospital,Tianshui 741001,China; 3.Chemistry and Chemical Engineering College,Lanzhou University,Lanzhou 730000,China)
Chitosan-La(Ⅲ)comp lexes w ith d iffe rent ra tios we re synthes ized.The s truc tures of these comp lexes we re cha rac te rized by FT-IR,UV and TG-DTA.M oreove r,the antibac te ria l ac tivity of chitosan and its che lae comp lexes aga ins t E.coli and S t.aureus we re inves tiga ted in vitro.The results ind ica ted tha t the antibac te ria l ac tivity of chitosan che la te comp lexes was m a rked ly imp roved comp a red w ith chitosan,and which was re la ted to the ra tio of chitosan to La(Ⅲ).The ce ll wa ll and m em b rane of E.coli and S t.aureus we re des troyed afte r trea ted by chitosan-La(Ⅲ)comp lexes.
chitosan;chitosan-La(Ⅲ)comp lexes;synthes ize;cha rac te riza tion;antibac te ria l ac tivity
TS201.2
A
1002-0306(2010)02-0304-04
壳聚糖分子中含有羟基 (-OH)和游离的氨基(-NH2),其分子结构中每个基本单元都连有一个伯氨基,氮原子上的孤对电子可投入到金属离子等的空轨道中,形成配位键结合,因此它可以与 Fe2+、Ca2+、Cu2+、Zn2+等配位,有效地捕集或吸附溶液中的金属离子[1-4]。Wang等发现壳聚糖金属离子配合物的抑菌活性优于壳聚糖[5]。壳聚糖硒作为补硒剂,毒性较小,硒化壳聚糖对癌细胞具有明显的抑制作用[6]。目前,壳聚糖及其降解产物在抗菌、抑菌方面已被应用于各个领域中,其中有关壳聚糖及其衍生物抗菌性能的报道较多[7-9],认为壳聚糖不仅具有天然抗菌性能,而且抗菌谱广。壳聚糖能有效地抑制细菌和真菌的生长和繁殖,与一般抑制剂相比,它具有抑菌活性高、广谱、杀灭率高等优点[10]。稀土元素具有许多特殊的生物活性和较好的抗菌能力,将其与壳聚糖配位将有望提高壳聚糖的抑菌性能和生物活性。论文合成了几种不同配比的壳聚糖镧配合物,运用 FT-I R、UV、TG-DTA和循环伏安法对配合物进行了表征。测试了壳聚糖及其镧配合物 (CTSLa(Ⅲ))对大肠埃希氏菌 (E.coli)和金黄色葡萄球菌(S t.aureus)的抑菌性能。结果表明,壳聚糖镧配合物的抑菌性能较壳聚糖有所提高,抑菌性能与其配比有关。该研究将拓展壳聚糖作为抑菌材料的应用前景,有望开发一种天然绿色稀土生物农药。
2009-03-17 *通讯联系人
冯小强(1980-),男,讲师,研究方向:天然高分子生物活性研究。
天水师范学院院立项目;物理无机化学重点学科资助项目。

