瑞士乳杆菌对小鼠肠道黏膜免疫应答及细胞因子的影响
贾玉臣,陈庆森*,王友湘,阎亚丽
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
瑞士乳杆菌对小鼠肠道黏膜免疫应答及细胞因子的影响
贾玉臣,陈庆森*,王友湘,阎亚丽
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
探讨灌胃瑞士乳杆菌(Lactobacillus helveticus TS206)发酵制品对健康Balb/c小鼠肠道黏膜免疫应答及细胞因子的影响。本实验将Balb/c小鼠分为空白对照组、生理盐水组和瑞士乳杆菌组3组,瑞士乳杆菌组的灌胃剂量为108CFU/mL,分别在灌胃后0、1、2、3、4、6、8、12、24h处死小鼠得到小肠组织样品,利用RIA法和ELISA法测得各组小鼠肠道黏膜SIgA和细胞因子的含量,并作统计分析。结论:灌胃组小鼠肠道黏膜中SIgA的含量与生理盐水对照组相比差异极显著(P<0.01);灌胃组小鼠肠道黏膜中IL-2和IFN-γ的含量与生理盐水对照组相比具有显著性差异(P<0.05);灌胃组IL-4与生理盐水对照组相比含量明显升高(P<0.05);而灌胃组和生理盐水对照组相比IL-6的表达水平后期差异不显著(P>0.05);IFN-γ/IL-4的值处于相互拮抗的状况,表明瑞士乳杆菌对健康小鼠具有维护肠黏膜免疫平衡的作用,也对保持Th1/Th2平衡状态具有明显的作用,即证实瑞士乳杆菌作为益生菌具有调控小鼠肠道黏膜免疫应答的功效。
瑞士乳杆菌;细胞因子;肠道黏膜;免疫应答
肠黏膜中细胞因子是由肠上皮细胞(intestinal epithelial cells,IECs)、淋巴细胞、巨噬细胞等分泌能影响其他细胞功能的多肽分子。它们表达于天然免疫和特异免疫的效应阶段,介导免疫应答、炎症反应并进行调节[1]。IFN-γ为Th1最特异分泌的细胞因子,调节细胞免疫功能,清除细胞内细菌和病毒的作用;IL-4为Th2最特异分泌的细胞因子,调节体液免疫功能,可中和细胞外的病原体。肠黏膜上皮细胞受到刺激后,若IL-4在外周血及肠黏膜组织中水平升高,而IFN-γ分泌水平下降,从而使IFN-γ/IL-4比值变化,导致Th1/Th2失衡[2]。机体在对抗自身及外来抗原入侵的过程中以Th1介导的细胞免疫为主,一旦由Th1向Th2偏移,则机体处于免疫抑制状态,使肠黏膜逃避免疫监视。
瑞士乳杆菌TS206(Lactobacillus helveticus TS206)不仅是人体肠道的益生菌,而且还具有较强的蛋白水解活性,能水解乳蛋白产生多种生物活性肽,如该菌发酵产ACE抑制活性肽已表现出很好的开发潜力[3];能够促进小鼠肠道内有益菌的显著增殖,同时对肠道内过路菌和可疑致病菌均有一定的抑制作用,从而对小鼠肠道微生物区系具有一定的调节作用[4]。早在1988年de Simone 等[5]研究发现,肠胃外给予乳酸菌能诱导产生TNF、IL-2以及IL-1,并且存在菌株差异性。Perdigon等[6]通过灌喂乳酸菌或乳酸菌发酵奶后再经口导入沙门氏菌,发现乳酸菌能通过在肠液中产生抗沙门氏菌的IgA(免疫球蛋白A)起到免疫保护作用,血清IgA 水平也显著高于灌喂牛奶的大鼠,且这种作用也有菌株差异性。曹晋宜等[7]、王友湘等[8]研究证实,长期灌胃一定剂量的瑞士乳杆菌具有显著提高肠黏膜的免疫调控功能。本研究以具有益生功能的瑞士乳杆菌TS206灌胃 Balb/c小鼠,利用RIA和ELISA法测定各组小鼠肠道黏膜SIgA和细胞因子的含量,探讨瑞士乳杆菌在调节动物肠道黏膜免疫功能方面的作用。
1 材料与方法
1.1 材料、试剂与仪器
瑞士乳杆菌TS206 (Lactobacillus helveticus TS206),本实验室保藏菌种。
Balb/c小鼠(SPF级,雄性,6~8周龄,体质量16~20g)和小鼠常规饲料均购于中国人民解放军军事医学科学院实验动物中心。
分泌型免疫球蛋白A放射免疫分析试剂盒(SIgA RIA Kit) 中国原子能科学研究院同位素研究所;细胞因子定量检测试剂盒 北京尚柏生物医学技术有限公司;其他常规试剂均为国产分析纯。
高压蒸汽灭菌锅、超低温冰箱 Sanyo公司;恒温生化培养箱 上海新苗医疗器械制造有限公司;紫外分光光度计 北京普析通用仪器有限责任公司;超净工作台 苏州净化设备有限公司;高速冷冻离心机 Sigma公司。
1.2 方法
1.2.1 瑞士乳杆菌TS206的发酵工艺
质量分数10%乳清粉溶液,调pH5.5→115℃高压灭菌30min→低速离心除去杂质→115℃高压灭菌→接种瑞士乳杆菌→40℃下静止培养16h→终止发酵,获得菌体细胞
1.2.2 灌胃瑞士乳杆菌细胞制剂的制备
将发酵获得的瑞士乳杆菌菌体细胞用无菌生理盐水悬浮,在600nm波长处测定菌悬液的OD值,同时用溴甲酚绿培养基平板计数[9],作出菌落数-OD值的关系曲线,利用该曲线将菌浓浓调整至108CFU/mL备用。
1.2.3 实验动物分组
本研究设计的短期内(24h)灌胃Balb/c小鼠瑞士乳杆菌细胞制剂的最佳剂量按文献[7-8]进行,试验设计方案及灌胃方式见表1所示。
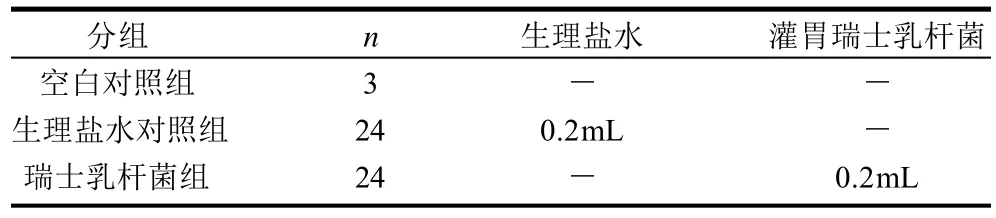
表1 实验动物分组及灌胃方案Table 1 Grouping mice and the dose received respectively
1.2.4 肠黏膜及组织样本的获取
实验按表1所设计的菌浓度灌胃小鼠,分别在灌胃后0、1、2、3、4、6、8、12、2 4 h处死小鼠(每组3只),解剖得到小肠组织,用无菌缓冲液冲洗除掉残渣后刮取内容物0.1g于离心管中, -20℃下冷冻保藏;同时取小鼠自幽门下4cm处小肠0.15g于离心管中,-20℃下冷冻保藏。待所有样品收集完后在检测前要进行样品的预处理。
1.2.5 小鼠肠道黏膜中SIgA含量的测定
将肠黏膜样品取出平衡至室温,然后加入无菌pH7.2的PBS缓冲液200μL充分摇匀,2000×g离心10min,取上清液100μL 进行放射性免疫法(radioimmunoassay,RIA)检测,操作步骤按说明书进行。测定值根据标准曲线求出各个样品中SIgA的含量。
1.2.6 小鼠肠道黏膜中细胞因子含量的测定
将小肠组织样品取出平衡至室温,然后加入无菌pH7.2的PBS缓冲液500μL,在4℃下用组织匀浆器将组织破碎,立即在离心机中4℃、5000×g离心10min,取上清液分装到4个离心管中,每个离心管放100μL,放回到4℃冰箱中保存待测。用ELISA方法按照试剂盒说明书所述步骤进行测定。
1.3 数据处理
实验数据采用SPSS11.5统计软件进行分析处理。
2 结果与分析
2.1 灌胃瑞士乳杆菌对小鼠肠黏膜SIgA含量的影响
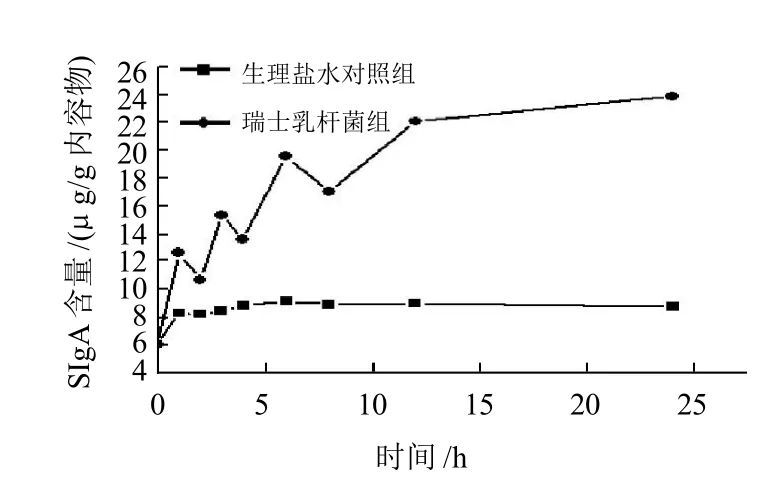
图1 灌胃瑞士乳杆菌对小鼠肠道黏膜SIgA含量的影响Fig.1 Effect of Lactobacillus helveticus by oral administration on the content of SIgA in intestinal mucosa of mice
图1表明,24h内生理盐水对照组肠黏膜中SIgA的含量处于平稳的分泌水平,瑞士乳杆菌灌胃组小鼠肠道黏膜中SIgA的含量与生理盐水对照组相比,在1h呈现极显著差异(P<0.01),此后波动性升高并于12h后基本维持在一个显著的较高水平(P<0.05)。可见,瑞士乳杆菌作为益生菌对小鼠肠黏膜具有明显免疫调节作用,与前期报道是一致的,即通过对灌胃瑞士乳杆菌和大肠杆菌小鼠肠道微生物菌群的比较,证实了瑞士乳杆菌具有促进双歧杆菌和乳酸杆菌增殖的作用,对肠杆菌和肠球菌等条件致病菌的生长有一定的抑制作用,能够降低肠道内大肠杆菌的数量[4,8]。实验表明,一定剂量(≥106CFU/mL)的瑞士乳杆菌对动物肠道的内环境具有很好的调理作用。
2.2 灌胃瑞士乳杆菌对小鼠肠黏膜Th1/Th2平衡的影响
2.2.1 灌胃瑞士乳杆菌对小鼠肠黏膜Th1细胞因子的影响
图2表明,瑞士乳杆菌灌胃组小鼠肠道黏膜中IL-2的含量和生理盐水对照组相比,从第1小时便呈现显著性差异(P<0.05),在前8h瑞士乳杆菌灌胃组小鼠肠黏膜中IL-2的波动比较大,在第4小时和第6小时呈现极显著升高(P<0.01),于第6小时达到最大值(1044.92pg/g内容物),在12~24h时间段内波动比较缓慢,但明显比生理盐水对照组高;对于IFN-γ,由图3可见,瑞士乳杆菌灌胃组小鼠肠黏膜中IFN-γ含量与生理盐水对照组相比,除了在第4小时无显著差异外(P>0.05),其他时间点均呈现显著性差异(P<0.05),并于第3小时达到最大值(519.81 pg/g内容物)整体变化趋势与IL-2相似。
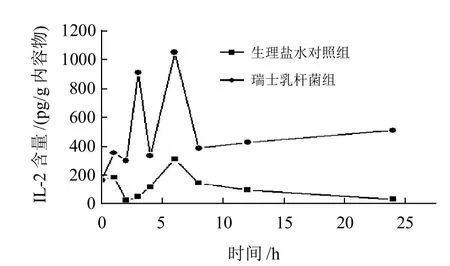
图2 灌胃瑞士乳杆菌对小鼠肠黏膜IL-2含量的影响Fig.2 Effect of Lactobacillus helveticus by oral administration on the content of IL-2 in intestinal mucosa
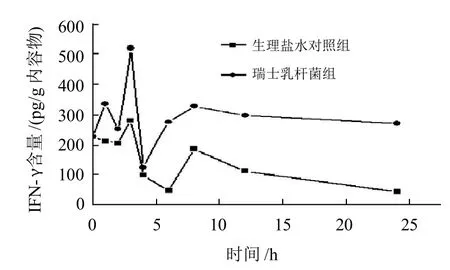
图3 灌胃瑞士乳杆菌对小鼠肠黏膜IFN-γ含量的影响Fig.3 Effect of Lactobacillus helveticus by oral administration on the content of IFN-γ in intestinal mucosa of mice
2.2.2 灌胃瑞士乳杆菌对小鼠肠黏膜Th2细胞因子的影响
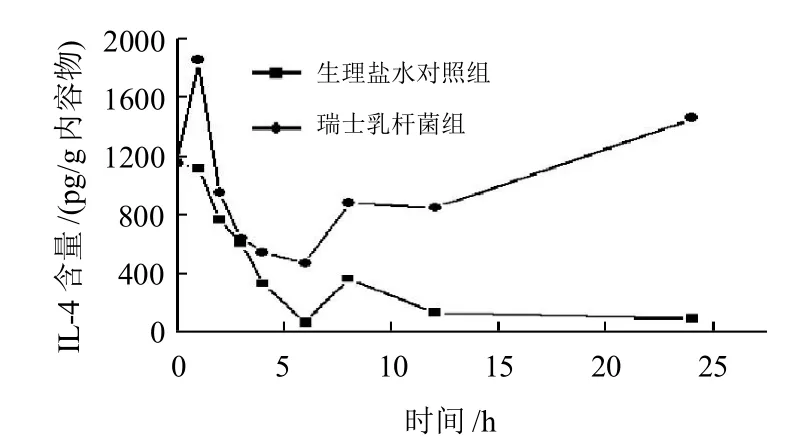
图4 灌胃瑞士乳杆菌对小鼠肠黏膜IL-4含量的影响Fig.4 Effect of Lactobacillus helveticus by oral administration on the content of IL-4 in intestinal mucosa of mice

图5 灌胃瑞士乳杆菌对小鼠肠黏膜IL-6含量的影响Fig.5 Effect of Lactobacillus helveticus by oral administration on the content of IL-6 in intestinal mucosa of mice
图4表明,瑞士乳杆菌灌胃组小鼠肠道黏膜中IL-4的含量和生理盐水对照组相比,除在第2、3、4小时无显著差异外(P>0.05),其他时间点均显著升高(P<0.05),至6h前瑞士乳杆菌灌胃组小鼠肠道黏膜中IL-4的含量有所下降,但是在6h后表达水平又较明显地升高,说明一定剂量的瑞士乳杆菌对健康小鼠肠黏膜具有一定的拮抗调节作用,长期灌胃瑞士乳杆菌对肠道黏膜刺激表达IL-4的水平也证实了这种现象[7]。
由图5可见,瑞士乳杆菌灌胃组小鼠肠道黏膜中IL-6的含量和生理盐水对照组相比在前期波动较大,第1小时和第6小时均呈现显著性差异(P<0.05),并于第6小时达到最大值(628.88pg/g内容物),在后期处于比较平缓的状态,与生理盐水对照组相比差异不显著(P>0.05)。瑞士乳杆菌刺激后IL-6的分泌情况与长期灌胃益生菌组小鼠肠道黏膜中IL-6的含量具有相类似的情况[7]。
2.2.3 灌胃瑞士乳杆菌对小鼠肠黏膜IFN-γ/IL-4比值的影响
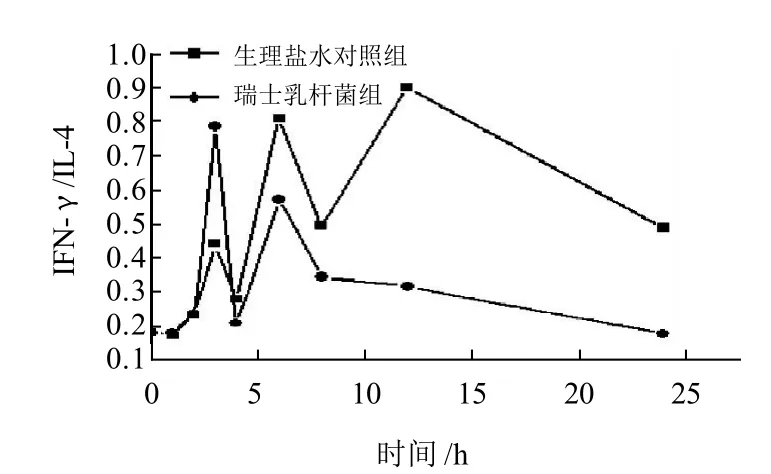
图6 灌胃瑞士乳杆菌对小鼠肠黏膜IFN-γ/IL-4比值的影响Fig.6 Effect of Lactobacillus helveticus by oral administration on the ratio of IFN-γ/IL-4 in intestinal mucosa of mice
对Th1型和Th2型细胞比例的分析结果如图6所示,瑞士乳杆菌组的IFN-γ/IL-4比值与生理盐水对照组相比,在第3小时差异显著(P<0.05),随后第4小时和第6小时又表现为差异不显著(P>0.05),并在第12小时呈现极显著的升高(298.46),后期急剧下降,但与生理盐水对照组相比差异显著(P<0.05)。这说明了IFN-γ是Th1型的细胞因子,当Th2型细胞因子增多时Th1细胞因子也要增多以抑制Th2型细胞因子的产生,调节机体的平衡。可见,短时间的灌胃并不能完全反映瑞士乳杆菌以及益生菌的调节作用,长期灌胃更能正确地反映益生菌效用价值。
3 讨 论
分泌型IgA (SIgA)是机体内肠黏膜表面分泌的主要免疫球蛋白,也是防御致病菌在肠道黏膜黏附和定植的第一道防线。机体黏膜B细胞通过免疫受体和微生物抗原的交互作用,特异性的移到生发中心,SIgA浆细胞在黏膜淋巴滤胞中发育,均沿上皮层分布,弥散定居于黏膜下层各位点。有些细胞因子可调节SIgA的表达,如IL-4和TGF-β促进B细胞发生IgA类型转换,IFN-γ通过拮抗IL-4 抑制IgA抗体的分泌。Th2型细胞因子IL-5、IL-6和IL-10可促进IgA的分泌。本研究证实了灌胃瑞士乳杆菌TS206对肠黏膜高水平分泌SIgA起到了显著的促进作用,这可能是由于瑞士乳杆菌有效地通过受体竞争作用使黏膜的分泌,或者是诱导肠道淋巴组织的免疫功能来保护黏膜的[10]。另外,瑞士乳杆菌对肠黏膜的保护可能主要归功于“定殖障碍”。“定殖障碍”是描述某些细菌抑制其他种类细菌定殖的作用,如营养和复位点的竞争,改变环境的pH值,产生细菌素或其他抗菌肽等。这种定殖构成了一种强烈的黏膜屏障功能,从而防止致病菌的吸附和入侵。众多的研究报道表明益生菌能够通过多种信号转导途径对机体的天然和获得性免疫系统进行调节,抑制异常的自身免疫反应,维持肠道稳态[4-8]。
随着分子生物学技术的不断发展,大大推动了促炎性细胞因子与抗炎性细胞因子的研究,特别对炎症性肠病(IBD)的发病机制的研究和相关肠道疾病的治疗进展[11-12],Th1/Th2平衡理论已为解释一些自身免疫性疾病提供了很好的模型。Th细胞根据CD4+细胞分泌的两类不同细胞因子分为Th1和Th2细胞,Th1细胞主要分泌IL-2、IFN-γ等,而Th2细胞主要分泌IL-4、IL-6、IL-10等。Th1/Th2细胞具有相互拮抗作用,通过阻止另一类细胞的产生效应功能以实现影响Th1/Th2细胞间的平衡,IFN-γ能促进Th2细胞分化为Th1细胞,影响Th1/Th2比率,而IL-4能促进Th0细胞分化为Th1细胞,并抑制Th1细胞,分泌其系列因子,促进机体免疫应答。Th1细胞主要介导与细胞和局部炎症有关的免疫应答,参与细胞免疫;而Th2细胞的主要功能为刺激及细胞增生并产生抗体与体液免疫有关。机体要处于良好的免疫状态,应保持Th1/Th平衡,才能使机体不处于免疫抑制状态。本研究结果显示IL-2和IL-6在第6小时达到最高点;IL-4在第1小时达到最高点;IFN-γ在第3h达到最高值,表明Th1/Th2细胞处于相互拮抗状态;IFN-γ/IL-4值在第3小时达到最高点,此后开始呈波动式下降,在第24小时降至和灌胃前的水平比较接近的状态。因此,实验结果表明灌胃一定剂量的瑞士乳杆菌对肠黏膜细胞因子的表达是一种上调的趋势,细胞因子的变化比较快速,在短期内就能达到较高的水平,处于平缓期的水平也是高于对照组的,不是无限增加的,而是在调节机体平衡的同时细胞因子趋于一定的水平,短期内的瑞士乳杆菌的刺激使细胞因子明显增多但是波动较大,没有长期灌胃时表现出较好的规律性。但研究也明显地表明了刺激在12h后细胞因子会慢慢趋向于一个比较恒定的水平,最终保持Th1型和Th2型T细胞逐渐趋于正常比例,达到维持机体的健康。
[1] 马玉龙, 许梓荣. 肠道黏膜免疫研究进展[J]. 中国畜牧兽医, 2004,31(2): 27-29.
[2] 金伯泉. 细胞和分子免疫学[M]. 2版. 北京: 科学出版社, 2001: 539-581.[3] 郭宇星, 陈庆森, 赵林森, 等. 瑞士乳杆菌发酵法制备乳清蛋白源性ACE抑制肽的研究[J]. 食品科学, 2006, 27(6): 151-154.
[4] 王友湘, 陈庆森. 瑞士乳杆菌对小鼠肠道微生物区系影响[J]. 食品科学, 2008, 29(9): 542-546.
[5] de SIMONE C, TZANTZOGLOU S, BALDINELLI L, et al. Ehancement of host resistance against Salmonella typhimurium infection by a diet supplement with yogurt[J]. Immunopharmacol Immunotoxical, 1988,10(3): 399-415.
[6] PERDIGON G, ALVAREZ S, NADER-de-MACIASM E, et al. The oral administration of lactic acid bacteria increase the mucosal intestinal immunity in response to enteropathogens[J]. Journal of Food Protection,1990, 53(5): 404-410.
[7] 曹晋宜, 韩军丽, 王友湘, 等. 瑞士乳杆菌对小鼠肠道黏膜和肠组织中细胞因子影响的研究[J]. 食品科学, 2009, 30(21): 343-347.
[8] 王友湘, 陈庆森. 瑞士乳杆菌菌体的分离以及对小鼠肠道黏膜SIgA影响的研究[J]. 食品研究与开发, 2008, 29(5): 50-52.
[9] 王友湘, 陈庆森, 阎亚丽. 用于乳酸菌分离鉴定的几种培养基的筛选及应用[J]. 食品科学, 2007, 28(9): 374-378.
[10] MADSEN K L. The use of probiotics in gastrointestinal disease[J]. Can J Gastroenterol, 2001, 12: 817-822.
[11] GROUX H, POWRIE F. Regulatory T cells and inflammatory bowel disease[J]. Immunol Today, 1999, 20: 442-445.
[12] FANTINI M C, MONTELEONE G, MACDONALD T T. New players in the cytokine orchestra of inflammatory bowel disease[J]. Inflamm Bowel Dis, 2007, 13: 1419-1423.
Effects of Lactobacillus helveticus on Immune Response and Cytokines in Intestinal Mucosa of Mice
JIA Yu-chen,CHEN Qing-sen*,WANG You-xiang,YAN Ya-li
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce,Tianjin 300134, China)
Our aim was to investigate the effects of Lactobacillus helveticus TS206 on intestinal immune response and cytokines in intestinal mucosa of healthy Balb/c mice. Mice were randomly assigned to three groups - normal control group, saline control group and L.helveticus group which were administered with the dose 108CFU/mL. All the mice were executed after 0, 1, 2, 3, 4,6, 8, 12, 24 h of administration and the SIgA and cytokines concentration were determined in intestine mucosa of all mice by radioimmunoassay (RIA) and enzyme linked immunosorbent assay (ELISA). The results showed that compared with control group and physiological saline group, the SIgA content in intestinal mucosa of mice with the oral administration of L. helveticus was significant different (P<0.01); IL-2 and IFN-γ content was also significant different (P<0.05). IL-4 content in the intestinal mucosa of mice from treatment was significantly higher than control (P<0.05), but not IL-6 expression level (P>0.05). IFN-γ/IL-4 ratio exerted mutual antagonistic action, suggesting that L. helveticus maintain mucosa immunization balance in healthy mice,and also keep Th1/Th2 balance. Our results indicate that probiotic bacteria L.helveticus is provided with modulation of immune response in intestinal mucosa of mice.
Lactobacillus helveticus;cytokine;intestinal mucosa;mmune response
TS201.3
A
1002-6630(2010)23-0335-05
2010-09-20
国家自然科学基金项目(30771524;31071522)
贾玉臣(1985—),男,硕士研究生,研究方向为发酵生物技术、乳品质量与安全。E-mail:jychtotti@163.com
陈庆森(19 57—),男,教授,硕士,研究方向为发酵生物技术、生物活性物质。E-mail:chqsen@tjcu.edu.cn

