草鱼鱼鳞中活性胶原蛋白提取工艺及参数优化
王 艳,汪海波*,桂 萌,王孟津,张含俊,刘良忠
(武汉工业学院食品科学与工程学院,湖北 武汉 430023)
草鱼鱼鳞中活性胶原蛋白提取工艺及参数优化
王 艳,汪海波*,桂 萌,王孟津,张含俊,刘良忠
(武汉工业学院食品科学与工程学院,湖北 武汉 430023)
以草鱼鱼鳞为原料,在低于蛋白变性温度的条件下提取酸溶性胶原蛋白(ASC)和酶溶性胶原蛋白(PSC),并对鱼鳞原料的前处理方法、胶原蛋白提取工艺进行优化。结果表明,在鱼鳞原料的前处理工艺中,以0.1mol/L的Na2CO3溶液为试剂脱除原料中杂蛋白的最佳工艺条件为室温、料液比1:40(g/mL),300r/min搅拌处理3次,每次6h;以0.3mol/L的EDTA为试剂脱除原料中矿物质杂质的最佳工艺条件为室温、料液比1:60,搅拌处理3次,每次12h;ASC的最佳提取工艺条件为:提取温度不高于25℃,料液比1:60,醋酸浓度0.8mol/L,提取3次,每次24h;PSC的最佳提取工艺条件为:胃蛋白酶用量为鱼鳞原料质量的3.0%、醋酸浓度0.8mol/L、料液比1:30、提取温度4℃、提取2次,每次24h。
草鱼鱼鳞;胶原蛋白;提取;参数优化
Abstract:Acid-soluble collagen (ASC) and pepsin-soluble collagen (PSC) were extracted from the scales of grass carp at low temperature, and optimal extraction parameters were explored. The optimal parameters for removing impurity proteins from fish scales with 0.1 mol/L Na2CO3 were material/liquid ratio of 1:40 for mixing 3 times for 6 h each time at room temperature. The optimal parameters for removing mineral impurities with 0.3 mol/L EDTA were material/liquid ratio of 1:60 for mixing 3 times 12 h for each time at room temperature. The optimal parameters for ASC extraction were material/liquid ratio of 1:60 for extraction with 0.8 mol/L acetic acid 3 times for 24 h each time at 25 ℃. The optimal parameters for PSC extraction were amount of pepsin on the basis of the weight of fish scales, 3.0%; acetic acid concentration, 0.8 mol/L; and material/liquid ratio 1:30 for twice extraction at 4 ℃ for 24 h each time.
Key words:the scales of grass carp;collagen;extraction;optimal parameters
中国是世界上水产品产量最大的国家,淡水鱼产量约占全国水产总量的60%左右。近年来,我国淡水鱼养殖业迅猛发展的同时也带动了水产加工业规模的不断提高,这也就意味着养殖产量较高的低值淡水鱼加工品的比例将越来越大,其加工下脚料如鱼鳞、鱼皮和鱼骨等也将逐年增长。目前,国内对这些下脚料没有充分利用,造成了严重的资源浪费并污染环境。研究表明,淡水鱼鱼鳞、鱼皮中含有丰富的胶原蛋白,通过提取利用和产品开发,这些胶原蛋白资源,特别是保持完整三螺旋结构的活性胶原蛋白在化妆品、生物医学材料以及食品添加剂等领域均具有潜在的开发和应用价值[1-9]。目前,国内对淡水鱼中胶原资源的开发尚处于起步阶段,相关研究主要集中在胶原产品的结构鉴定和性能表征等方面。如张艳等[10]从草鱼皮中提取胶原蛋白并分析了其氨基酸组成、变性温度和蛋白质分子质量;钟朝辉等[11-12]系统研究了草鱼鱼鳞中酶溶性胶原蛋白的黏度特性和分子的溶液行为;王孟津等[13]和王海波等[14]曾对草鱼鱼鳞中胶原蛋白的基本理化性能、生物力学性能等进行了相关研究。胶原蛋白的性能与胶原类型、来源以及提取方法等因素有密切关联,其中,胶原蛋白的提取方法对如何获取高活性、高产率的胶原产品具有至关重要的影响。目前,国内针对淡水鱼中胶原蛋白提取工艺和提取方法的研究较少且缺乏系统性,这在一定程度上阻碍了淡水鱼胶原资源的开发进程。为此,本研究以草鱼鱼鳞为原料,在低于胶原变性温度的条件下提取、制备活性胶原蛋白产品,系统研究胶原蛋白提取过程中,原料的预处理方法和酸溶性胶原蛋白(ASC)、酶溶性胶原蛋白(PSC)的最佳提取工艺条件与工艺参数,为淡水鱼鱼鳞胶原蛋白的开发和应用提供可以借鉴的科学依据。
1 材料与方法
1.1 材料与试剂
市售新鲜草鱼,取鱼鳞,用清水仔细洗涤干净后冷冻保藏备用。
胃蛋白酶(3000U/g) 武汉市华顺生物技术有限公司;羟脯氨酸标准品 Sigma公司;无水Na2CO3、NaCl、NaOH、EDTA等(均为国产分析纯)。
1.2 仪器与设备
Cary-50型紫外-可见分光光度计 美国Varian公司;DF-101S型集热式恒温磁力搅拌机 江省金坛市医疗仪器厂;TDL-50型离心机 上海安亭科学仪器厂;ZFQ85-A型旋转蒸发器 上海亚荣生化仪器厂;Lg105-2型真空冷冻干燥机 北京医用实验仪器厂。
1.3 方法
1.3.1 鱼鳞胶原蛋白的制备工艺路线
工艺流程:鱼鳞→清水漂洗、沥干→低温鼓风干燥→粉碎→浸泡脱除杂蛋白→清水漂洗、沥干→浸泡脱除矿物杂质→清水漂洗、沥干→提取酸溶性胶原蛋白(ASC)→残渣→提取酶溶性胶原蛋白(PSC)
操作要点:鱼鳞洗涤沥干后用一定料液比(g/mL)的溶剂浸泡脱除可溶性杂蛋白,分离上清液后,残渣继续用一定料液比的EDTA溶液脱除原料中的矿物质杂质,脱杂后的鱼鳞依次用醋酸和醋酸+胃蛋白酶提取酸溶性胶原蛋白(ASC)和酶溶性胶原蛋白(PSC)。前期研究[13]表明,草鱼鱼鳞酸溶性胶原蛋白和酶溶性胶原蛋白的变性起始温度分别为30℃和28℃,因此本次实验中,在无特殊说明的情况下,所有提取操作过程均在低于25℃的条件下完成。
1.3.2 羟脯氨酸的定量测定方法
本实验通过测定胶原蛋白特征氨基酸——羟脯氨酸含量的方法,间接评价胶原蛋白的提取效果。参考文献[15]方法,以羟脯氨酸为标准品,以对二甲基氨基苯甲醛为显色剂,比色法定量测定羟脯氨酸含量,测定标准曲线为y=0.0636X+0.0896,式中:X为羟脯氨酸质量浓度/(mg/L);y为561nm处吸光度(A),R2=0.9991。
1.3.3 鱼鳞原料及提取液中羟脯氨酸总含量的测定
精确称取1g鱼鳞粉,加入50mL浓度为6mol/L的盐酸,在105℃鼓风干燥箱中密封水解24h,用蒸馏水定容至100mL。准确移取1mL该水解液,用NaOH溶液调节pH值至6.0后蒸馏水定容至100mL,按1.3.2节方法测定羟脯氨酸含量,计算出鱼鳞中羟脯氨酸总含量为77.5mg/g鱼鳞原料(干基)。吸取10mL胶原蛋白提取液,按上述方法测定提取液中羟脯氨酸的含量,计算羟脯氨酸的提取率。

1.3.4 脱杂上清液中钙离子和杂蛋白的定量测定
参考国标GB/T 15452—95《工业循环冷却水中钙、镁离子的测定》中方法测定脱杂上清液中钙离子总含量,通过测定一定体积脱杂上清液在280nm处吸光度的方法评价溶液体系中蛋白含量。
1.3.5 草鱼鱼鳞中杂蛋白的脱除及参数优化
分别采用NaOH、NaCl、Na2CO3溶液作为杂蛋白的脱除试剂,进行脱杂蛋白处理。精确称取1g鱼鳞粉,精确加入50mL的脱杂试剂,浸泡10h后吸取脱杂上清液,分别测定其在280nm处的吸光度和溶液中羟脯氨酸含量,综合比较几种试剂脱除杂蛋白的效果和胶原蛋白的流失情况(用羟脯氨酸的溶出率为评价指标)。以Na2CO3溶液作为杂蛋白的脱除试剂,分别改变Na2CO3浓度、处理温度、时间、料液比、处理次数等条件因素,考察各因素对杂蛋白脱除效果的影响。

1.3.6 草鱼鱼鳞中矿物质杂质的脱除及参数优化
选择EDTA溶液作为鱼鳞中矿物质杂质的脱除试剂,以脱杂上清液中钙离子总含量为评价指标,分别考察EDTA溶液浓度、脱杂温度、料液比等因素对矿物质杂质脱除效果的影响。
1.3.7 草鱼鱼鳞中酸溶性胶原蛋白的提取工艺研究
经过脱除杂蛋白和矿物质杂质处理后的鱼鳞经过充分洗涤和低温干燥,作为胶原蛋白提取原料。以醋酸溶液为提取溶剂,分别改变醋酸浓度、提取温度、时间、提取次数等因素,考察不同条件因素对ASC提取效果的影响。在单因素试验的基础上,选择料液比、醋酸浓度和提取时间做三因素三水平正交试验。
1.3.8 草鱼鱼鳞中酶溶性胶原蛋白的提取工艺研究
提取酸溶性胶原蛋白后的鱼鳞残渣经过充分洗涤和低温干燥后,作为胶原蛋白提取原料。以胃蛋白酶作为水解酶,以醋酸为提取溶剂,分别考察酶用量、提取料液比、提取时间等因素对PSC提取效果的影响,并在单因素试验的基础上,选择加酶量、醋酸浓度和提取温度做三因素三水平正交试验。
2 结果与分析
2.1 鱼鳞原料中杂蛋白脱除工艺与参数优化
2.1.1 杂蛋白脱除试剂的选择
除胶原蛋白外,鱼鳞中还含有部分其他种类的杂蛋白成分,必须在提取胶原蛋白之前予以去除,这样可以有效降低后续纯化的难度并提高胶原产品的纯度。本实验分别以0.5mol/L的Na2CO3、NaCl和NaOH溶液作为杂蛋白脱除试剂,以脱杂上清液中羟脯氨酸溶出率和280nm处吸光度作为脱杂效果的评价指标,比较不同试剂的杂蛋白脱除效果和胶原蛋白流失情况。实验结果如图1所示。
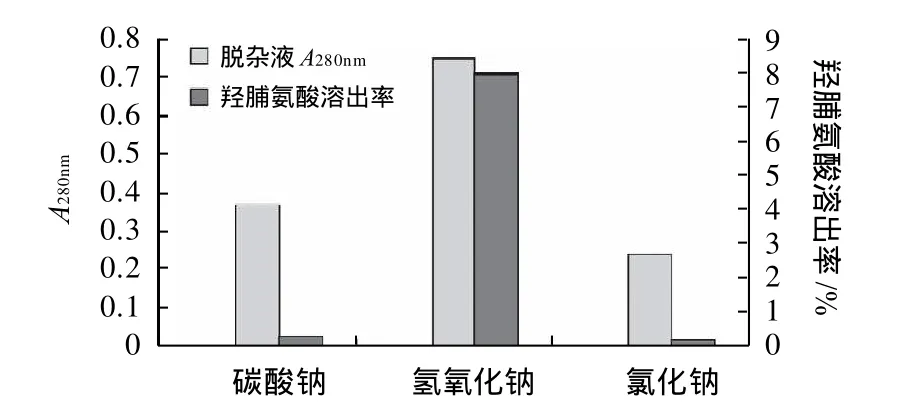
图1 不同试剂对杂蛋白脱除效果的比较Fig.1 Comparison of the removal of protein impurities using different solvents
由图1可得,在相同浓度下,NaOH溶液对蛋白质有极高的溶出率,但在溶出杂蛋白的同时,鱼鳞原料中胶原蛋白(羟脯氨酸)的流失率也远高于其他两种脱杂试剂;与NaCl溶液和NaOH溶液相比,Na2CO3溶液脱杂上清液中胶原蛋白的流失率远低于NaOH溶液,而其对杂蛋白的脱除效果明显优于NaCl溶液,因此最终优选Na2CO3溶液作为杂蛋白的脱除试剂。
2.1.2 杂蛋白脱除工艺参数的优化
选择Na2CO3溶液作为杂蛋白的脱除试剂,以脱杂上清液在280nm处吸光度为测定指标,分别改变Na2CO3溶液浓度、操作温度、时间等条件,考察各因素对杂蛋白脱除效果的影响。实验结果如图2所示。
由图2可得,Na2CO3浓度在0.1~0.9mol/L、脱杂料液比在1:40~1:100范围内改变时,杂蛋白脱除效果变化不大;温度和搅拌操作对杂蛋白脱除效果有比较明显的影响,高速搅拌和提高体系温度可有效增强杂蛋白的溶出率,但考虑到淡水鱼胶原蛋白的体外变性温度一般均低于30℃,因此仍选择25℃作为杂蛋白的脱除温度;杂蛋白脱除操作重复3次,每次脱杂处理6h后,脱杂上清液中蛋白质溶出率不再增加。因此,鱼鳞原料中杂蛋白脱除的优选工艺参数为:以0.1mol/L的Na2CO3溶液为脱杂试剂,料液比1:40,室温,300r/min搅拌脱杂3次,每次6 h。
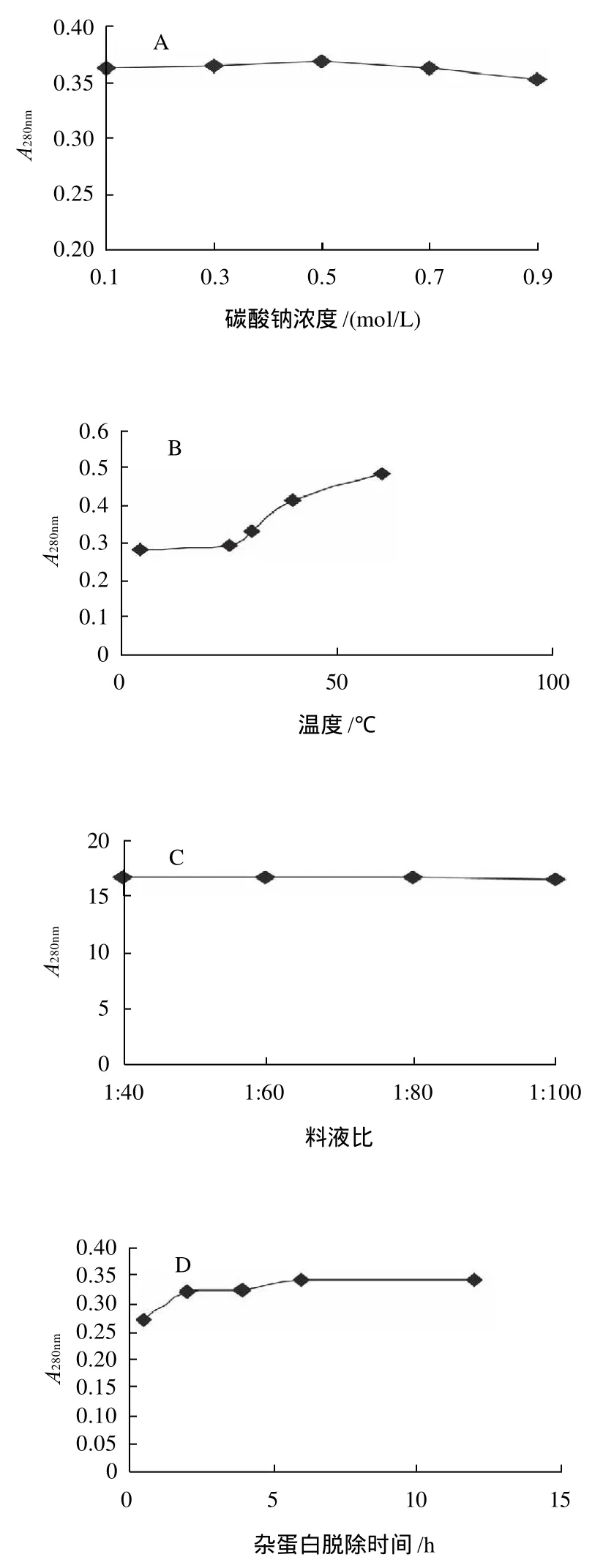
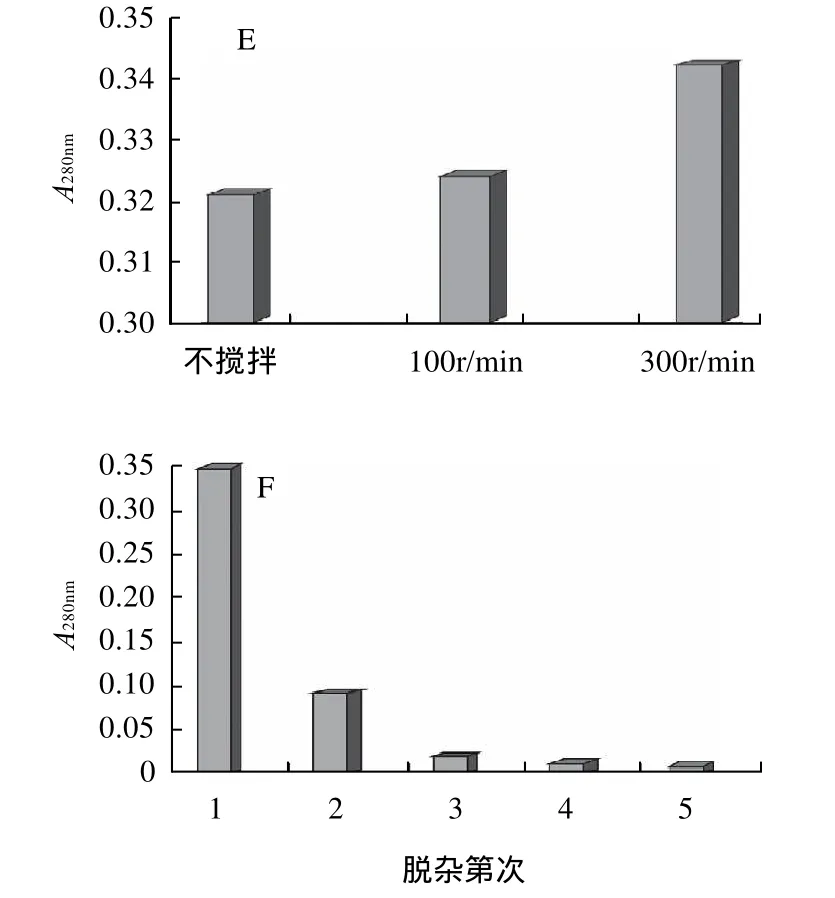
图2 不同因素对杂蛋白脱除效果的影响Fig.2 Effects of different factors on the removal of protein impurities
2.2 鱼鳞原料中矿物质杂质脱除工艺参数优化
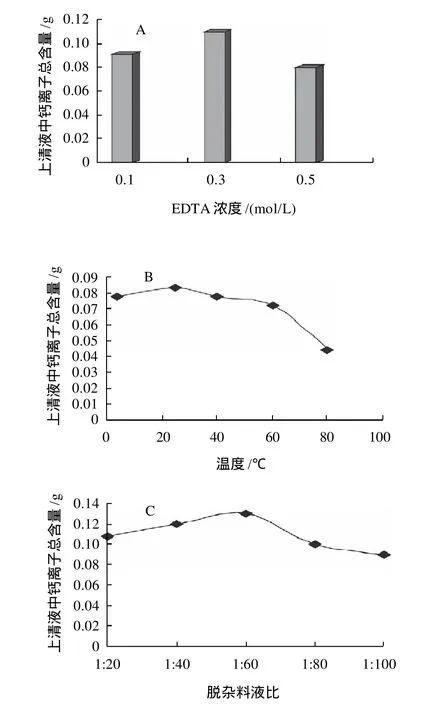

图3 不同因素对矿物质杂质脱除效果的影响Fig.3 Effect of different factors on the removal of mineral impurities
以羟基磷灰石为主要存在形式的矿物质是鱼鳞中的主要组成成分之一,鱼鳞中的胶原蛋白往往与矿物质成分紧密的结合在一起,增加了胶原的提取难度。研究表明[7],酸溶液和EDTA溶液对鱼鳞中的矿物质杂质均具有理想的脱除效果,但是酸溶液在脱除矿物质杂质的同时也会导致原料中酸溶性胶原蛋白的流失,因此本研究选择EDTA作为鱼鳞原料中矿物质杂质的脱除试剂。以脱杂上清液中钙离子含量作为脱杂效果的监测指标,分别考察EDTA浓度、脱杂温度、料液比以及脱杂时间和脱杂次数等因素对鱼鳞中矿物质杂质脱除效果的影响,结果如图3所示。
由图3可得,EDTA浓度为0.3mol/L、料液比为1:60、浸泡脱杂时间12h的条件下脱杂效果最好;25℃时最有利于矿物质杂质的脱除;脱杂操作重复3次后,EDTA脱杂液对矿物质杂质的溶出率不再增加。
2.3 草鱼鱼鳞中酸溶性胶原蛋白(ASC)的提取工艺
草鱼鱼鳞原料经脱除杂蛋白和矿物质杂质后,以醋酸为提取溶剂,提取酸溶性胶原蛋白(ASC),以胶原蛋白特征氨基酸——羟脯氨酸的提取率作为胶原蛋白提取效果的监测指标,别通过单因素试验和正交试验研究了不同提取条件因素对ASC提取效果的影响并确定了ASC的最佳提取工艺参数,实验结果如图4和表1所示。
单因素试验结果表明,提高提取温度和醋酸浓度有利于ASC的提取,但考虑到淡水鱼胶原蛋白的变性温度一般低于30℃以及高酸度条件下可能导致胶原分子结构的改变,因此仍选择在较低的酸度和低于室温的条件下提取较为适宜;增加提取次数、提高提取料液比和延长提取时间均可提高ASC的提取率,但当单次提取时间超过24h、提取次数超过3次后,ASC的提取率不再增加。正交试验结果表明,在单次提取过程中,醋酸浓度、提取料液比和提取时间3因素对ASC提取效果的影响依次减弱。结合单因素试验和正交试验的结果,以醋酸为溶剂提取ASC的最佳提取工艺条件是:提取温度不高于25℃,料液比1:60,醋酸浓度0.8mol/L,提取3次,每次提取时间24h。
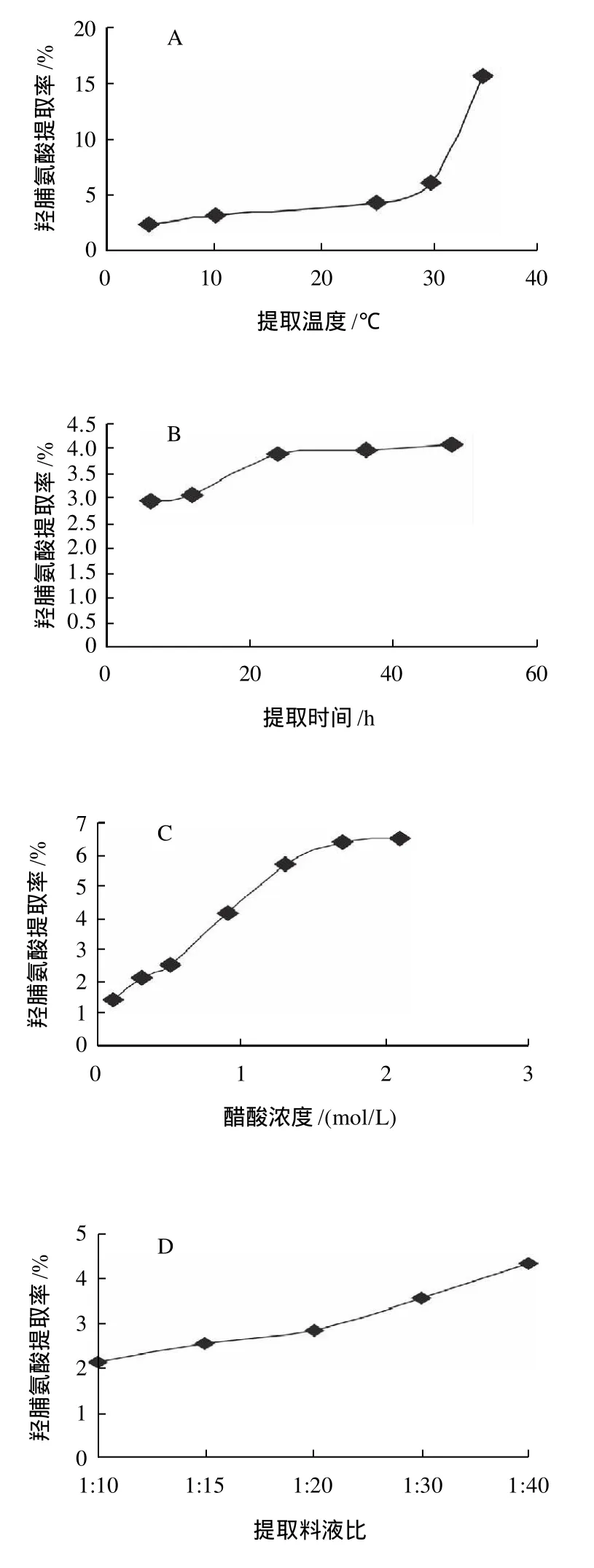

图4 ASC提取单因素试验Fig.4 Effects of different factors on ASC extraction

表1 ASC提取正交试验设计及结果Table 1 Arrangement of the orthogonal array design for optimizing ASC extraction and experimental results
2.4 草鱼鱼鳞中酶溶性胶原蛋白(PSC)的提取工艺研究

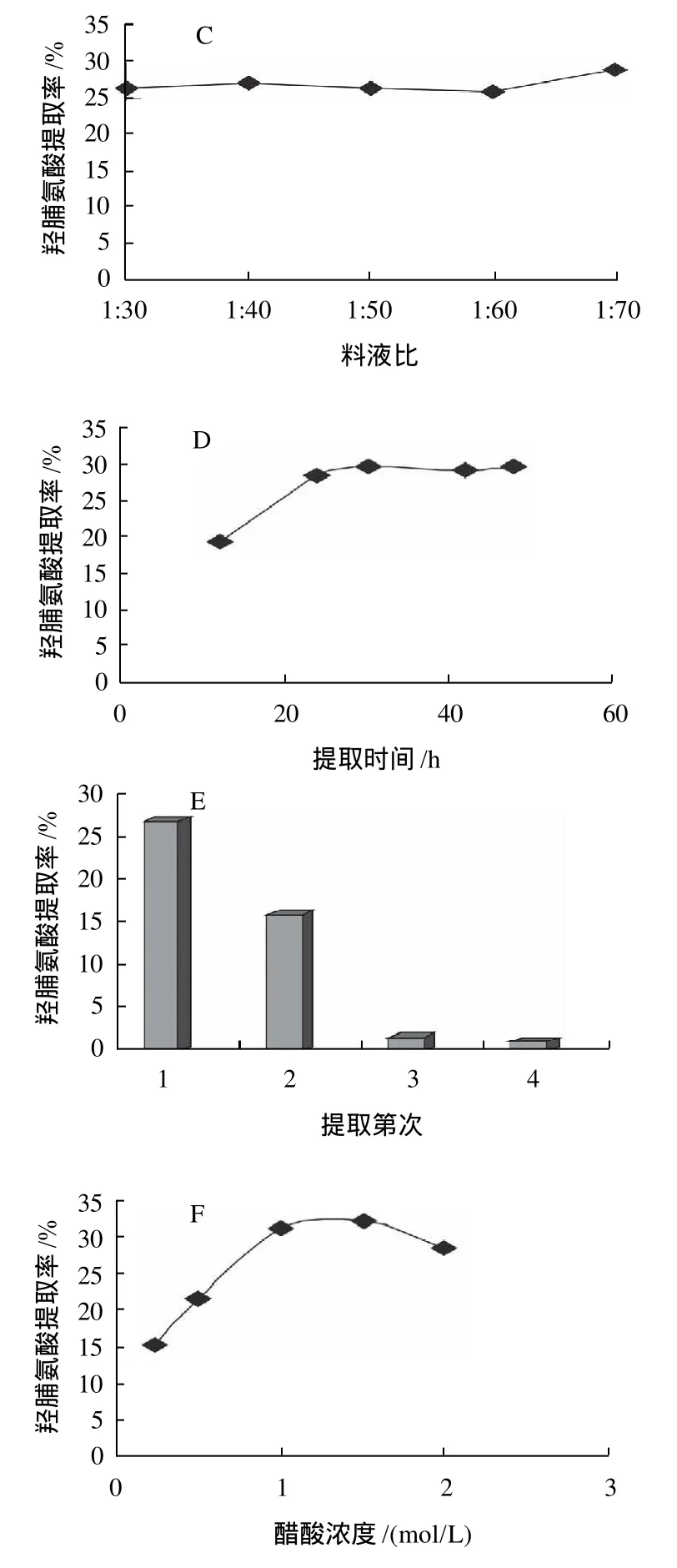
图5 PSC提取单因素试验Fig.5 Effects of different factors on PSC extraction
以提取ASC后的鱼鳞残渣为原料,采用胃蛋白酶水解结合醋酸提取的方法进一步提取酶溶性胶原蛋白(PSC),以胶原蛋白特征氨基酸——羟脯氨酸的提取率作为胶原蛋白提取效果的监测指标,分别通过单因素试验和正交试验研究不同提取因素对PSC提取效果的影响并确定了PSC的最佳提取工艺参数,实验结果如图5和表2所示。
单因素试验结果表明,在胃蛋白酶添加量为鱼鳞原料质量的2.5%、醋酸浓度为1.0mol/L、提取时间24h的条件下,PSC的提取率达到最大,在低于胶原蛋白变性温度时,提高酶水解提取温度会降低PSC提取率,在高于胶原蛋白变性温度时,PSC提取率随温度的升高而增加;2次提取可有效提高PSC的提取效率,但进一步增加提取次数后,PSC的总提取率增加不明显;增大提取料液比对提取效果的影响不大。正交试验结果表明,在所选择的3个影响因素中,酶添加量、醋酸浓度和提取温度对PSC提取效果的影响依次减弱。结合单因素试验和正交试验的结果,PSC的提取最佳工艺条件为胃蛋白酶用量为鱼鳞原料质量的3.0%、醋酸浓度0.8mol/L、提取料液比1:30、提取温度4℃、提取2次,每次提取时间24h。
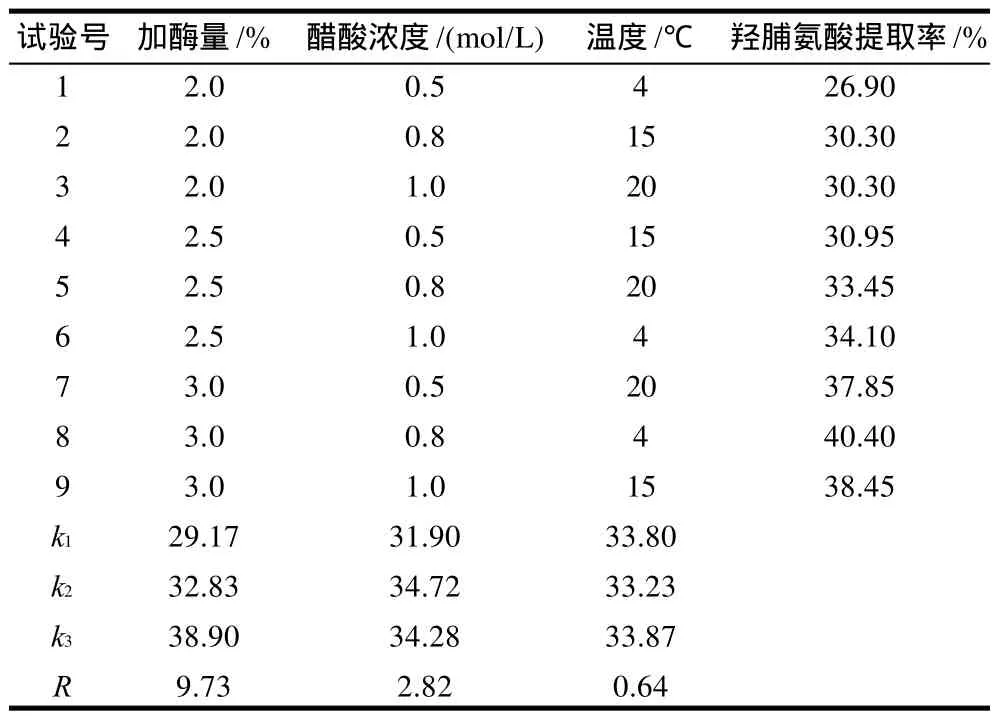
表2 PSC提取正交试验设计及结果Table 2 Arrangement of the orthogonal array design for optimizing PSC extraction and experimental results
3 结 论
以草鱼鱼鳞为原料,分别采用Na2CO3溶液脱杂蛋白、EDTA溶液脱矿物质杂质的方法进行原料的前处理以提高鱼鳞胶原蛋白的提取效率和产品纯度;经过前处理的鱼鳞原料依次用酸溶液和胃蛋白酶与酸溶液提取酸溶性胶原蛋白和酶溶性胶原蛋白。本实验重点研究了鱼鳞前处理的方法、工艺条件以及酸溶性胶原蛋白和酶溶性胶原蛋白的最佳工艺条件,结果表明:鱼鳞原料中杂蛋白脱除的优选工艺参数为以0.1mol/L的Na2CO3溶液为脱杂试剂、料液比1:40、室温、300r/min搅拌脱杂3次、每次6h;鱼鳞原料中矿物质杂质脱除的适宜艺条件为以0.3mol/L的EDTA溶液为脱杂试剂、在25℃条件下脱杂、料液比为1:60、搅拌提取3次、每次12h;ASC的适宜取工艺条件为提取温度不高于 25℃、料液比1:60、醋酸浓度0.8mol/L、提取3次、每次提取时间24h;PSC的适宜提取工艺条件为胃蛋白酶用量为鱼鳞原料质量的3.0%、醋酸浓度0.8mol/L、提取料液比1:30、提取温度4℃、提取2次,每次提取时间24h。
[1] LI Fan, JIA Dongying, YAO Kai. Amino acid composition and functional properties of collagen polypeptide from Yak bone[J]. Food Science and Technology, 2009, 42(5):945-949.
[2] ZEUGOLIS D I, PAUL R G, ATTENBURROW G. Post-self-assembly experimentation on extruded collagen fibres for tissue engineering applications[J]. Acta Biomaterialia, 2008, 4(6):1646-1656.
[3] Olde DAMINK L H, DIJKSTRA P J.In vitrodegradation of dermal sheep collagen cross-linked using a water-soluble carbodiimide[J].Biomaterials, 2008, 17(7):679-684.
[4] ROCHE S, RONZIERE M C, HERBAGE D, et al. Native and DPPA cross-linked collagen sponges seeded with fetal bovine epiphyseal chondrocytes used for cartilage tissue engineering[J]. Biomaterials, 2006,22(1):9-18.
[5] SANKAR S, SEKAR S, MOHAN R, et al. Preparation and partial characterization of collagen sheet from fish scales[J]. International Journal of Biological Macromolecules, 2008, 42(1):6-9.
[6] PIPATCHAROENWONG C, GARNJANAGOONCHORN W,JIRAPAKKUL W. Collagen extraction of red snapper scales[C]. Bangkok:Proceedings of the 46thKasetsart University Annual Conference, 2008:33-40.
[7] HARADA O, KUWATA M, YAMAMOTO T. Extraction of gelatin from sardine scales by pressurized hot water[J]. Journal of the Japanese Society for Food Science and Technology, 2007, 54(6):261-265.
[8] NAGAI T, SUZUKI N, NAGASHIMA T. Collagen from common minke whale (Balaenoptera acutorostrata) unesu[J]. Food Chemistry,2008, 111(2):269-301.
[9] ESPE M, GULBRANDSEN K E. Age of farmed atlantic salmon at seawater transfer affects muscle collagen content and solubility at harvest[J]. Journal of Food Science, 2003, 68(5):1814-1817.
[10] 张艳, 李国英, 缪煜清, 等. 草鱼皮胶原的提取及性能的初步研究[J].水产科学, 2006, 25(3):136-139.
[11] 钟朝辉, 李春美, 窦宏亮, 等. 草鱼鱼鳞酶溶性胶原蛋白粘度特性及变性温度研究[J]. 食品与发酵工业, 2006, 32(6):64-68.
[12] 钟朝辉, 李春美, 顾海峰, 等. 草鱼鱼鳞酶溶性胶原蛋白的提取及基本性能研究[J]. 水产科学, 2007, 26(2):91-94.
[13] 王孟津, 汪海波, 桂萌, 等. 草鱼鱼鳞胶原蛋白的提取及其理化性质研究[J]. 食品科学, 2009, 30(18):113-117.
[14] 汪海波, 王孟津, 张寒俊, 等. 草鱼鱼鳞胶原蛋白的流变学性能研究[J]. 食品科学, 2009, 30(23):138-141.
[15] NAGAI T, SUZUBI N. Isolation of collagen from fish waste material—skin, bone and fins[J]. Food Chemistry, 2000, 68(3):227-281.
Extraction Optimization of Collagen from Grass Carp Scales
WANG Yan,WANG Hai-bo*,GUI Meng,WANG Meng-jin,ZHANG Han-jun,LIU Liang-zhong
(School of Food Science and Technology, Wuhan Polytechnic University, Wuhan 430023, China)
TS201.7
A
1002-6630(2010)18-0070-07
2010-06-21
湖北省自然科学基金重点项目(2009CDA117);武汉市科技局科技攻关计划项目(200920137006);武汉工业学院研究生创新性实验计划资助项目(ZD16)
王艳(1987—),女,硕士研究生,研究方向为天然产物化学。E-mail:wy2008@163.com
*通信作者:汪海波(1971—),男,教授,博士,研究方向为天然产物化学。E-mail:wanghaibo@whpu.edu.cn

