高温油藏采出液中嗜热产甲烷古菌的分离鉴定
刘海昌,兰贵红,刘全全,张文静,曹毅,邓宇,张辉
1 农业部能源微生物与利用重点开放实验室,成都 610041
2 四川大学生命科学学院,成都 610065
研究报告
高温油藏采出液中嗜热产甲烷古菌的分离鉴定
刘海昌1,兰贵红2,刘全全1,张文静1,曹毅2,邓宇1,张辉1
1 农业部能源微生物与利用重点开放实验室,成都 610041
2 四川大学生命科学学院,成都 610065
为了进一步从高温油藏中发掘新的微生物种质资源,采用 Hungate 厌氧操作技术从大港油田油井采出水中分离出一株嗜热自养产甲烷杆菌DL-7。生理生化结果显示菌株DL-7只能够利用H2/CO2生长,不利用甲酸、甲醇、三甲胺、乙酸和二级醇类;最适生长温度60℃;最适盐浓度0.8 g/L;最适pH为7.0~7.5;只有在添加酵母粉的培养基中才可以较好生长。16S rRNA序列比对结果显示菌株DL-7与标准株M. marburgensisDSM 2133T (X15364) 的16S rRNA基因序列相似性为99.7%。
油藏微生物,热自养产甲烷杆菌,系统发育分析
Abstract:To explore new microbial resources in deep subsurface oil reservoirs, strain DL-7 was isolated with Hungate technology from oil reservoir water sampled from Dagang oilfield, China. Physiological and biochemical examinations showed that H2/CO2is the unique substrate of the strain, which cannot metabolize formate, methanol, trimethylamine, acetate and other secondary alcohols. The optimum growth conditions were further identified to be 60°C, pH 7.0−7.5 and 0.25% NaCl. Moreover, the strain cannot grow without yeast extract. Analysis of its 16S rRNA sequence indicated that a similarity of 99.7% presents between the strain and the model speciesM. marburgensisDSM2133T (X15364).
Keywords:microorganisms in petroleum reservoir, thermautotrophic methanogen, phylogenetic analysis
已有的地球化学证据表明,产甲烷古菌进化史可以追溯到35亿年前,几乎等同于地球生命的进化史。尽管产甲烷古菌是地球上最古老的物种之一,但它们却广泛分布于各种环境中[1]。地下油藏是一个特殊的生境,生物地球化学研究结果证实,产甲烷条件下的烃降解是地下油藏中烃类物质的主要代谢途径[2];分子生态研究也表明,在缺氧、高温、高矿化度和营养匮乏的油藏中分布着种类丰富的产甲烷古菌。近年来,我们从高温油藏中分离到多株嗜热产甲烷古菌,其中包括产甲烷古菌新科1个 (甲热球菌科 Methermicoccaceae[3]) 和新种 1个 (石油甲烷袋状菌Methanoculleus receptaculi)[4]。目前分离到的产甲烷古菌分布于3个纲、6个目、15科、33属共计155个种。从1972年[5]第一株热自养产甲烷杆菌的分离到现在,研究人员已经从多种生境中分离到了数十株热自养产甲烷杆菌,它们被划分成6个种[6]。嗜热产甲烷杆菌属Methanothemobacter是高温油藏中较为普遍的一类产甲烷古菌,同时这类产甲烷古菌也广泛分布于高温人工厌氧反应器的活性污泥中。菌株 DL-7分离于大港油田油藏采出水,它与嗜热产甲烷杆菌属中菌株M. marburgensisDSM2133T(X15364) 的16S rRNA基因序列相似性为99.7%,它只能利用H2/CO2生长,代时较长,约为6 h,生长温度为47℃~68℃。
1 材料与方法
1.1 样品
样品取自大港油田庄海8背斜区块3号采油井,该油井为非注水井,井顶深为3 364.59 m,井底深为4 098.41 m,油层有效厚度为733 m。原油密度为0.9543 g/mL(20℃下测得),粘度为 599.0 mPa·s (50℃下测得)。油藏温度65℃~75℃。
1.2 富集、分离和纯化
1.2.1培养基
采用亨盖特厌氧操作改良技术[7]分离纯化。富集培养[8]采用 MB培养基,分离培养基采用Medi2um141 (DSMZ),纯化培养基采用Medium 119(DSMZ)。
1.2.2操作方法
采用亨盖特厌氧操作改良技术进行液体梯度稀释和固体滚管分离纯化。25 mL厌氧管或120 mL血清瓶中加入无氧培养基,顶空为氮气,121℃高压灭菌30 min,接种后充入H2+CO2(V/V=4∶1,最终压力约200 kPa) 混合气,60℃培养。
1.3 形态观察
采用荧光相差显微镜和扫描电子显微镜观察菌体形态,电镜照片的制作参见文献[9]。
1.4 生理生化鉴定
检测:使用Nikon Eclipse 80i相差显微镜观察,用Nikon DXM-1200C相机拍照:甲烷含量的测定采用岛津GC-2010气相色谱仪;电镜照片采用AMRAY扫描电镜观察拍照[9]。
1.4.1生理实验
生长条件测定包括最适pH值、最适生长温度和最适NaCl浓度试验。
1.4.2生化实验
底物实验、刺激因子实验、抗生素敏感性实验均采用改良的Medium141无机盐培养基。
不同底物 (终浓度) 利用实验:H2/CO2(V/V=20 mL/5 mL)、甲酸盐 (50 mmol/L)、甲醇(50 mmol/L)、甲胺 (50 mmol/L)、三甲胺(50 mmol/L)、乙酸盐 (50 mmol/L)、乙醇(50 mmol/L)分别作为唯一碳源。
不同刺激因子 (终浓度) 实验:酵母粉0.2%、胰酶解酪蛋白0.2%、复合维生素溶液1%(V/V)、微量元素溶液 1%(V/V)、瘤胃浸提液 1%(V/V)、污泥浸提液 1%(V/V)、NaAC 50%、NiCl20.02%、Na2WO40.02%、Na2MoSO40.02%、HS-CoM 0.025%。
不同抗生素抑制实验:红霉素、卡那霉素、链霉素、氨苄青霉素、利福平、氯霉素,终浓度均为200 μg/mL。
1.5 16S rRNA序列扩增、测序及系统发育树构建
1.5.116S rRNA基因扩增与测序
提取基因组 DNA作为模板,用产甲烷菌 16S rRNA特异性引物进行 PCR扩增。正向引物Met-86F:5′-GCTCAGTAACACGTGG-3′,反向引物Met-1340R:5′-CGGTGTGTGCAAGGAG-3′。PCR反应条件:94℃预变性3 min;94℃变性30s,58℃退火 30s,72℃延伸 1.5 min,40 个循环;72 ℃ 10 min 。1%琼脂糖电泳,回收产物与载体pMD-18连接,转化至E. coliJM109,送上海生工生物工程技术服务有限公司测序。
1.5.2系统发育树的构建
将菌株的 16S rRNA测序结果提交 GenBank核酸序列数据库进行BLAST,使用Clustalx(1.83)软件将与之同源性较高的产甲烷菌的16S rRNA序列进行比对,通过MEGA(4.1) 软件采用邻位相邻法绘出系统发育树并进行 Bootstape稳定性检验(1 000 次)[10]。
1.6 (G+C) mol%含量的测定
根据热变性温度法[11](Tm值法) 测定基因组(G+C) mol%。测定菌株 DNA 的热变性温度 (Tm值),同时测定E. coliK12的Tm值。根据公式[11](G+C) mol%=51.2+2.08×[Tm(X)−Tm(K12)]计算出(G+C) mol%。
2 结果与分析
2.1 形态特征
实验表明,菌株DL-7革兰氏染色呈阳性,菌体表面光滑无鞭毛,不运动,直径 0.35~0.45 μm,长2.5 μm~5 μm,具有弯曲和直杆微弯2种形态,单生、成对、多数成聚集状态存在。60℃培养10 d长出菌落,菌落淡黄色、圆形、边缘整齐。于紫外光(420 nm) 下产生绿色荧光,图1为液体培养条件下处于对数生长期的荧光照片,图 2液体培养基中菌体扫描电镜照片。

图1 DL-7紫外荧光显微照片 (100×)Fig.1 Fluorescence micrograph of strain DL-7 (100×).
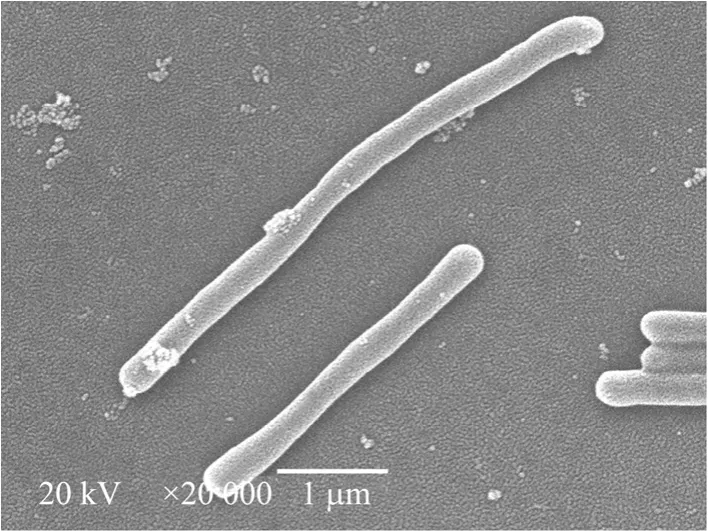
图2 DL-7扫描电镜照片Fig.2 Electron micrograph of strain DL-7.
2.2 生理生化特征
2.2.1生理特征
菌株DL-7生长温度范围为47℃~68℃,最适温度为 60℃(图 3)。实验发现,菌株 DL-7生长 pH 6.0~8.5,最适pH为7.0~7.5 (图4)。最适NaCl浓度为0.8 g/L (图5)。表1是菌株DL-7与甲烷杆菌属中几株菌的主要性状比较。由表1可见,DL-7菌株与其他几株在最适生长温度及分离源上有较大差别。
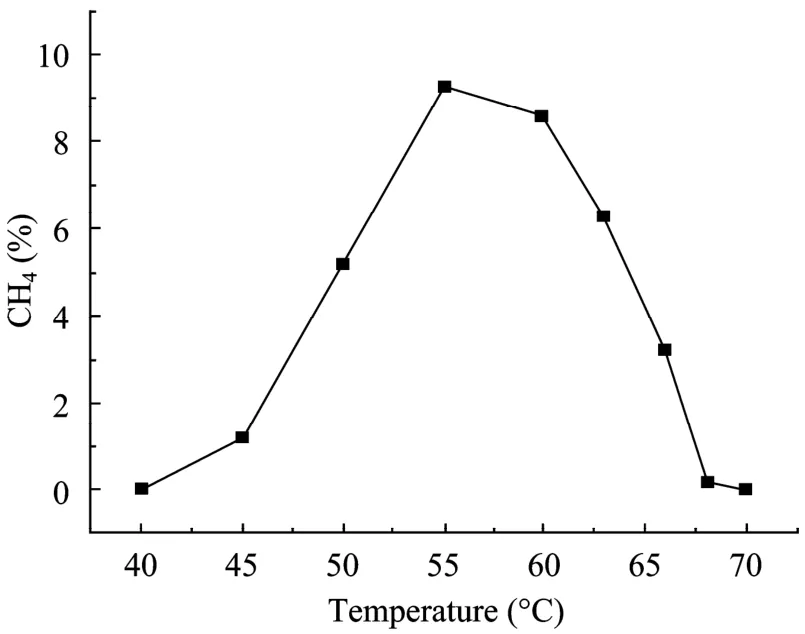
图3 温度对菌株DL-7生长的影响Fig.3 Effect of temperate on the growth of strain DL-7.

图4 pH对菌株DL-7生长的影响Fig.4 Effect of pH on the growth of strain DL-7.
2.2.2生化特征
底物实验结果表明,菌株DL-7只能利用H2/CO2为底物生长,不利用甲酸、甲醇、三甲胺、乙酸、乙醇等。
抗生素实验的结果表明,菌株DL-7对红霉素、卡那霉素、链霉素、氨苄青霉素、利福平等抗生素均有抗性,对氯霉素敏感。

表1 DL-7与几株热自养产甲烷菌主要性状的比较Table 1 Comparison between strain DL-7 and other most closely strains ofMethanothemobacter
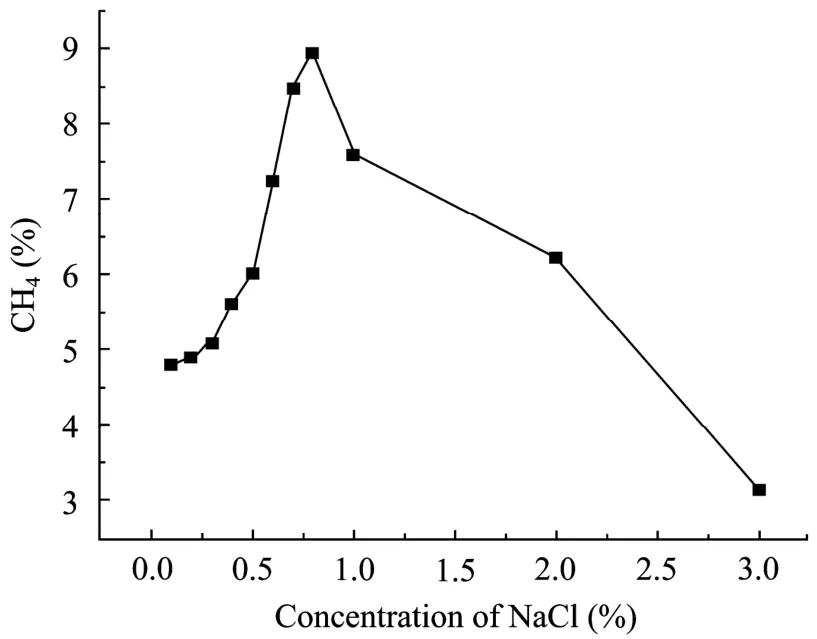
图5 不同盐浓度对菌株DL-7生长的影响Fig.5 Effect of salinities on the growth of strain DL-7.
表1是DL-7菌株与几株热自养甲烷菌主要性状的比较。由表1可见,DL-7菌株与其他几株在最适生长温度、最适pH值、分源等有明显的不同。
2.3 16S rRNA序列的测定及系统发育树构建菌株
菌株DL-7 的 16S rRNA 部分序列长 958 bp。根据菌株 DL-7 16S rRNA 测序结果进行 BLASTn分析,菌株 DL-7与M. marburgensisDSM 2133T(X15364) 的16S rRNA基因序列相似性为99.7%。菌株 DL-7 与嗜热产甲烷杆菌属其他菌株的系统发育分析结果见图6。
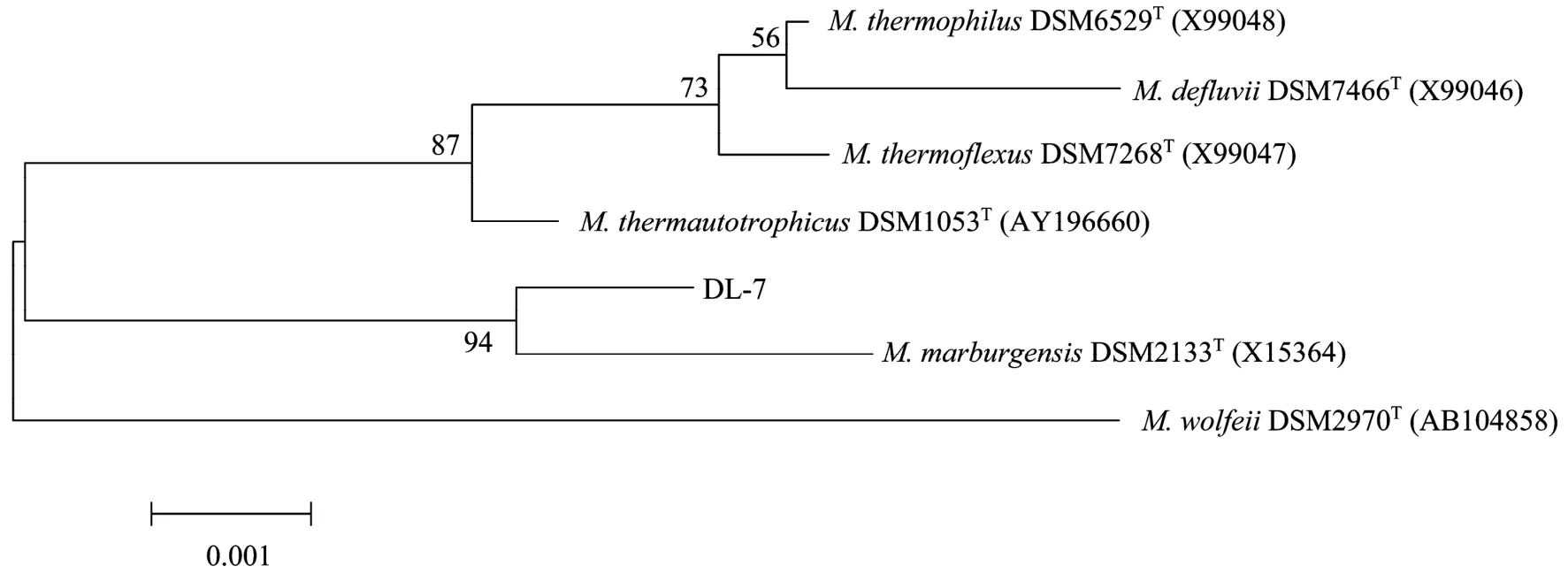
图6 基于16S rRNA序列相似性构建的系统发育树Fig.6 Phylogenetic tree based on the 16S rRNA sequences.
3 讨论
虽然DL-7的16S rRNA与M. marburgensisDSM 2133T的相似性高达99.7%,但是二者在部分生理生化特征和G+C含量2个指标上还是有较大差异。其确切分类地位还有待用 DNA分子杂交[12]的技术手段作进一步的鉴定。
高温油藏环境经历了漫长的地质年代的演化过程,作为一个典型的高温高压高矿化度的极端厌氧环境,其内部的微生物菌群结构和物质能量的代谢方式必然有其特殊性。产甲烷菌处于油藏厌氧环境中物质代谢的最后控制环节,它的生长特性必然影响着整个物质传递链中各类菌群的代谢生长,同时产甲烷古菌的生长也必然受控于其上游整个菌群的生长代谢。因此,分离和研究高温油藏中产甲烷古菌的代谢特征对我们认识油藏环境中整个物质能量代谢特征有极其重要的意义。
产甲烷古菌以其特殊的代谢方式参与地球生物圈中的碳素循环,其代谢产物甲烷既是导致全球气候变暖的第二大温室气体[13],同时又是最有前景的可再生新能源载体之一。探索研究产甲烷菌的进化历史、分布范围和代谢特征,已经成为地球化学、环境化学、生物化学和微生物学等多学科交叉的研究热点。
高温沼气发酵工程作为人工控制的高温厌氧产甲烷代谢体系,与高温油藏厌氧发酵具有很多相似之处。在高温沼气发酵过程中,产甲烷菌群无疑是整个发酵代谢中最为重要的一环,它们控制着整个代谢过程的速率。目前分离自高温人工厌氧生物反应器的产甲烷古菌很大一部分属于嗜热产甲烷杆菌属,通过对该类产甲烷菌群的研究有助于我们对整个高温产甲烷发酵体系的认识,从而更好指导我们对高温产甲烷发酵工程的设计、调试和运行。
REFERENCES
[1] Ueno Y, Yamada K, Yoshida N,et al.Evidence from fluid inclusions for microbial methanogenesis in the early Archaean era.Nature, 2006, 440: 516−519.
[2] Jones DM, Head IM, Gray ND,et al.Crude-oil biodegradation via methanogenesis in subsurface petroleum reservoirs.Nature, 2007, 451: 176−180.
[3] Cheng L, Qiu TL, Yin XB,et al.Methermicoccus shengliensisgen. nov., sp. nov., a thermophilic,methylotrophic methanogen isolated from oil-production water, and proposal ofMethermicoccaceae fam. nov..Int J Syst Evol Microbiol, 2007, 57: 2964.
[4] Cheng L, Qiu TL, Li X,et al.Isolation and characterization ofMethanoculleus receptaculisp. nov.from Shengli oil field, China.FEMS Microbiol Lett, 2008,285: 65−71.
[5] Zeikus JG, Wolee RS.Methanobacterium thermoautotrophicussp. n., an anaerobic, autotrophic, extreme thermophile.JBacteriol, 1972, 109: 707.
[6] Wasserfallen A, Nolling J, Pfister P,et al.Phylogenetic analysis of 18 thermophilicMethanobacteriumisolates supports the proposals to create a new genus,Methanothermobactergen. nov., and to reclassify several isolates in three species,Methanothermobacter thermautotrophicuscomb. nov.,Methanothermobacter wolfeiicomb. nov., andMethanothermobacter marburgensissp. nov..Int J Syst Evol Microbiol, 2000, 50: 43.
[7] Balch WE, Wolfe RS. New approach to the cultivation of methanogenic bacteria: 2-mercaptoethanesulfonic acid(HS-CoM)-dependent growth ofMethanobacterium ruminantiumin a pressureized atmosphere.Appl Environ Microbiol, 1976, 32: 781.
[8] Romesser JA, Wolfe RS, Mayer F,et al.Methanogenium,a new genus of marine methanogenic bacteria, and characterization ofMethanogenium cariacisp. nov. andMethanogenium marisnigrisp. nov..Arch Microbiol,1979, 121: 147−153.
[9] Qiu TL, Cheng L, Luo H,et al.Isolation and characterization of methanogens from sediments in Jiaozhou Bay.China Biogas, 2007, 25: 3−6.
仇天雷, 承磊, 罗辉,等.一株近海沉积物中产甲烷菌的分离及鉴定. 中国沼气, 2007, 25: 3−6.
[10] Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees.Mol Biol Evol, 1987, 4: 406.
[11] Mandel M, Marmur J. Use of ultraviolet absorbance-temperature profile for determining the guanine plus cytosine content of DNA.Methods Enzymol,1968, 12: 195−206.
[12] Gonzalez JM, Saiz-Jimenez C. A simple fluorimetric method for the estimation of DNA−DNA relatedness between closely related microorganisms by thermal denaturation temperatures.Extremophiles, 2005, 9: 75−79.
[13] Ren R. Man-made sources of methane emissions and technologies for reducing methane emissions.Environment Herald, 2000, 4: 42−43.
任仁. 温室气体甲烷的人为源及其减排的技术措施. 环境导报, 2000, 4: 42−43.
Isolation and identification of a methanogen from the high temperature oil reservoir water
Haichang Liu1, Guihong Lan2, Quanquan Liu1, Wenjing Zhang1, Yi Cao2, Yu Deng1,and Hui Zhang1
1Key Laboratory of Energy Microbiology and Application,Chengdu610041,China
2School of Life Science,Sichuan University,Chengdu610065,China
Received:May 22, 2010;Accepted:July 6, 2010
Supported by:National Natural Science Foundation of China (No. 40973059).
Corresponding author:Hui Zhang. Tel/Fax: +86-28-85258573; E-mail: zhanghuits@yahoo.com.cn
国家自然科学基金 (No. 40973059) 资助。

